Лечение макулярного отека у пациентов после лучевой терапии увеальной меланомы с применением дексаметазонового имплантата
- Аннотация
- Статья
- Ссылки
- English
Цель – представить первый опыт ИВВД при макулярном отеке (МО), развившемся после ЛТ УМ.
Материал и методы. За период с 2022 по 2025 г. в ФГАУ НМИЦ «МНТК „Микрохирургия глаза” им. академика С.Н. Федорова» ИВВД выполнено 130 пациентам (39 (30%) мужчин, 91 (70%) женщина; 130 глаз) с МО, развившимся на фоне ЛТ УМ. Средний возраст пациентов составил 56 ± 13 лет (от 26 до 86 лет), средняя максимальная корригированная острота зрения (МКОЗ) в момент постановки диагноза МО – 0,25 (Q1 0,08; Q2 0,4).
По данным оптической когерентной томографии (ОКТ), среднее значение центральной толщины сетчатки (ЦТС) в момент постановки диагноза МО составило 439 ± 188 мкм (от 158 до 916 мкм), среднее значение объема куба (ОК) – 12 ± 3 мм3 (диапазон от 6 до 22 мм3).
Результаты. МКОЗ после ИВВД составила 0,3 (Q1 0,05; Q3 0,61; p = 0,039). Согласно полученным данным, у 43 (33%) пациентов произошла стабилизация процесса, у 40 (31%) – улучшение. По данным ОКТ, среднее значение ЦТС после ИВВД достигло 257 ± 61 мкм (от 125 до 368 мкм) и существенно отличалось от исходного значения ЦТС (до введения) – 439 ± 188 мкм (p < 0,001). Среднее значение ОК составило 10 ± 2 мм3 (от 6 до 15 мм3) и также значимо отличалось от исходного уровня (до введения) – 12 ± 3 мм3 (p = 0,001).
Заключение. Мы впервые в России применили ИВВД при МО, развившемся на фоне ЛТ УМ. ИВВД ассоциируется со снижением ЦТС и повышением зрительных функций.
Цель – представить первый опыт ИВВД при макулярном отеке (МО), развившемся после ЛТ УМ.
Материал и методы. За период с 2022 по 2025 г. в ФГАУ НМИЦ «МНТК „Микрохирургия глаза” им. академика С.Н. Федорова» ИВВД выполнено 130 пациентам (39 (30%) мужчин, 91 (70%) женщина; 130 глаз) с МО, развившимся на фоне ЛТ УМ. Средний возраст пациентов составил 56 ± 13 лет (от 26 до 86 лет), средняя максимальная корригированная острота зрения (МКОЗ) в момент постановки диагноза МО – 0,25 (Q1 0,08; Q2 0,4).
По данным оптической когерентной томографии (ОКТ), среднее значение центральной толщины сетчатки (ЦТС) в момент постановки диагноза МО составило 439 ± 188 мкм (от 158 до 916 мкм), среднее значение объема куба (ОК) – 12 ± 3 мм3 (диапазон от 6 до 22 мм3).
Результаты. МКОЗ после ИВВД составила 0,3 (Q1 0,05; Q3 0,61; p = 0,039). Согласно полученным данным, у 43 (33%) пациентов произошла стабилизация процесса, у 40 (31%) – улучшение. По данным ОКТ, среднее значение ЦТС после ИВВД достигло 257 ± 61 мкм (от 125 до 368 мкм) и существенно отличалось от исходного значения ЦТС (до введения) – 439 ± 188 мкм (p < 0,001). Среднее значение ОК составило 10 ± 2 мм3 (от 6 до 15 мм3) и также значимо отличалось от исходного уровня (до введения) – 12 ± 3 мм3 (p = 0,001).
Заключение. Мы впервые в России применили ИВВД при МО, развившемся на фоне ЛТ УМ. ИВВД ассоциируется со снижением ЦТС и повышением зрительных функций.
Актуальность
В настоящее время лечение увеальной меланомы (УМ) имеет выраженную органосохраняющую направленность, что прежде всего обусловлено отсутствием различий в выживаемости при проведении энуклеации и при использовании методов лечения с сохранением глаза [1]. При этом среди основных принципов ведения пациентов с УМ, которыми руководствуется мировое офтальмоонкологическое сообщество, – сохранение жизни пациента, сохранение глаза и сохранение зрения – особое значение имеют функциональные результаты, а именно зрительные функции.
На сегодняшний день в авангарде органосохраняющего лечения УМ стоит лучевая терапия (ЛТ) в виде брахитерапии (БТ), протонотерапии и стереотаксической радиохирургии [2]. Органосохраняющее лечение демонстрирует высокую эффективность при УМ даже больших размеров, тем не менее не лишено риска развития осложнений, к основным из которых относится нейро- и ретинопатия [3]. Макулярный отек (МО) лучевого генеза является основной причиной снижения зрения пациентов после органосохраняющего лечения, что, безусловно, сказывается на качестве их жизни [4].
Несмотря на достаточно солидный опыт использования лучевых методов при УМ, пока нет четких схем лечения МО. Зарубежные публикации, посвященные интравитреальному введению дексаметазона (ИВВД), немногочисленны. Опыт ИВВД у пациентов с МО лучевого генеза в Российской Федерации отсутствует [5]. Тем не менее необходимо отметить, что, по данным зарубежной литературы, случаев роста или рецидива опухоли после ИВВД при лучевом МО не выявлено [6, 7].
Цель – представить первый опыт ИВВД при МО, развившемся после ЛТ УМ.
Материал и методы
За период с 2022 по 2025 г. в МНТК «Микрохирургия глаза» им. академика С.Н. Федорова ИВВД при МО, развившемся после ЛТ УМ, выполнено 130 пациентам (39 (30%) мужчин, 91 (70%) женщина; 130 глаз). Средний возраст пациентов составил 56 ± 13 лет (26–86 лет). Максимальная высота УМ до проведения ЛТ варьировала от 2,2 до 10 мм (средняя – 5,3 ± 2 мм), протяженность – от 4,19 до 17,4 мм (средняя – 10 ± 3 мм). Вторичная отслойка сетчатки имела место в 12 (33%) случаях, а ее средняя высота достигала 2,4 ± 0,4 мм (от 0,3 до 6,6 мм).
БТ с Ru-106 выполнялась в 130 случаях. Время до возникновения МО после ЛТ в среднем составило 6 ± 4 месяца (1–24 месяца). При БТ доза на склеру составила в среднем 932 ± 309 Гр (392–1472 Гр), а на вершину – 135 ± 14 Гр (117–170 Гр).
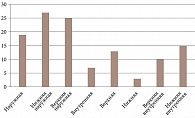
Юкстапапиллярная локализация опухоли наблюдалась в 4 (6%) глазах. После лечения в них развилась сочетанная нейро- и ретинопатия (в виде МО) из-за непосредственной близости зоны облучения и диска зрительного нерва. В 71 (55%) глазу в процесс была вовлечена наружная полусфера глазного яблока. Распределение опухолей по локализации представлено на риcунке.
Средняя максимальная корригированная острота зрения (МКОЗ) в момент выявления МО составила 0,25 (Q1 0,08; Q2 0,4).
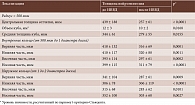
Данные оптической когерентной томографии (ОКТ): среднее значение центральной толщины сетчатки (ЦТС) – 439 ± 188 мкм (158–916 мкм), объем куба (ОК) – 12 ± 3 мм3 (6–22 мм3), средняя толщина куба (СТК) – 344 ± 61 мкм (239–523 мкм) (таблица).
ИВВД осуществлялось по стандартной методике согласно аннотации к препаратам: пред- и послеоперационная инстилляция антисептиков (пиклоксидина гидрохлорид), местная анестезия глазными каплями с инокаином, интравитреальная инъекция дексаметазонсодержащего биодеградируемого имплантата Озурдекc (Allergan Pharmaceuticals Ireland, Ирландия) в дозе 0,7 мг по методике trans pars plana (трансвитреальная тонкоигольная аспирационная биопсия). Инъекция выполнялась вне зоны проекции опухоли на склеру с предпочтительным выбором противоположного опухоли сектора.
Что касается среднего количества инъекций, 110 пациентам выполнена одна инъекция, 15 – две, пяти – три. ИВВД проводилось с трехмесячным интервалом.
Через полтора месяца после каждой инъекции осуществлялся контроль эффективности лечения, включавший офтальмоскопию, визометрию, измерение внутриглазного давления (ВГД), проведение ОКТ.
Статистическую обработку данных выполняли с использованием программного обеспечения Google Sheets (Google LLC), MedCalc 19.5.3 (MedCalc Software Ltd, Бельгия) и Microsoft Office Excel 2019 (Microsoft, США). В рамках описательной статистики рассчитывали минимальное и максимальное значения, медиану (Ме), первый и третий квартили (Q1; Q3), среднее значение, стандартное отклонение (σ). Результаты представлены в виде среднего значения ± σ при нормальном распределении и в виде Ме (Q1; Q3) при его отсутствии.
Распределение показателей в группах оценивали на основании критериев Колмогорова – Смирнова и Шапиро – Уилка. Достоверность различий зависимых выборок проверяли на основании парного t-критерия Стьюдента, в отсутствие нормального распределения – исходя из критерия Уилкоксона. Отличия считали статистически значимыми при p < 0,05.
Результаты
Положительный эффект от ИВВД при МО наблюдался в 64% случаев: у 40 (31%) пациентов зафиксировано улучшение МКОЗ, у 43 (33%) – ее стабилизация. Средний показатель ОЗ после ИВВД в момент последнего визита в среднем увеличился и составил 0,3 (Q1 0,05; Q3 0,61), что значимо отличалось от значения до введения – 0,25 (p = 0,039).
Показатели ОЗ стабилизировались в течение двух-трех месяцев.
Среднее значение ЦТС после лечения определялось на уровне 263 ± 74 мкм (р < 0,0001), ОК – 10 ± 2 мм3 (р = 0,0168), СТК – 279 ± 55 мкм (p = 0,0155).
По данным ОКТ, среднее значение ЦТС после ИВВД составило 257 ± 61 мкм (125–368 мкм), что значимо отличалось от значения ЦТС до введения – 439 ± 188 мкм (p < 0,001), а среднее значение ОК – 10 ± 2 мм3 (6–15 мм3), что также значимо отличалось от значения ОК до введения – 12 ± 3 мм3 (p = 0,001).
Рецидивы МО после ИВВД отмечались у 20 (15%) пациентов в течение 2,5 ± 1 месяц и потребовали повторного ИВВД.
У 2 (6%) пациентов в периоде наблюдения были выявлены осложнения в виде повышения уровня ВГД до 30 мм рт. ст. Этим пациентам назначали местную гипотензивную терапию в виде инстилляций тимолола 0,5%. Развитие заднекапсулярной катаракты выявлено у трех пациентов. Им проведена факоэмульсификация катаракты с имплантацией интраокулярной линзы.
Обсуждение
МО, обусловленный ЛТ, – предсказуемое осложнение у пациентов с УМ [5]. Несмотря на это, работ, посвященных методам борьбы с данным осложнением, недостаточно для выбора оптимальной тактики лечения. В своей предыдущей работе мы подчеркивали недостаток статей, описывающих интравитреальное введение ингибиторов ангиогенеза (ИВВИАГ) при МО после ЛТ [2]. Исследования ИВВД при МО после ЛТ немногочисленны.
L. Frizziero и соавт. [8] изучали эффективность имплантата. Среднее время возникновения МО после ЛТ составило 23 месяца, средняя МКОЗ до ИВВД – 61 строчка ETDRS, ЦТС – 407 мкм. Среднее снижение ЦТС определялось на уровне 148 мкм, МКОЗ увеличилась до 6,5 строчки ETDRS. Стабилизацию ЦТС авторы наблюдали до трех месяцев, а МКОЗ оставалась неизменной в течение двух месяцев, затем началось ее снижение.
K.M. Bui и соавт. [9] также отмечали эффективность ИВВД при МО лучевого генеза, более продолжительную стабилизацию нормальной архитектоники сетчатки по сравнению с ИВВИАГ и интравитреальным триамцинолоном.
Следует отметить резистентность МО, обусловленного ЛТ, к ИВВИАГ. Несмотря на ежемесячные введения ИВВИАГ, высота нейроэпителия и показатели МКОЗ не изменялись в большинстве случаев хронизации процесса и выполнения ЛТ в непосредственной близости от зрительного нерва. Так, в исследовании J.M. Caminal и соавт. [10] значения ЦТС снизились с 416 до 254 мкм, а повышение показателей МКОЗ было статистически недостоверным. Из 12 случаев с МО до ИВВД в двух выполнялась лазеркоагуляция, в двух – ИВВИАГ, в пяти – комбинированная терапия: лазеркоагуляция и ИВВИАГ. У всех пациентов отмечалась персистенция МО. Для определения эффективности ИВВД использовалась классификация МО N. Horgan [11]: у двух пациентов имела место третья стадия, у одного – четвертая, у восьми – пятая. У одного пациента МО не классифицирован из-за твердых экссудатов. Результаты распределились следующим образом: у шести пациентов МО редуцировался, у одного пациента зафиксирована первая стадия, у двух – вторая, у двух – пятая. Только один пациент получил две инъекции, остальные – одно ИВВД. У трех пациентов, у которых наблюдались твердые экссудаты, отмечалась их частичная регрессия после ИВВД.
I. Seibel и соавт. [12] предложили при лучевой нейропатии использовать интравитреальный дексаметазон. Из 78 пациентов 38 (48,7%) получили инъекции бевацизумаба, 35 (44,9%) – триамцинолона ацетонида и 5 (6,4%) – имплантат с дексаметазоном. В группе бевацизумаба острота зрения улучшилась у 11 (28,9%) пациентов на 0,25 LogMAR (0,1–0,4 LogMAR), оставалась стабильной у 24 (63,2%) пациентов через четыре недели после инъекции. В группе триамцинолона показатели остроты зрения улучшились у 10 (28,6%) пациентов на 0,25 LogMAR (0,1–0,4 LogMAR), а функции стабилизировались у 20 (57,1%). Через четыре недели после имплантации дексаметазона острота зрения оставалась стабильной у 4 (80%) пациентов. Различий между группами в отношении функциональных результатов или уменьшения толщины центральной фовеальной области не установлено.
D. Eckstein и соавт. сравнивали интравитреальную терапию с естественным течением лучевой оптической нейропатии после первичной протонно-лучевой терапии меланомы хориоидеи в отношении долговременной остроты зрения и развития атрофии зрительного нерва [13]. Из 93 пациентов 48 наблюдались только после лучевой оптической нейропатии, а 45 получали интравитреальную терапию (триамцинолон, бевацизумаб и/или дексаметазон). Средний период наблюдения составил 55 месяцев (29–187 месяцев); средний интервал между началом лучевой оптической нейропатии и последним посещением пациента – 34 месяца (24–125 месяцев). Из 48 участников исследования у 41 (85,4%) развилась атрофия зрительного нерва в среднем через 14 месяцев (3–86 месяцев) после лучевой оптической нейропатии. Из 45 пациентов, получавших интравитреальное лечение, у 34 (75,5%) наблюдалась атрофия зрительного нерва в среднем через 12,5 месяца (1–55 месяцев) после развития нейропатии зрительного нерва. Это указывает на отсутствие статистически значимых различий между группами. Сравнивая изменение остроты зрения с момента возникновения оптической нейропатии до достижения конечной остроты зрения, исследователи не обнаружили статистически значимых различий между группами (p = 0,579).
Следует отметить, что в нашем исследовании улучшение МКОЗ отмечалось в 75% случаев.
Заключение
ИВВД при лечении МО снижает высоту МО, улучшая или стабилизируя ОЗ и обеспечивая продолжительный положительный эффект.
Положительный эффект от ИВВД при МО наблюдался в 64% случаев: у 40 (31%) пациентов отмечалось улучшение МКОЗ, у 43 (33%) – ее стабилизация. Средний показатель ОЗ после ИВВД в момент последнего визита в среднем повысился и составил 0,3 (Q1 0,05; Q3 0,61, p = 0,039).
В нашем исследовании регресс МО по данным ОКТ был достигнут в 83 (64%) случаях.
Финансирование. Авторы не получали конкретного гранта на это исследование от какого-либо финансирующего агентства в государственном, коммерческом и некоммерческом секторах.
Соответствие действующим критериям авторства ICMJE. Авторы подтверждают соответствие.
Согласие пациентов на публикацию. Письменного согласия на публикацию данного материала не получено. Он не содержит никакой личной идентифицирующей информации.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
V.A. Yarovaya, PhD, Ye.O. Malakshinova, A.A. Yarovoy, PhD
Interdisciplinary Scientific and Technical Complex ‘Eye Microsurgery’ named after Academician S.N. Fedorov
Contact person: Yekaterina O. Malakshinova, ekaterinamalakshinova@yandex.ru
Relevance. The triune task of treating uveal melanoma (UM) with organ-preserving radiation therapy (RT) is to preserve the patient's life, eye and vision. The most common cause of vision loss is radiation neuro- and retinopathy. Such complications reduce not only visual acuity, but also the patient's quality of life. According to modern foreign literature, intravitreal administration of dexamethasone (IVAD) improves and/or stabilizes the eye, restoring the architecture of the retina.
The aim is to present the first experience of IVAD in macular edema (ME), which developed after RT of UM.
Material and methods. For the period from 2022 to 2025 at the Interdisciplinary Scientific and Technical Complex ‘Eye Microsurgery’ named after Academician S.N. Fedorov IVAD was performed in 130 patients (39 (30%) men, 91 (70%) women; 130 eyes) with ME developed on the background of RT of UM. The average age of the patients was 56 ± 13 years (from 26 to 86 years). The average maximum corrected visual acuity (CVA) at the time of diagnosis of ME was 0.25 (Q1 0.08; Q2 0.4).
According to optical coherence tomography (OCT), the average value of the central retinal thickness (CRT) at the time of diagnosis of ME was 439 ± 188 microns (from 158 to 916 microns), the average cube volume (CV) was 12 ± 3 mm3 (range from 6 to 22 mm3).
Results. The average maximum CVA after IVAD was 0.3 (Q1 0.05; Q3 0.61; p = 0.039). According to the received data, 43 (33%) patients had stabilization of the process, 40 (31%) showed improvement. According to the OCT data, the average value of the CRT after IVAD was 257 ± 61 microns (from 125 to 368 microns), which was significantly different from the initial value of the CRT (before administration) – 439 ± 188 microns (p < 0.001), and the average value of CV – 10 ± 2 mm3 (from 6 to 15 mm3), which it significantly differed from the CV value before administration – 12 ± 3 mm3 (p = 0.001).
Conclusion. This is the first time in Russia that we have used IVAD in the case of ME, which has developed against the background of RT of UM. IVAD is associated with a decrease in CRT and an increase in visual functions in ME, which developed after RT of UM.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.