Первый опыт применения бролуцизумаба при диабетическом макулярном отеке
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проанализированы результаты загрузочной фазы бролуцизумаба (пять интравитреальных инъекций) у четырех пациентов с диффузным ДМО.
Результаты. Пациент У., 53 года: OS: максимально корригированная острота зрения (МКОЗ) – 0,3, толщина фовеолярной зоны сетчатки (ТФС) – 495 мкм, кистозные полости в слое нейроэпителия, скопление жидкости субретинально на фоне непролиферативной диабетической ретинопатии (ДР). По окончании курса лечения достигнут полный регресс диффузного отека макулы: ТФC – 230 мкм, МКОЗ – 0,8. Пациент С., 76 лет: OD: МКОЗ – 0,4, ТФС – 430 мкм, множественные интраретинальные кисты на фоне пролиферативной ДР. После курса лечения ТФС снизилась до 255 мкм, МКОЗ – до 0,5. Пациент Р., 71 год: OS: МКОЗ – 0,3, ТФС – 401 мкм, кистозные полости в слое нейроэпителия, препролиферативная ДР. К концу курса лечения ТФС снизилась до 297 мкм, МКОЗ повысилась до 0,5. Пациент М., 67 лет: ОS: МКОЗ – 0,05, ТФС – 571 мкм, обширные кистозные полости в слое нейроэпителия, пролиферативная ДР. К концу курса лечения ТФС – 230 мкм, МКОЗ – 0,1.
Заключение. Полученные первоначальные результаты показывают высокую эффективность бролуцизумаба в лечении раннего отека с исходно высокой зрительной функцией. Для объективной оценки эффективности лечения у пациентов с далеко зашедшей стадией заболевания, большой давностью отека необходимы дальнейшие исследования с более длительным наблюдением и большей выборкой.
Материал и методы. Проанализированы результаты загрузочной фазы бролуцизумаба (пять интравитреальных инъекций) у четырех пациентов с диффузным ДМО.
Результаты. Пациент У., 53 года: OS: максимально корригированная острота зрения (МКОЗ) – 0,3, толщина фовеолярной зоны сетчатки (ТФС) – 495 мкм, кистозные полости в слое нейроэпителия, скопление жидкости субретинально на фоне непролиферативной диабетической ретинопатии (ДР). По окончании курса лечения достигнут полный регресс диффузного отека макулы: ТФC – 230 мкм, МКОЗ – 0,8. Пациент С., 76 лет: OD: МКОЗ – 0,4, ТФС – 430 мкм, множественные интраретинальные кисты на фоне пролиферативной ДР. После курса лечения ТФС снизилась до 255 мкм, МКОЗ – до 0,5. Пациент Р., 71 год: OS: МКОЗ – 0,3, ТФС – 401 мкм, кистозные полости в слое нейроэпителия, препролиферативная ДР. К концу курса лечения ТФС снизилась до 297 мкм, МКОЗ повысилась до 0,5. Пациент М., 67 лет: ОS: МКОЗ – 0,05, ТФС – 571 мкм, обширные кистозные полости в слое нейроэпителия, пролиферативная ДР. К концу курса лечения ТФС – 230 мкм, МКОЗ – 0,1.
Заключение. Полученные первоначальные результаты показывают высокую эффективность бролуцизумаба в лечении раннего отека с исходно высокой зрительной функцией. Для объективной оценки эффективности лечения у пациентов с далеко зашедшей стадией заболевания, большой давностью отека необходимы дальнейшие исследования с более длительным наблюдением и большей выборкой.
Введение
Наиболее распространенной причиной снижения остроты зрения у больных сахарным диабетом (СД) является диабетический макулярный отек (ДМО). Он может развиваться на любой стадии диабетической ретинопатии (ДР) [1–5].
Долгое время стандартом лечения ДМО оставалась фокальная лазерная фотокоагуляция. Однако с внедрением в начале XXI в. анти-VEGF-терапии полностью изменились прогноз и возможности лечения заболевания [6–14].
Известно, что VEGF вырабатывается во многих типах клеток сетчатки (нейронах, мюллеровых клетках, астроцитах), в ретинальном пигментном эпителии, эндотелии, перицитах сосудов [15].
Посредством VEGF стимулируется рост новообразованных сосудов, формируется отек сетчатки. Гипергликемия служит мощным стимулятором секреции VEGF. Обнаружена прямая корреляция между концентрацией VEGF в стекловидном теле и выраженностью макулярного отека и ретинопатии [5, 16, 17].
Показанием к применению анти-VEGF-терапии при ДМО является толщина фовеолярной зоны сетчатки (ТФС) ≥ 250 мкм. Терапия показана при максимально корригированной остроте зрения (МКОЗ) в пределах 0,05–0,6.
Для достижения максимальных результатов лечение следует начинать с загрузочных инъекций [14, 18–21].
Последнее поколение анти-VEGF-препаратов, применяемых в офтальмологии, представлено препаратом бролуцизумаб. Его молекула является одноцепочечным фрагментом гуманизированного антитела человека (scFv), ингибитором VEGF-A молекулярной массой около 26 кДа. Бролуцизумаб препятствует связыванию VEGF-A с его рецепторами VEGFR1 и VEGFR2 и тормозит рост новообразованных сосудов.
Лекарственная форма бролуцизумаба в концентрации 120 мг/мл позволяет вводить 6 мг препарата в виде одной интравитреальной инъекции 50 мкл. Благодаря более высокой концентрации действующего вещества в одной вводимой дозе бролуцизумаба период его действия, а следовательно, интервал между инъекциями увеличивается. Это важное преимущество данного препарата перед аналогами.
Загрузочная фаза лечения бролуцизумабом предусматривает пять последовательных инъекций с шестинедельным промежутком. С 24-й недели интервалы между инъекциями увеличиваются до 12 недель [22].
Нами накоплен значительный опыт в изучении ДМО и применении ингибиторов ангиогенеза при возрастной макулярной дегенерации, миопической хориоидальной неоваскуляризации, ДМО [23–28].
Препарат бролуцизумаб прошел регистрацию в Минздраве России в 2020 г. В Хабаровском филиале Национального медицинского исследовательского центра «Межотраслевой научно-технический комплекс „Микрохирургия глаза“» имени академика С.Н. Федорова» Минздрава России его начали применять с 2021 г. для лечения неоваскулярной формы возрастной макулярной дегенерации.
С марта 2022 г. после проведения двухлетнего рандомизированного многоцентрового исследования III группы KESTREL и KITE бролуцизумаб используют при ДМО. Среди отечественных публикаций мы не обнаружили работ, посвященных оценке его эффективности при ДМО, поэтому сочли необходимым поделиться собственными первыми клиническими результатами.
Цель – оценить клиническую эффективность бролуцизумаба при ДМО.
Материал и методы
Проанализированы результаты загрузочной фазы лечения бролуцизумабом (пять интравитреальных инъекций) у четырех пациентов (четыре глаза) в возрасте 53–76 лет с диффузным ДМО. Все пациенты имели СД 2-го типа, его длительность варьировала от семи до 32 лет. Три пациента страдали гипертонической болезнью, четвертый – диабетической нефропатией стадии I.
Во всех случаях имел место диффузный ДМО. По данным оптической когерентной томографии (ОКТ) макулы (NIDEK RS-3000 Advance, Япония, протокол Macula Multi), исходная ТФС составила от 401 до 571 мкм. Ранее ни одному из пациентов не выполняли интравитреальных инъекций анти-VEGF-препаратов.
Исходная МКОЗ колебалась в пределах от 0,05 до 0,4. В двух глазах зафиксирована непролиферативная диабетическая ретинопатия (ДР), в третьем – препролиферативная ДР, в четвертом – пролиферативная ДР (согласно классификации E. Kohner и M. Porta, 1991) [29]. Двум пациентам ранее проводили сеансы панретинальной лазерной коагуляции сетчатки.
Каждому пациенту выполнили по пять последовательных инъекций бролуцизумаба с шестинедельным промежутком на основании инструкции к применению данного препарата [22].
Динамический мониторинг состояния макулы включал проведение бесконтактной офтальмоскопии макулы с линзой 90 дптр, ОКТ макулы, оценку ТФС и МКОЗ. Методом микропериметрии на фундус-микропериметре (MAIA, CenterVue, Италия) исследовали порог световой чувствительности макулы.
Срок наблюдения составил 35 недель, контрольный осмотр проводили спустя месяц после окончания загрузочной фазы лечения. В дальнейшем все пациенты продолжили получать интравитреальные инъекции данного препарата с увеличенным интервалом (каждые 12 недель).
Все пациенты благополучно завершили терапию. Из нежелательных побочных явлений зарегистрирована только умеренная болезненность в момент введения иглы. После каждой интравитреальной инъекции для профилактики развития внутриглазного воспаления пациентам назначали однократные инстилляции капель бромфенака 0,09% в течение двух недель и четырехкратные инстилляции левофлоксацина 0,5% на протяжении недели.
Результаты
Пациент У., 53 года. Жалобы на снижение остроты зрения левого глаза в течение двух месяцев. Страдает СД 2-го типа с 2015 г., принимает таблетированные препараты. Ранее операций на глазах не было, у офтальмолога регулярно не наблюдался. Уровень HbA1C – 6,3%. МКОЗ OD – 0,8, OS – 0,3. Уровень внутриглазного давления (ВГД) – 18 и 17 мм рт. ст. соответственно. Световая чувствительность макулы ОD/ОS – 26,2/23,5 dB, индекс состояния макулы – 44,8/98,4 усл. ед., фиксация центральная, стабильная.
Объективно: передние отрезки глаз спокойны, оптические среды прозрачны. При офтальмоскопии макулы в левом глазу выявлен кистозный отек. ОКТ макулы OS: ТФС – 495 мкм, в слоях нейроэпителия кистозные полости различных размеров, скопление жидкости интра- и субретинально. Диск зрительного нерва (ДЗН) бледно-розовый, контурирован, соотношение экскавации к диску (Э/Д) – 0,2. Вены расширены, во всех квадрантах множество мелких ретинальных геморрагий, микроаневризм, твердых экссудатов.
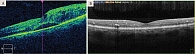
Диагноз: диффузный макулярный отек левого глаза, непролиферативная ДР обоих глаз. Назначен загрузочный курс интравитреальных инъекций бролуцизумаба в левый глаз. Перед второй инъекцией отмечалось уменьшение кистозных полостей в слое нейроэпителия, ТФС – 377 мкм, сохранялся диффузный отек сетчатки, МКОЗ OS – 0,4. Но после третьей инъекции произошла значительная редукция отека (ТФС – 258 мкм). При этом МКОЗ повысилась до 0,7. К концу загрузочной фазы офтальмоскопически отмечались значительная резорбция ретинальных геморрагий и микроаневризм, полный регресс диффузного отека макулы, ТФС уменьшилась до 230 мкм, МКОЗ повысилась до 0,8. Улучшились значения микропериметрии: световая чувствительность макулы возросла до 26,9 dB, индекс состояния макулы – 64,2 усл. ед. (рис. 1).
Пациент С., 76 лет. Жалобы на снижение остроты зрения правого глаза в течение четырех последних месяцев. С 2011 г. страдает СД 2-го типа, принимает инсулин и таблетированные препараты. Уровень HbA1С – 8%. Сопутствующая артериальная гипертония стадии II. В 2021 г. на обоих глазах проведены факоэмульсификация катаракты, панретинальная лазерная коагуляция сетчатки по поводу ДР.
OD/ОS: МКОЗ – 0,4/0,9, ВГД – 20/18 мм рт. ст., световая чувствительность макулы – 24,2/30,3 dB, индекс состояния макулы – 74,8/41,2 усл. ед., фиксация центральная, стабильная. Передний отрезок обоих глаз спокоен, на обоих глазах артифакия, интраокулярные линзы (ИОЛ) заднекамерные, центрированы. Офтальмоскопия обоих глаз: четкообразность ретинальных вен, их калибр неравномерный, видны зоны интраретинальных микрососудистых аномалий: в трех квадрантах на правом глазу и одном квадранте на левом глазу единичные ретинальные геморрагии, твердые экссудаты, в макуле правого глаза визуализируется кистозный отек, ретроэкваториально видны зоны ретинальной неоваскуляризации, следы лазеркоагуляции. Данные ОКТ: ТФС OD – 430 мкм, наличие множественных интраретинальных кист.
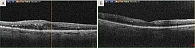
Диагноз: диффузный макулярный отек правого глаза, пролиферативная ДР обоих глаз. Назначен загрузочный курс интравитреальных инъекций бролуцизумаба. При осмотре перед второй инъекцией динамика ТФС отсутствовала (422 мкм), при этом МКОЗ снизилась до 0,2. Но после дальнейших инъекций отмечалась постепенная редукция ТФС с нарастанием МКОЗ. Через месяц после пятой инъекции ТФС снизилась до 255 мкм, МКОЗ повысилась до 0,5. Средняя световая чувствительность центральной зоны сетчатки OD возросла до 28,3 dB, индекс состояния макулы – до 59,2 усл. ед. На глазном дне зафиксировано уменьшение геморрагий и зон неоваскуляризации (рис. 2).
Пациент Р., 71 год. Жалобы на низкую остроту зрения левого глаза в течение последнего года. Страдает СД 2-го типа с 2012 г., максимальный уровень глюкозы крови – 15,0 ммоль/л. На момент явки в клинику длительно не принимал сахароснижающих препаратов, отменил их самостоятельно, придерживался нестрогой диеты, длительное время не был на приеме у эндокринолога. Сопутствующая артериальная гипертония 3-й степени, гипотензивные препараты принимает нерегулярно, периодически отмечает подъем уровня систолического артериального давления до 200 мм рт. ст.
ОD/OS: МКОЗ – 0,6/0,3, ВГД – 19/17 мм рт.ст., световая чувствительность макулы – 28,1/18,8 dB, индекс состояния макулы – 61,2/98,4 усл. ед., фиксация центральная, стабильная. Передние отрезки обоих глаз спокойны, двусторонний диффузный макулярный отек, геморрагии и интраретинальные микрососудистые аномалии во всех квадрантах. ОКТ левого глаза: две обширные кистозные полости в слое нейроэпителия, ТФС – 283/401 мкм. Начальные помутнения кортикальных слоев хрусталика.
Диагноз: диффузный макулярный отек, препролиферативная ДР обоих глаз.
Назначен курс инъекций бролуцизумаба в оба глаза. С учетом более тяжелой степени макулярного отека на левом глазу лечение было начато с него.
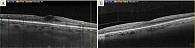
После второй инъекции бролуцизумаба наблюдалось снижение ТФС OS до 370 мкм, МКОЗ увеличилась до 0,4. Дальнейшая динамика была слабоположительной. Спустя месяц после пятой инъекции ТФС снизилась до 297 мкм, МКОЗ повысилась до 0,5. Средняя световая чувствительность центральной зоны сетчатки на левом глазу незначительно возросла до 19,9 dB, индекс состояния макулы составил 92,6 усл. ед. (рис. 3).
Пациент М., 67 лет. Жалобы на выраженное снижение зрения на обоих глазах в течение нескольких лет. Страдает СД 2-го типа с 1990 г., однократно отмечался максимальный подъем глюкозы крови до 32,0 ммоль/л. Находится на инсулинотерапии с 2012 г. Уровень НвА1С на момент начала терапии – 9,7%. Ранее, с 2017 г. по 2022 г., проводились сеансы панретинальной лазеркоагуляции сетчатки. В 2018 г. на обоих глазах выполнена факоэмульсификация с имплантацией ИОЛ. В 2020 г. выявлена первичная открытоугольная (IIВ) глаукома обоих глаз. Использует инстилляции дорзоламида 2% + тимолола 0,5% (фиксированная комбинация) двукратно ежедневно в оба глаза. На фоне гипотензивной терапии была достигнута стойкая компенсация уровня ВГД.
ОD/OS: МКОЗ – 0,01/0,05, ВГД – 16/17 мм рт. ст., световая чувствительность макулы – 10,4/13,5 dB, индекс состояния макулы – 100/100 усл. ед., фиксация центральная, стабильная.
Передний отрезок обоих глаз спокоен, артифакия, ИОЛ центрированы. Офтальмоскопически: в макуле обоих глаз диффузный кистозный отек, интраретинальные геморрагии, скопления твердых экссудатов. В экваториальной зоне и ретроэкваториально определяются зоны ретинальной неоваскуляризации, следы коагулятов, микроаневризмы. В слоях нейроэпителия сформировались обширные кистозные полости с тенденцией к слиянию, деформации слоя ретинального пигментного эпителия. ТФС ОD/OS – 456/571 мкм соответственно. ДЗН деколорирован, Э/Д – 0,8, неоваскуляризация 1/3 ДЗН на обоих глазах.
Диагноз: диффузный макулярный отек, пролиферативная ДР, первичная открытоугольная (IIА) глаукома, артифакия обоих глаз.
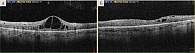
Проведен курс инъекций на левом, лучше видящем глазу. К концу загрузочной фазы отмечалось значимое уменьшение ТФС до 230 мкм, хотя при этом улучшение МКОЗ было незначительным – до 0,1. Не зарегистрировано значимых изменений функциональных показателей сетчатки: световая чувствительность макулы – 15,6 dB, индекс состояния макулы – 100 усл. ед. (рис. 4).
Оценка динамики морфологических и функциональных показателей макулы у четырех пациентов с диффузным ДМО к концу загрузочного курса бролуцизумаба показала, что у одного из них на фоне непролиферативной ДР и исходного значения ТФС 495 мкм произошла значимая редукция отека в виде снижения ТФС до 230 мкм к концу загрузочной фазы лечения. При этом значительно увеличилась МКОЗ – с 0,3 до 0,7. В двух случаях диффузного ДМО на фоне пре- и пролиферативной ДР показатели ТФС изменились менее значительно: с исходных 430 и 401 мкм до 255 и 297 мкм соответственно. При этом улучшение МКОЗ было умеренным – с исходных 0,4 и 0,3 до 0,5 у обоих пациентов.
У одного пациента с исходно грубыми морфологическими изменениями макулы на фоне тяжелой пролиферативной ДР показатель ТФС к концу загрузочного курса лечения уменьшился с 571 до 230 мкм. При этом МКОЗ увеличилась незначительно – с 0,05 до 0,1 к концу загрузочной фазы, что можно объяснить тяжелым исходным изменением макулы.
Обсуждение
Диффузный ДМО является основной причиной необратимого снижения центрального зрения у большинства пациентов с ДР различной стадии. Как показала клиническая практика, методики лазерной коагуляции макулярной зоны (по типу модифицированной решетки и другие технологии) эффективны лишь на ранних стадиях ДМО [30–33].
Описанный в литературе клинический опыт применения медикаментозных методов лечения ДМО с помощью анти-VEGF-препаратов демонстрирует достаточно высокий клинический эффект. Хотя имеют место и недостатки: толерантность к данному виду лечения у ряда пациентов, необходимость выполнения частых инъекций и связанная с этим высокая стоимость терапии, увеличение риска нежелательных побочных явлений в виде внутриглазного воспаления [34, 35].
Сказанное побуждает исследователей к разработке новых поколений препаратов данной фармакологической группы, лишенных большинства перечисленных недостатков.
Как показал наш опыт использования нового препарата бролуцизумаба при диффузном ДМО, положительные результаты отмечаются уже к окончанию курса лечения. Так, у первого пациента произошла полная редукция макулярного отека со значительным повышением МКОЗ. У второго и третьего пациентов также произошла редукция диффузного макулярного отека, но МКОЗ повысилась не так значимо. На наш взгляд, это может быть связано с более выраженными стадиями ДР, большей продолжительностью СД, степенью его компенсации, сопутствующей патологией. У четвертого пациента почти не отмечалось положительной динамики к концу загрузочного курса. По-видимому, в немалой степени это обусловлено исходными грубыми морфологическими изменениями макулы: наличием крупных кистозных полостей, деформацией слоя пигментного эпителия, высокими значениями ТФС (571 мкм) с изначально низкой зрительной функцией в течение длительного периода времени, фоновой пролиферативной стадией ДР, большой продолжительностью СД, сопутствующей системной и глазной патологией.
Повышение функциональных показателей макулы, по данным микропериметрии, отмечалось у всех пациентов, но незначимо. Возможно, при более длительных сроках наблюдения на фоне дальнейшей терапии эти показатели улучшатся.
Заключение
Полученные результаты показывают эффективность бролуцизумаба в лечении раннего ДМО с исходно высокой зрительной функцией.
Для объективной оценки эффективности лечения у пациентов с далеко зашедшей стадией заболевания, большой давностью отека необходимы дальнейшие исследования с более длительным сроком наблюдения и большей выборкой.
Авторы заявляют об отсутствии конфликта интересов.
L.P. Danilova, Ye.L. Sorokin, PhD, Prof., A.Ye. Shulga
Khabarovsk Branch of the National Medical Research Center ‘Interdisciplinary Scientific and Technical Complex ‘Eye Microsurgery’ named after Academician S.N. Fedorov’ of the Ministry of Health of the Russian Federation
Far Eastern State Medical University
Contact person: Alisa Ye. Shulga, naukakhvmntk@mail.ru
The aim is to evaluate the clinical efficacy of brolucizumab in diabetic macular edema (DME).
Material and methods. The results of the loading phase of brolucizumab (5 intravitreal injections) were analyzed in 4 patients with diffuse DME.
Results. A 53-year-old patient U., OS: best corrected visual acuity (BCVA) – 0.3, foveal retinal thickness (RT) – 495 µm, cystic cavities in epithelial layer, subretinal fluid accumulation against the background of non-proliferative diabetic retinopathy (DR). After the course of treatment, complete regression of diffuse macular edema was achieved: RT – 230 μm, BCVA – 0.8. A 76-year-old patient S., OD: BCVA – 0.4, RT – 430 μm, multiple retinal cysts against the background of proliferative DR. After the course of treatment: RT decreased to 255 μm, BCVA – to 0.5. A 71-year-old patient R., OS: BCVA – 0.3, RT – 401 µm, cystic cavities in epithelial layer, preproliferative DR. By the end of the course of treatment, RT decreased to 297 μm, BCVA increased to 0.5. A 67-year-old patient M., OS: BCVA – 0.05, RT – 571 μm, extensive cystic cavities in epithelial layer, proliferative DR. By the end of the course of treatment: RT – 230 μm, BCVA – 0.1.
Conclusion. The first results obtained high efficacy of brolucizumab in treatment of early edema with initially high visual functions. For an objective assessment of effectiveness of treatment in patients with advanced stage of disease, a long prescription of edema, further longer follow-up periods and more patients are required.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.