Лечение метастатической увеальной меланомы. Опыт ведущего референсного центра
- Аннотация
- Статья
- Ссылки
- English

Введение
Увеальная меланома (УМ) – редкая злокачественная опухоль, возникающая из меланоцитов сосудистой оболочки глаза [1]. Несмотря на успехи в лечении первичной опухоли, частота развития метастатической формы заболевания составляет, по данным различных литературных источников, до 50% [2]. Чаще всего УМ метастазирует в печень (60,5%), легкие (24,4%), кожу/мягкие ткани (10,9%) [3]. Медиана общей выживаемости (ОВ) больных метастатической УМ составляет около 13,4 месяца, а двухлетняя выживаемость не превышает 8% [4].
УМ отличается по своим молекулярно-биологическим свойствам от меланомы кожи. Драйверными для УМ являются мутации в генах GNA11 и GNAQ (80–90%), приводящие к активации пути RAS/RAF/MEK/ERK (RAS-ERK) и др. [5]. Кроме того, УМ отличает от меланомы кожи низкая мутационная нагрузка [6].
На сегодняшний день не существует стандартов выбора первой линии терапии среди пациентов с метастатической УМ. Наиболее эффективным методом лечения при солитарном характере метастатического поражения является хирургический. В систематическом обзоре A.M. Hameed и соавт. медиана ОВ в группе пациентов с метастатической УМ, которым удалось выполнить резекцию R0, составила 25 месяцев (диапазон 9,5–65,6 месяца), в группе пациентов с R1/2-резекцией – 16 месяцев (диапазон 11,7–29 месяцев). Одно- и трехлетняя ОВ составили 70% (диапазон 39–100%) и 36% (диапазон 10,2–53%) соответственно. Важно отметить, что у большинства пациентов в данном исследовании размер метастатического очага не превышал 30 мм и пациенты относились к группе благоприятного прогноза, медиана времени до прогрессирования составляла 54 месяца [7].
Последние несколько лет химиотерапия применяется реже в первой линии с учетом низкой эффективности. Наилучшие результаты продемонстрированы в исследованиях по оценке эффективности следующих режимов химиотерапии: гемцитабин + треосульфан и паклитаксел + карбоплатин, медиана ОВ составила 14 месяцев (95% доверительный интервал (ДИ) 12,4–30,6) и 7,8 месяца (95% ДИ 1–14) соответственно [8, 9].
Терапия ингибиторами контрольных точек увеличила ОВ пациентов с метастатической УМ, показатель однолетней ОВ увеличился с 25 до 41,9%, а медиана ОВ увеличилась с 7,8 до 10 месяцев (отношение рисков (ОР) 0,52; 95% ДИ 0,34–0,79; p = 0,003). При этом частота ответов на фоне проведения иммунотерапии анти-PD-1-препаратами составляет не более 7%, на фоне комбинированной иммунотерапии (анти-CTLA-4 и анти-PD-1) – 21% [10].
Прорывом последних лет в лечении метастатической УМ стал препарат тебентафусп. В исследовании II фазы (IMCgp100-202) тебентафусп продемонстрировал увеличение ОВ среди пациентов с метастатической УМ с генотипом HLA-A*02:01 в первой линии по сравнению с контрольной группой (химиотерапии или иммунотерапии ингибиторами контрольных точек в монорежиме). Однолетняя ОВ составила 73% против 59% в контрольной группе (ОР 0,51; 95% ДИ 0,37–0,71; p < 0,001). Однако главное ограничение столь эффективной терапии – это наличие HLA «подходящего» генотипа только у 40% пациентов с метастатической УМ [11].
Перспективными методами локального лечения для пациентов с метастатическим поражением печени являются изолированная перфузия печени (ИПП) мелфаланом и чрескожная перфузия печени (ЧПП). В исследованиях III фазы SCANDIUM (ИПП) и FOCUS (ЧПП) продемонстрировано увеличение как частоты объективного ответа (ЧОО), так и медианы выживаемости без прогрессирования (ВБП) по сравнению с контрольной группой. ЧОО в группе ИПП составила 40% против 4,5% в контрольной группе (p < 0,0001). Медиана ВБП составила 7,4 месяца против 3,3 месяца (ОР 0,21; 95% ДИ 0,12–0,36). ЧОО в группе ЧПП составила 32,9% (95% ДИ 22,75–40,40%) против 13,8% (95% ДИ 3,89–31,66%). Медиана ВБП составила 9,03 месяца (95% ДИ 6,34–11,56) и 3,12 месяца (95% ДИ 2,89–5,65) соответственно (p = 0,0007) [12, 13].
Задачей нашего исследования является анализ используемых вариантов терапии, их эффективности и переносимости среди ранее не леченных пациентов с метастатической УМ, обратившихся в Национальный медицинский исследовательский центр (НМИЦ) онкологии им. Н.Н. Блохина и Костромской онкологический диспансер в период с 2020 по 2023 г.
Материал и методы
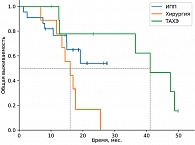
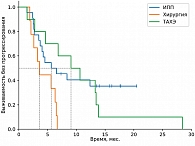
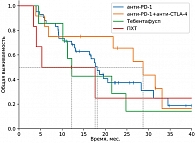
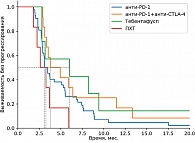
В период с 2020 по 2023 г. в НМИЦ онкологии им. Н.Н. Блохина обратились 175 пациентов с метастатической УМ. В итоговый анализ включено 125 пациентов, остальные 50 пациентов не вошли в анализ по причине отсутствия сведений об их судьбе после полученных рекомендаций, часть пациентов (20%) нуждалась в назначении паллиативной терапии. В качестве первой линии лечения проведена изолированная химиоперфузия печени мелфаланом на базе Костромского онкологического диспансера 22 пациентам, селективная трансартериальная химиоэмболизация (ТАХЭ) – девяти пациентам (карбоплатин и липиодол – шести, доксорубицин и липиодол – трем), хирургическое лечение – десяти пациентам, иммунотерапия анти-PD-1-ингибиторами – 42 пациентам, комбинированная иммунотерапия анти-PD-1 + анти-CTLA-4 – 12 пациентам, терапия тебентафуспом – семи пациентам, полихимиотерапия (ПХТ) – шести пациентам, комбинированные методы лечения (стереотаксическая лучевая терапия (СТЛТ) или ИПП мелфаланом + ингибиторы контрольных точек иммунитета) – 17 пациентам.
СТЛТ проводилась на линейных ускорителях электронов Varian Clinac 2100-2300 iX (Varian); использовалась трехмерная конформная лучевая терапия (3D-CRT); при наличии преимуществ с точки зрения распределения дозы и лучевой нагрузки на критические органы использовались технологии подведения дозы IMRT (лучевая терапия с модуляцией интенсивности) и VMAT (арк-терапия с объемной модуляцией интенсивности). У пациентов с облучением метастазов в печени использовалась технология контроля дыхательных движений, а именно задержка дыхания на вдохе под контролем системы RPM (Real-time Position Management). При укладке пациентов использовались оптимальные фиксирующие приспособления (термопластические маски, вакуумные матрацы, позиборды).
В каждой группе оценивались медианы ВБП и ОВ через 18 месяцев (18м-ОВ) и частота контроля над заболеванием (ЧКЗ), а также частота возникновения нежелательных явлений (НЯ) 3–4-й степени (использовалась шкала CTC AE v 4.0).
Анализ выживаемости проводился с использованием метода Каплана – Майера. Для статистического анализа и визуализации использовались язык программирования Python и библиотека Lifelines.
Результаты
Средний возраст пациентов с метастатической УМ составил 54,8 года (20–77), из них 56,6% женщин (n = 99) и 43,4% мужчин (n = 76). Медиана времени от диагностики первичной опухоли до регистрации метастатических проявлений – 2 года (0–21), у 70 (56%) пациентов время до регистрации метастазов – менее трех лет, у 23 (18,4%) – от трех до пяти лет, у 32 (25,6%) – более пяти лет, что может указывать на наличие предикторов негативного прогноза у большинства пациентов с метастатической УМ, обратившихся в НМИЦ онкологии им. Н.Н. Блохина. У большинства пациентов (90,2%) были диагностированы метастатические очаги в печени, что наиболее характерно для УМ, у 19% пациентов – в легких, у 15% – в костях, у 10% – в мягких тканях. Подробно результаты для каждой группы приведены в таблице.
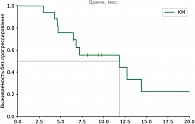
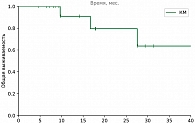
Среди пациентов, которым выполнялись локальные методы лечения, наилучшие показатели ВБП и ОВ зарегистрированы в группе хирургического лечения, что связано с более благоприятным профилем пациентов (медиана времени до появления метастатических очагов составила 4,7 года). Медиана ВБП в группе перфузии печени составила 5,63 месяца против 3,57 месяца в группе ТАХЭ, а 18м-ОВ – 64,9% против 35,4% соответственно. На основании этого можно сделать предварительные выводы о том, что для пациентов с множественным метастатическим поражением печени (объем поражения печени не более 80%) приоритетной является опция ИПП мелфаланом. Частота НЯ 3–4-й степени в группе ИПП выше по сравнению с группой пациентов, которым проводилась селективная химиоэмболизация (27,5% против 22,2% соответственно).
В группе системных методов лечения наибольшая медиана ВБП и ЧКЗ зарегистрирована в группе пациентов, получавших терапию тебентафуспом (6 месяцев против 3+ месяца в остальных группах). Однако ОВ через 18 месяцев была выше в группе комбинированной иммунотерапии (75% против 42% в группе тебентафуспа). Частота НЯ 3–4-й степени выше в группе тебентафуспа, но большая часть из них зарегистрирована в первые 12 недель терапии и не привела к прекращению лечения ни у одного пациента.
В группе комбинированных методов лечения пациенты получали иммунотерапию анти-PD-1-препаратами (n = 12) или комбинацию анти-PD-1 с анти-CTLA-4 (n = 5) совместно с СТЛТ (n = 7) или ИПП мелфаланом (n = 8), ТАХЭ доксорубицином с липиодолом (n = 2). Основным критерием выбора локального метода лечения являлись количество метастатических очагов и их размеры. При наличии более пяти метастатических очагов в печени пациентам проводилась ИПП. В случае невозможности проведения перфузии печени пациентам было рекомендовано проведение ТАХЭ. Основные критерии выбора СТЛТ – суммарно не более пяти очагов на органы, размеры очагов не более 30 мм, отсутствие технических сложностей в маркировании очагов перед планируемой СТЛТ. Лучевая терапия проводилась на один или максимум три метастатических очага. Выбор облучаемых очагов осуществлялся на основании данных рентгенологического исследования (наибольший в размере метастатический очаг по данным компьютерной томографии или магнитно-резонансной томографии с внутривенным контрастированием).
Комбинированные методы лечения при метастатической УМ продемонстрировали наибольшую ЧКЗ, медиану ВБП и ОВ, а также приемлемую токсичность (23,5% НЯ 3–4-й степени).
Обсуждение
Полученные нами результаты в большинстве групп сопоставимы с данными литературы. Важно отметить, что иммунотерапия ингибиторами контрольных точек внесла значимый вклад в лечение пациентов с метастатической УМ. Показатели ОВ увеличились практически в два раза по сравнению с другими методами лечения (химиотерапия и ТАХЭ). В группе тебентафуспа 18м-ОВ ниже, чем в исследовании IMCgp100-202, при большей ЧОО и медиане ВБП, что, вероятно, связано с объемом выборки. При непрямом сравнении комбинированные методы лечения продемонстрировали значимое увеличение медианы ВБП и ЧКЗ по сравнению с другими системными методами лечения, а 18м-ОВ сопоставима с группой хирургического лечения у пациентов с благоприятным прогнозом.
Эффективность сочетания лучевой терапии и иммунотерапии ингибиторами контрольных точек продемонстрирована в нескольких опубликованных исследованиях. В исследовании S. Grynberg и соавт. (2022 г.) девять пациентов с метастатической УМ получили иммунотерапию ингибиторами контрольных точек в сочетании с СТЛТ и дистанционной лучевой терапией. Семь (77,8%) из них получили комбинированную иммунотерапию анти-PD-1 + анти-CTLA-4, два (22,2%) – иммунотерапию анти-PD-1-препаратами. Лучевая терапия проводилась в течение шести месяцев после начала иммунотерапии. Общая частота ответа составила 44%, медиана ВБП – 22 месяца, а медиана ОВ – 26 месяцев [14].
В исследовании E. Rossi и соавт. (2023) 22 пациента получили иммунотерапию пембролизумабом в сочетании с лучевой терапией на метастатические очаги в печени, медиана ВБП составила 4,8 месяца, медиана ОВ – 21,2 месяца, у шести пациентов был достигнут частичный ответ (27,3%), у трех (13,6%) – стабилизация [15].
В исследовании нашего центра у 11 пациентов, получивших СТЛТ в комбинации с иммунотерапией ингибиторами контрольных точек (36% – анти-PD-1 + анти-CTLA-4, 64% – анти-PD-1), ЧОО составила 45% (один (9%) полный ответ и четыре (36%) частичных ответа), медиана ВБП – девять месяцев (95% ДИ 4,0–24,0), а медиана ОВ – 35 месяцев (95% ДИ 13,0 – не достигнута) [16].
Очевидно, что мы видим преимущество лучевой терапии и иммунотерапии ингибиторами контрольных точек среди пациентов с метастатической УМ. Это роль абскопального эффекта или особый синергизм? Ответ на на этот вопрос пока неизвестен, и проблема ограничена только научными рассуждениями.
Если говорить о сочетании ИПП мелфаланом и иммунотерапии ингибиторами контрольных точек, то предварительные результаты исследования SCANDIUM II демонстрируют эффективность комбинированного подхода. В данном исследовании 18 пациентов были рандомизированы в две группы: девять пациентов составили группу А, где была проведена ИПП мелфаланом с последующей комбинированной иммунотерапией анти-PD-1 + анти-CTLA-4, и девять пациентов вошли в группу В, где проводился один цикл неоадъювантной комбинированной иммунотерапии с последующей ИПП мелфаланом, а затем после хирургического вмешательства – оставшиеся три цикла комбинированной иммунотерапии. Ответ был оценен у 17 пациентов, зарегистрировано три полных ответа (18%), четыре частичных ответа (24%), семь случаев стабилизации (41%) и три – прогрессирования заболевания (18%). Общая частота ответа составила 63% в группе А (5/8) и 22% в группе В (2/9). В каждой группе было по 10 серьезных НЯ, связанных с лечением. Всего 11 из 18 пациентов (шесть в группе А и пять в группе В) не завершили запланированные четыре цикла комбинированной иммунотерапии, в среднем по 2,4 цикла в группе А и 3,0 цикла в группе В [17].
В исследовании нашего центра восьми пациентам было проведено комбинированное лечение, из них только два пациента получили комбинированную иммунотерапию анти-PD-1 + анти-CTLA-4 до перфузии (один-два курса), остальные шесть пациентов получили анти-PD-1-терапию в течение 1–1,5 месяца после оперативного вмешательства на фоне стабильного самочувствия и отсутствия прогрессирования по данным контрольного обследования, ЧОО составила 50% (4/8), частота развития НЯ 3–4-й степени – 37,5%.
Кроме того, также опубликованы первые результаты исследования по изучению ЧПП совместно с иммунотерапией (CHOPIN). В исследование включены семь пациентов, разделенных на две группы: в первой иммунотерапия проводилась по схеме ипилимумаб 1 мг/кг + ниволумаб 1 мг/кг, во второй – ипилимумаб 1 мг/кг + ниволумаб 3 мг/кг. В обеих группах пациентам проведено шесть еженедельных курсов ЧПП (мелфалан 3 мг/кг, максимум 220 мг). У одного (14,3%) пациента зарегистрирован полный ответ, у пяти (71,4%) – частичные (три ответа сохраняются при медиане наблюдения 29,1 месяца).
НЯ 3–4-й степени, включая синдром системной воспалительной реакции, фебрильную нейтропению и холецистит, наблюдались у 2/3 пациентов первой группы и у 3/4 пациентов второй группы [18].
Несмотря на преимущества комбинированных подходов, необходимо их дальнейшее изучение для определения критериев отбора пациентов на проведение СТЛТ или ИПП в комбинации с иммунотерапией.
Следует отметить, что в нашем исследовании среди пациентов с метастатической УМ мы зарегистрировали достаточно высокие показатели ОВ практически во всех группах, 56% пациентов с метастатической УМ получили три и более линий терапии, около 2% пациентов смогли получить шесть линий терапии. Чаще всего в качестве второй линии после прогрессирования на фоне локальных методов лечения назначалась комбинированная иммунотерапия (18,2% – после ИПП, 44% – после ТАХЭ и 40% – после хирургического лечения). После прогрессирования на фоне иммунотерапии анти-PD-1-препаратами назначалась паллиативная химиотерапия (ПХТ) (36%) или комбинированная иммунотерапия (19%). После прогрессирования на фоне комбинированной иммунотерапии – ПХТ (42%) или локальные методы лечения (25%).
Заключение
На сегодняшний день не существует критериев отбора пациентов с метастатической УМ для первой линии терапии. Все известные методы лечения обладают низкой эффективностью. Применение иммунотерапии позволило увеличить ОВ у больных с метастатической УМ, однако эффективность ее гораздо ниже, чем при меланоме кожи. Прорывом последних лет стал препарат тебентафусп, однако его эффективность продемонстрирована только у пациентов с небольшой опухолевой массой и при наличии определенного HLA-подтипа. Преодоление резистентности к иммунотерапии в последнее время одно из ключевых направлений в онкологии. В лечении больных с метастатической УМ комбинированные подходы (сочетание иммунотерапии ингибиторами контрольных точек и локальных методов лечения (ИПП мелфаланом, СТЛТ)) продемонстрировали эффективность и безопасность, кроме того, позволили увеличить ЧОО и медиану ВБП, что позволяет рассматривать эту опцию как одну из возможных при выборе первой линии терапии у пациентов с метастатической УМ.
V.V. Nazarova, PhD, Z.R. Magomedova, K.V. Orlova, PhD, E.A. Azarova, V.M. Unguryan, PhD, I.A. Utyashev, PhD, D.S. Romanov, PhD, I.G. Markina, PhD, I.V. Samoylenko, PhD, G.Yu. Kharkevich, PhD, V.A. Yarovaya, PhD, A.A. Yarovoy, PhD, L.V. Demidov, PhD
N.N. Blokhin National Medical Research Center of Oncology
N.I. Pirogov Russian National Research Medical University
Kostroma Clinical Oncological Dispensary
Hadassah Institute of Oncology, Moscow
Center for Innovative Medical Technologies
S.N. Fedorov National Medical Research Center ‘Eye Microsurgery’
Contact person: Valeria V. Nazarova, jezerovel@gmail.com
Uveal melanoma (UM) is the most common primary intraocular tumor. Despite successful treatment of the primary tumor, 50% of patients develop distant metastases. To date, there are no clear standards for choosing the first line of therapy for metastatic UM. The article presents a retrospective analysis of the effectiveness and safety of first-line therapy in 125 patients with metastatic UM who applied to the N.N. Blokhin National Medical Research Center of Oncology in the period from 2020 to 2023.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.