Место пробиотиков в антихеликобактерной терапии
- Аннотация
- Статья
- Ссылки
- English
В мире в 2015 г. насчитывалось 4,4 млрд человек, инфицированных Helicobacter pylori [1]. Как известно, с инфекцией H. pylori в слизистой оболочке желудка связаны острый и хронический гастрит, язвенная болезнь, неязвенная диспепсия, атрофический гастрит, кишечная метаплазия, аденокарцинома желудка, а также MALT-лимфома [2–4]. С H. pylori ассоциировано несколько экстрагастродуоденальных расстройств, таких как железодефицитная анемия, склеродермия, розацеа, атеросклероз и аутоиммунные заболевания щитовидной железы [5].
Инфекция H. pylori может ингибировать секрецию желудочной кислоты, вызывать хроническое воспаление слизистой оболочки желудка и тем самым приводить к изменению микробного сообщества [6, 7]. Кроме того, изменения микробиоты кишечника обусловлены рядом желудочно-кишечных и системных заболеваний [8]. И хотя желудок считается исключительной средой обитания H. pylori [9], эта бактерия была обнаружена посредством секвенирования 16S рРНК в образцах кала, правда с низкой относительной распространенностью [10]. Более того, согласно результатам исследований, H. pylori приводит к отчетливым изменениям микробиоты кишечника в дистальных отделах желудочно-кишечного тракта (ЖКТ) [11]. Аналогично в исследованиях с использованием флуоресцентной гибридизации in situ образцов фекалий у лиц, инфицированных H. pylori, показано снижение количества клостридий, а также общих анаэробов по сравнению с индивидуумами, негативными по H. pylori [12]. Эти наблюдения позволяют предположить, что инфекция H. pylori приводит к широко распространенным изменениям в экстрагастральной микробной структуре хозяина в результате изменений микрофлоры желудка. Между тем потенциал для индукции заболеваний и взаимодействие между H. pylori, кишечной микробиотой и здоровьем хозяина остаются недостаточно изученными. Установлено, что микробиота кишечника у H. pylori-негативных субъектов разнообразнее, чем у H. pylori-позитивных пациентов [13].
Колонизация желудка H. pylori влияет на распределение и количество исходных желудочных бактерий и нарушает микроэкологический баланс, что приводит к развитию патологии. Например, при инфицировании H. pylori уровень Lactobacillus в желудке ниже, чем в отсутствие хеликобактерной инфекции [14]. Вследствие хеликобактерной инфекции развивается микроэкологический дисбаланс, главным образом из-за синтеза антибактериального пептида – цекропина. Этот пептид может вызвать аутогенный аутолиз других бактерий [15]. Из-за отсутствия конкуренции со стороны этих бактерий H. pylori беспрепятственно размножается.
Согласно Киотскому глобальному консенсусу по H. pylori, чтобы минимизировать риск отдаленных последствий, включая язвенную болезнь желудка, аденокарциному желудка и лимфоидную опухоль, ассоциированную со слизистой оболочкой желудка (MALT), пациенты с диагностированной инфекцией H. pylori должны получать эрадикационную терапию [16]. Однако современные данные свидетельствуют о том, что эрадикация H. pylori связана с серьезными нарушениями кишечной микробиоты – уменьшением бактериального разнообразия, а также сокращением числа Bifidobacterium, Lactobacillus и продуцентов бутирата, таких как Faecalibacterium prausnitzii [12]. Подобные изменения могут сохраняться до четырех лет после завершения терапии антибиотиками [17].
Появляется все больше данных, подтверждающих потенциальный вред антибиотиков. Это указывает на необходимость более полного изучения сложных взаимодействий между H. pylori, кишечной микробиотой и хозяином для выявления субъектов, наиболее подверженных риску возникновения отдаленных последствий [18].
Ингибиторы протонной помпы (ИПП) входят в десятку наиболее часто используемых лекарственных средств в мире, возрастает частота неизбирательного использования ИПП [19], обусловленная медицинской гипервыпиской [20], а также самодиагностикой и самолечением в условиях доступности данных препаратов [21, 22]. ИПП считаются безопасными препаратами. Тем не менее в популяционных обсервационных исследованиях последних лет зарегистрированы их многочисленные побочные эффекты: сердечно-сосудистые заболевания и патология почек, дефицит питательных микроэлементов и остеопороз, когнитивные нарушения и преждевременная смерть [23]. Более поздние исследования не подтвердили связь ИПП с ишемическим инсультом [24], инфарктом миокарда [25] и когнитивными нарушениями [26].
ИПП широко используются для эрадикации H. pylori. К потенциальным эффектам анти-H. pylori-препаратов относят:
- прямой бактериостатический эффект вследствие ингибирования бактериальной АТФазы Р-типа;
- ингибирование бактериальной активности уреазы [27].
Следует отметить, что снижение активности уреазы достигается только при введении высоких доз ИПП (омепразол 80 мг/сут).
Известно по крайней мере два механизма, с помощью которых ИПП влияют на бактериальную композицию желудка:
- непосредственное воздействие на бактериальные и грибковые протонные насосы;
- нарушение нормальной микрофлоры желудка за счет повышения его рН [28].
Показано, что орофарингеальная и фекальная флора более широко представлена в микрофлоре желудка после применения ИПП [29]. P.F. Sterbini и соавт. выявили значительное увеличение распространенности стрептококка в ЖКТ у пациентов, принимавших ИПП, независимо от статуса H. pylori. Исследователи пришли к заключению, что стрептококк может служить независимым индикатором изменений микробиома желудка у пациентов с диспепсией на фоне применения ИПП. Этим можно объяснить обострение или персистенцию диспепсии у пациентов, находящихся на терапии ИПП [22].
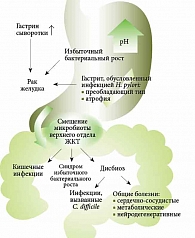
L. Macke и соавт. провели систематический обзор, посвященный оценке влияния ИПП на кишечную микробиоту [30]. В обзор были включены 12 независимых наблюдений с 4277 участниками и 11 интервенционных групп исследования с 180 участниками (все принимали ИПП). Установлено, что терапия ИПП сопровождается умеренными нарушениями микробиоты верхнего и нижнего отделов ЖКТ. В большинстве исследований подобные изменения ассоциировались не с показателями общего количества и разнообразия, а с изменением численности конкретных таксонов. Исследования микробиоты верхних отделов ЖКТ ограничены небольшим размером выборки и разнородным дизайном, но их результаты аналогичны таковым ранних наблюдений: ИПП способствуют чрезмерному росту микробиоты орофарингеального происхождения в пищеводе, желудке и двенадцатиперстной кишке (рисунок) [30].
Связанные с ИПП изменения профилей микробиоты в образцах фекалий подробно описаны как в интервенционных, так и в крупных наблюдательных исследованиях: использование ИПП связано с увеличением числа таксонов родов Bacillales (например, Staphylococcaceae) и Lactobacillales (в частности, Enterococcaceae, Lactobacillaceae и Streptococcaceae), Actinomycetales (Actinomycetaceae и Micrococcaceae), семейств Pasteurellaceae и Enterobacteriaceae и рода Veillonella. Кроме того, при использовании ИПП наблюдаются таксономическое снижение численности представителей семейств Bifidobacteriaceae, Ruminococcaceae и Lachnospiraceae и класса Mollicutes. Эти данные подтверждают вывод, что гипохлоргидрия, вызванная ИПП, позволяет микроорганизмам, входящим в состав микробиоты верхних отделов ЖКТ, заселять более дистальные отделы пищеварительного тракта.
Наблюдается также значительное увеличение Staphylococcus aureus и его бактериальной инвазии эпителиальных клеток, включая гены антибактериальных пептидов с нарушением целостности эпителия. ИПП играют важную роль в споруляции Clostridium difficile за счет снижения устойчивости к колонизации на фоне изменения микробиоты [31].
Многие врачи, под наблюдением которых находятся пациенты с инфекцией H. pylori и экстраалиментарными расстройствами на фоне гастроэнтерологических симптомов, нередко задаются вопросом: проводить эрадикацию H. pylori или не проводить?
В Маастрихтском соглашении V содержится основанное на фактических данных указание о проведении эрадикации H. pylori [32]. Однако клинические решения не всегда просты. Традиционная антихеликобактерная тройная терапия предполагает применение ИПП, кларитромицина и амоксициллина. В начале 1990-х гг. уровень эрадикации на фоне традиционной тройной терапии составлял 90% [33]. В последние десятилетия эффективность эрадикации H. pylori заметно снизилась из-за увеличения устойчивости к антибиотикам. В ряде стран частота несостоявшейся эрадикации превышает 20%. В районах с высокой распространенностью резистентных H. pylori-штаммов этот показатель может быть еще выше [34, 35]. Маастрихтское соглашение V рекомендует в целях эрадикационной терапии H. pylori дважды в день применять антибиотики и высокие дозы ИПП в течение 14 дней [32]. Как следствие – увеличение во время антихеликобактерной терапии (АХТ) частоты нежелательных побочных эффектов, таких как диарея, тошнота или рвота, и соответственно снижение приверженности лечению [36].
В исследованиях у 10–30% пациентов отмечались изменения частоты дефекации и характера стула [37–39], что могло быть связано с нарушением кишечной микробиоты. В исследовании L. Wu и соавт. диарея во время тройной терапии наблюдалась у 35% пациентов [40]. Таким образом, АХТ, основанная на применении антибиотиков, ассоциируется с изменением кишечной микробиоты [41].
L. Chen и соавт. [18] установили, что применение антихеликобактерной висмутсодержащей четырехкомпонентной схемы способно не только уничтожить H. pylori, но и изменить микробиоту кишечника (исследовано с использованием секвенирования 16S рРНК в образцах кала). Показано, что АХТ-индуцированный энтеральный дисбиоз может сохраняться до восьми недель после начала терапии антибиотиками. Однако следует учитывать, что изменения микробиоты кишечника после эрадикации H. pylori – не только результат действия антибиотиков. Это может быть обусловлено длительными изменениями секреции слюны, кислотности и моторики желудка, иммунологического ответа слизистой оболочки, изменениями в метаболических путях и потерей прямого влияния инфекции H. pylori на другие микроорганизмы, населяющие пищеварительный тракт человека [42]. Побочные эффекты эрадикации H. pylori, продолжительность которых превышает восемь недель, способны потенциально влиять на течение ряда заболеваний, связанных с дисбактериозом кишечника (воспалительные заболевания кишечника, пищевая аллергия и сахарный диабет), а также на усвоение пищи и лекарственных средств [43].
В ряде исследований оценивали долговременные изменения микробиоты кишечника. Альфа- и бета-разнообразие микробиоты и относительная численность всех типов восстанавливались до первоначального состояния только через год [10, 17, 44].
Во избежание изменений микробиоты к обычному лечению как взрослых, так и детей необходимо добавлять альтернативные и адъювантные методы, например пробиотики [45–49]. Хотя вопрос о положительном влиянии пробиотиков на эрадикацию H. pylori остается дискутабельным [50], в нескольких метаанализах и обзорах показано, что на фоне применения пробиотиков скорость эрадикации H. pylori увеличивается приблизительно на 5–10% [51–53]. Иммунная система и нормальная микробиота желудка способны эффективно противодействовать колонизации H. pylori, в то время как нарушение баланса микробиоты желудка повышает восприимчивость к инфекции H. pylori. Эти данные составляют теоретическую основу клинического использования пробиотиков в целях увеличения скорости эрадикации H. pylori.
Особое внимание в Маастрихтском соглашении V уделено гастроинтестинальной микробиоте и пробиотикам [32]:
- утверждение 5: эрадикационная терапия H. pylori может нарушить здоровую микробиоту кишечника, что приведет к краткосрочным клиническим последствиям (уровень доказательности 2с, степень рекомендации B);
- утверждение 6: эрадикация H. pylori должна применяться с осторожностью у пациентов с неразвитой или нестабильной кишечной микробиотой во избежание отдаленных клинических последствий (уровень доказательности 2с, степень рекомендации B);
- утверждение 9: только некоторые пробиотики эффективны для уменьшения побочных эффектов со стороны ЖКТ, вызванных эрадикационной терапией H. pylori. Конкретные штаммы следует выбирать исключительно на основании подтвержденной клинической эффективности (уровень доказательности умеренный, степень рекомендации сильная);
- утверждение 10: некоторые пробиотики могут оказывать благотворное влияние на эрадикацию H. pylori (уровень доказательности очень низкий, степень рекомендации слабая).
Метаанализ Z. Lv и соавт. показал, что пробиотические добавки способны улучшить показатели эрадикации и уменьшить побочные эффекты, возникшие на фоне эрадикационной терапии. Кроме того, пробиотики, по-видимому, оказывают повышенное влияние на частоту эрадикации при введении до или после стандартных схем. Длительное лечение пробиотиками может иметь преимущество перед краткосрочным введением. Lactobacillus и пробиотические добавки с несколькими видами положительно влияют на скорость эрадикации инфекции H. pylori [54].
F. Wang и соавт. проанализировали 140 исследований (44 английских и 96 китайских), в которых в общей сложности участвовало 20 215 пациентов. Схема эрадикационной терапии H. pylori включала более десяти пробиотических стратегий. Частота эрадикации и побочных явлений в пробиотической группе составила 84,1 и 14,4%, в контрольной группе – 70,5 и 30,1% соответственно. В целом дополнительное применение пробиотиков повысило эффективность эрадикации H. pylori и снизило частоту нежелательных явлений [49].
X. Shi и соавт. провели метаанализ 40 исследований с участием 8924 пациентов и оценили уровень эрадикации, частоту общих побочных эффектов на фоне лечения, эффективность и безопасность пробиотиков в эрадикации H. pylori, наилучшие сроки и продолжительность приема пробиотиков, использование схем эрадикации, штаммов, локализаций и общие побочные эффекты. По сравнению с контрольной в основной (пробиотической) группе наблюдались более высокая частота эрадикации (р < 0,001) и более низкая частота развития общих побочных эффектов (р < 0,001). Рейтинг общих побочных эффектов по показателям SUCRA был при диарее (39,7%), боли в животе (43,9%), тошноте (78,8%), нарушении вкуса (99,6%), рвоте (7,1%) и запоре (30,9%). Пробиотики увеличивали скорость эрадикации и уменьшали побочные эффекты на фоне АХТ. Использование пробиотиков до и после эрадикации, на протяжении всего периода лечения, а также в течение более двух недель ассоциировалось с лучшими эффектами эрадикации. Пробиотики в сочетании с четырехкомпонентной схемой с висмутом признаны лучшей комбинацией, Lactobacillus и мультиштаммы – лучшими пробиотиками [55].
M. Yu и соавт. провели метаанализ 11 рандомизированных контролируемых исследований, в которых участвовало в общей сложности 724 пациента. Авторы изучали влияние добавок Lactobacillus на частоту эрадикации H. pylori и побочные эффекты тройной терапии. Эффективность эрадикации H. pylori в группе Lactobacillus была значительно выше, чем в контрольной группе (р < 0,0001). Анализ в подгруппах продемонстрировал, что показатели эрадикации значительно выше как в группе взрослых, так и в группе детей. Существенных различий между субъектами из Азии и Европы не выявлено. Добавление Lactobacillus значительно снижало частоту различных нарушений пищеварения (р = 0,005) [56].
A. Hungin и соавт. провели систематический обзор по применению пробиотиков при симптомах со стороны нижних отделов ЖКТ. Впоследствии был принят обновленный международный консенсус, основанный на фактических данных, под эгидой Европейского общества первичной медицинской помощи в разделе гастроэнтерологии. Было принято утверждение 11: у пациентов, получающих эрадикационную терапию H. pylori, специфические пробиотики полезны в качестве адъювантной терапии для предотвращения или уменьшения продолжительности/интенсивности сопутствующей диареи. Согласие – 100% (6, 87,5%; 5, 12,5%; степень доказательности для эффекта высокая). В целом в исследованиях, включенных в данный систематический обзор и ориентированных на конкретные первичные конечные точки, сообщалось о доказательствах, подтверждающих эффективность пробиотиков в облегчении симптомов со стороны нижнего отдела ЖКТ (особенно общего показателя симптомов ЖКТ, боли в животе и кишечной диспепсии), улучшении показателей качества жизни, профилактики диареи, связанной с антибиотиками, и диареи на фоне АХТ. Безопасность пробиотиков была сопоставима с таковой плацебо. После представления доказательств консенсус между клиническими экспертами был достигнут [57].
Эффективность пробиотических препаратов в уменьшении побочных явлений в течение курса АХТ зависит от вида используемого пробиотика. Пробиотик должен быть метаболически активным в просвете кишечника, выживать и сохраняться после завершения терапии. Он должен быть устойчив к кислоте и желчи и быть антагонистом к патогенным бактериям, профилактируя развитие антибиотик-ассоциированной кишечной диспепсии. Таким пробиотиком является Линекс® Форте. Одна капсула препарата Линекс® Форте содержит молочнокислые бактерии (Lactobacillus acidophilus (CHR. HANSEN LA-5®) и Bifidobacterium animalis subsp. lactis (CHR. HANSEN BB-12®)). Каждая капсула содержит 2 × 109 КОЕ живых лиофилизированных молочнокислых бактерий. Показаниями к применению являются:
- лечение и профилактика дисбактериоза кишечника;
- облегчение запора у взрослых и детей старше 12 лет;
- дополнение к стандартной эрадикационной терапии H. pylori у взрослых и детей старше 12 лет;
комплексная терапия и профилактика диареи, метеоризма и других нарушений пищеварения, вызванных вирусными и бактериальными инфекциями ЖКТ (например, ротавирусные инфекции, диарея путешественника), терапией антибиотиками широкого спектра действия и другими противомикробными препаратами, лучевой терапией органов брюшной полости.
В обновленную инструкцию вошло показание – диарейные синдромы различной этиологии.
К преимуществу B. lactis (BB-12) и L. acidophilus (LA-5) относится высокая устойчивость к кислой среде желудка и желчи, благодаря чему их жизнеспособность сохраняется при прохождении через весь ЖКТ [58]. Другим крайне важным свойством данных штаммов бактерий является высокая адгезивная способность, играющая ключевую роль в создании колонии в кишечнике хозяина [59]. Спустя неделю после окончания приема B. lactis (BB-12) и L. acidophilus присутствуют в 87,5 и 37,5% образцов фекалий соответственно [60]. С помощью полимеразной цепной реакции установлено, что свыше 90% BB-12 были живыми [61]. Это означает, что они способны выживать и размножаться в кишечнике и по завершении терапии.
В ряде клинических исследований подтверждена польза пробиотиков L. acidophilus (LA-5) и B. animalis subsp. lactis (BB-12) при проведении АХТ. Так, добавление комбинированного пробиотика L. acidophilus (LA-5) и B. animalis subsp. lactis (BB-12) приводило к снижению частоты развития антибиотик-ассоциированной диареи (ААД) в пять раз при использовании стандартных режимов эрадикационной тройной терапии (p < 0,05) [39] и в два раза – на фоне квадротерапии (p < 0,05) [62]. Тошнота, рвота, металлический привкус во рту, запор встречались более чем в два раза реже у пациентов (p < 0,05), получавших L. acidophilus (LA-5) и B. animalis subsp. lactis (BB-12) [39, 62]. Кроме того, добавление пробиотиков к тройной эрадикационной терапии сопровождалось достоверно более высокой частотой эрадикации H. pylori (91 vs 78%; p < 0,05) [39]. При этом только у пациентов группы пробиотика наблюдалось восстановление до исходного уровня Bifidobacterium в кале на пятой неделе [39].
L.V. McFarland и соавт. провели систематический обзор и метаанализ 19 рандомизированных контролируемых исследований (n = 2730) мультиштаммовых пробиотиков, назначаемых в дополнение к эрадикационной терапии H. pylori. Авторы проанализировали влияние шести мультиштаммовых пробиотиков на уровень эрадикации, частоту развития любых побочных эффектов и ААД. Анализ показал, что дополнительное использование некоторых многоштаммовых пробиотиков может повышать уровень эрадикации H. pylori, профилактировать развитие побочных эффектов и диареи, связанной с приемом антибиотиков. Только две пробиотические смеси (L. acidophilus (LA-5)/B. animalis subsp. lactis (BB-12) и смесь из восьми штаммов) продемонстрировали значительную эффективность по всем трем изучаемым показателям [63].
Таким образом, комбинация пробиотиков B. animalis subsp. lactis (BB-12) и L. acidophilus (LA-5), входящих в состав пробиотика Линекс® Форте, улучшает переносимость эрадикационной терапии, достоверно снижая частоту ААД и других побочных эффектов, способствует восстановлению кишечного микробиоценоза и повышению эффективности эрадикационной терапии H. pylori. При проведении АХТ целесообразно применять пробиотик Линекс® Форте во время всего курса эрадикации (14 дней) и не менее 14 дней после завершения терапии.
На кафедре микробиологии Кемеровского государственного медицинского университета проведено исследование содержимого капсул препарата Линекс® Форте. Первоначально готовили взвесь из капсулы и выполняли микроскопическое исследование мазков, окрашенных методом Грама. Установлено наличие грамположительных палочек двух морфотипов. Первый морфотип характеризуется средней длиной, ровными прямыми или слегка изогнутыми палочками с закругленными концами. Концы у данного морфотипа более интенсивно окрашены (метахромазия). Палочки располагаются одиночно, V-образно и в виде частокола (род Bifidobacterium). Второй морфотип бактерий представляет собой толстые, длинные, слегка изогнутые палочки, расположенные одиночно или в виде длинных цепочек (род Lactobacillus). Содержание микроорганизмов в капсуле исследовали методом разведений. Из содержимого капсулы готовили первое разведение в физиологическом растворе (1:10), затем титровали взвесь и получали разведения 10-3, 10-5, 10-7, 10-9. Проводили высевы на жидкие питательные среды – Бифидум-среда (г. Оболенск) и среда MRS (HiMedia, Индия). Рост наблюдался во всех разведениях. В разведении 10-9 отмечался рост отдельных колоний в виде «спускающихся сталактитов» в количестве двух штук. Таким образом, содержание микроорганизмов в одной капсуле составило 2 × 109 × 10 = 2 × 1010 КОЕ. Консорциум микроорганизмов восстанавливался из лиофилизированного состояния, то есть начинал расти и размножаться при посеве на жидкие питательные среды через 24 часа. Разделить участников консорциума и выделить чистые культуры не удалось, поскольку данные пробиотические штаммы показали низкую способность к росту на плотных питательных средах. Биологические свойства изучали без выделения чистых культур. Кислотообразующая способность всего консорциума бактерий составила 220 ºТ (градусов Тернера). В целом адгезивная способность была средней, так как индекс адгезии равен 3,3. У представителей консорциума отсутствовала уреазная и протеолитическая активность (тест на мочевину и индол отрицательный). Поскольку в состав препарата входят пребиотики, были изучены сахаролитические ферменты пробиотических микроорганизмов. Инулин представляет собой полисахарид из остатков фруктозы или пектин, боковые цепочки которого состоят из нейтральных моносахаридов, включающих галактозу, ксилозу и арабинозу. С помощью тест-системы ANAERO-TEST 23 (Lachema, Чехия) установлена способность пробиотических бифидобактерий и лактобацилл ферментировать данные субстраты, то есть инулин оказывает пребиотический эффект в отношении вводимых в микробиоценоз штаммов. При этом пробиотические штаммы не ферментировали фруктозу, входящую в состав олигофруктозы. Следовательно, данный углевод может стимулировать рост и размножение флоры пациентов. Пробиотические бактерии препарата Линекс® Форте проявляли антагонизм к условно патогенным бактериям и грибам – S. xylosus, S. epidermidis, Klebsiella pneumoniae, Candida albicans, C. dubliniensis. В то же время пробиотический консорциум не обладал антагонизмом к Escherichia coli lac+, Enterococcus faecium, B. bifidum, B. longum, B. breve, выделенным из кишечника детей и взрослых. Значит, возможные эффекты «пробиотик против хозяина» или «аутофлора против пробиотика» при приеме препарата Линекс® Форте исключены. Определена чувствительность к антибиотикам всего консорциума бактерий диско-диффузионным методом. Показано, что бактерии резистентны к антибиотикам, таким как цефтазидим, цефазолин, цефтриаксон, амоксициллин, рокситромицин, офлоксацин, левофлоксацин, спарфлоксацин, имипенем, меропенем. Консорциум бактерий чувствителен только к гентамицину и амикацину. Таким образом, препарат Линекс® Форте характеризуется следующими микробиологическими признаками: содержание бактерий в одной дозе препарата – 1010 КОЕ, консорциум включает микроорганизмы рода Bifidobacterium и Lactobacillus, активность кислотообразования – 220 ºТ, индекс адгезии микроорганизмов – 3,3 – средний. Консорциум микроорганизмов восстанавливается из лиофилизированного состояния через 24 часа. Пробиотические штаммы препарата Линекс® Форте проявляют антагонизм к условно патогенным стафилококкам, клебсиеллам и грибам. При этом отмечается биосовместимость c доминирующими представителями кишечного микробиоценоза – представителями рода Escherichia, Bifidobacterium, Enterococcus. Консорциум бактерий устойчив к антибиотикам группы бета-лактамов, фторхинолонов, макролидов (применяемые при эрадикации Н. рylori), что делает возможным применение препарата Линекс® Форте одновременно с соответствующими антибиотиками, а также в комплексе АХТ.
Препарат Линекс® Форте рекомендуется для профилактики побочных эффектов и повышения переносимости АХТ и соответственно повышения эффективности эрадикационной терапии инфекции H. pylori.
Ye.Yu. Plotnikova, MD, PhD, Prof., Yu.V. Zakharova, PhD
Kemerovo State Medical University
Contact person: Yekaterina Yu. Plotnikova, eka-pl@rambler.ru
Currently, infection caused by Helicobacter pylori is considered to be the most common chronic bacterial infection in humans. Presumably, H. pylori occurs in 50% of the world's population. H. pylori infection is associated with remodeling of the intestinal microbiota. H. pylori eradication is necessary to control complications of diseases associated with Helicobacter pylori infection (stomach and duodenal ulcers). Proton pump inhibitors (PPIS) in a single mode can affect the bacterial composition of the stomach. They contribute to excessive growth of oropharyngeal microbiota in the esophagus, stomach, and duodenum, and PPIS-induced hypochlorhydria allows upper gastrointestinal microbiota to spread to more distal parts of the digestive tract. Anti-Helicobacter therapy not only destroys H. pylori, but also changes the intestinal microbiota. It is restored to its original state only after a year. To avoid this problem, alternative and adjuvant methods, such as probiotics, are added to conventional treatment. Linex® Forte is recommended for use during the administration of PPIS, as well as in the complex of anti-Helicobacter therapy for the prevention and treatment of dysbiotic disorders of the gastrointestinal tract.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.