Нормальная микрофлора кишечника принимает активное участие в синтезе биологически активных веществ, подавляющих рост и размножение патогенных микроорганизмов [6, 7]. Представители нормальной микрофлоры кишечника обладают адгезивными свойствами, фиксируясь на эпителии слизистой оболочки кишечника, они образуют пристеночный слой, что обеспечивает колонизационную резистентность организма. Они устойчивы к неблагоприятным внешним воздействиям за счет образования клеточного муцина и бактериального полисахарида, синтезируют антибиотикоподобные вещества (бактериоцины). Продукты жизнедеятельности нормальной микрофлоры кишечника, закисляя его содержимое, стимулируют его моторную функцию. Кроме того, метаболиты микрофлоры задействованы в энергообеспечении эпителиоцитов, регуляции нормальной пролиферации и дифференцировки клеток кишечника и др. [8–14]. Любые патологические изменения в организме отражаются на составе, свойствах и метаболической активности кишечной микрофлоры, которая, в свою очередь, участвует в регуляции функционального состояния макроорганизма, в основном через дистанционные взаимодействия, где в роли «сигнальных молекул» выступают ее метаболиты.
Важно отметить, что каждая КЖК образуется при ферментации субстрата бактериями определенного вида, поэтому по составу КЖК можно судить о функциональной активности конкретных представителей кишечной микрофлоры [15, 24, 25]. Участие данных метаболитов в локальных и системных функциях макроорганизма позволяет их использовать в качестве биохимических маркеров происходящих в нем процессов, в частности в кишечнике. Целью нашего исследования явилось изучение метаболической активности кишечной микрофлоры при функциональных нарушениях ЖКТ у детей раннего возраста с последующей коррекцией жидкими синбиотиками, содержащими КЖК.
Материалы и методы
В исследование включены 69 детей раннего возраста с минимальными пищеварительными дисфункциями, которые были разделены на две группы в зависимости от характера вскармливания. I группу (ГВ) составили 40 детей (средний возраст 9,15 ± 0,90 недель), находившихся на грудном вскармливании. II группу (ИВ) составили 29 детей (средний возраст 8,13 ± 0,98 недель), вскармливаемых искусственно смесями, содержащими в качестве углеводного компонента только лактозу. Мы проанализировали выраженность минимальных пищевых дисфункций в зависимости от характера вскармливания. Интенсивность синдрома кишечных колик была оценена по 3-балльной системе, где 1 балл – кишечные колики только в вечернее время, 2 балла – кишечные колики возникают после каждого кормления и в ночное время, 3 балла – кишечные колики беспокоят в течение всего дня. Нами установлено, что средняя интенсивность (в баллах) кишечных колик у детей, находящихся на грудном и искусственном вскармливании, достоверно не отличалась друг от друга: ГВ – 1,72 ± 0,12 балла, ИВ – 1,72 ± 0,13 балла. Выраженность синдрома срыгивания оценена по 5-балльной системе, предложенной Y. Vandenplas (1993) [26]. Частота возникновения и выраженность синдрома срыгивания у детей не отличалась в зависимости от характера вскармливания (ГВ – 1,87 ± 0,15 балла, ИВ – 1,95 ± 0,19 балла).
Консистенцию кала мы оценивали по Бристольской шкале форм кала [27]. В группе младенцев, находившихся на грудном вскармливании, средняя консистенция кала составила 6,75 ± 0,09 балла, во второй группе (ИВ) – 6,81 ± 0,07 балла (р > 0,05). Всем детям первых месяцев жизни с функциональными нарушениями ЖКТ проводилось копрологическое исследование. В зависимости от типа нарушения пищеварения (стеаторея 1 и 2 типа) и наличия слизи в кале мы проанализировали содержание и спектр КЖК методом ГЖХ-анализа (патент на изобретение РФ № 2145511 «Способ разделения смеси жирных кислот фракции С2–С7 методом газожидкостной хроматографии» от 09.04.1999. Авт. Н.С. Иконников, М.Д. Ардатская, В.Н. Бабин, О.Н. Минушкин и др.). Изучались следующие параметры: абсолютное содержание кислот, профили С2–С4 кислот (т.е. удельное содержание отдельной кислоты в общем пуле С2–С4 кислот рСн = Сн/С2 + С3 + С4), значения анаэробного индекса (АИ = С3 + С4/С2), отражающего окислительно-восстановительный потенциал внутрипросветной среды, уровень изокислот и отношение содержания изокислот к кислотам с неразветвленной цепью (изоСн/Сн).
Результаты исследования и их обсуждение
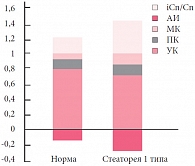
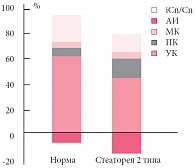
При стеаторее 1 типа (рис. 1) наблюдалось повышение содержания в основном масляной кислоты – в группе ГВ до 0,091 ± 0,008 ед, в группе ИВ – до 0,132 ± 0,008 ед. Данные изменения, возможно, были связаны с недостаточностью липазы у детей с функциональными нарушениями пищеварения за счет относительной экзокринной недостаточности поджелудочной железы, так как масляная кислота является одним из конечных продуктов деградации длинноцепочечных жирных кислот, поступающих в толстую кишку. При стеаторее 2 типа (рис. 2) значительно повышена доля пропионовой кислоты по сравнению с нормой и со значениями при стеаторее 1 типа: при ГВ – 0,170 ± 0,010 ед; при ИВ – 0,216 ± 0,010 ед. Известно, что пропионовая кислота является продуцентом строгих анаэробов, которые принимают участие в энтерогепатической циркуляции жирных кислот (7α-дигидроксилирование жирных кислот), увеличение уровня пропионовой кислоты, возможно, связано с нарушением желчеобразования и желчевыделения у детей с функциональными нарушениями ЖКТ. Достоверность полученных данных подтверждается результатами линейного регрессионного анализа. Мы обнаружили высокую степень корреляции между стеатореей 1 типа и уровнем масляной кислоты (при ГВ r = 0,877, при ИВ r = 0,83), между уровнем пропионовой кислоты и стеатореей 2 типа (при ГВ r = 0,82, при ИВ r = 0,68).
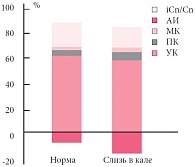
По результатам копрологического исследования у 37,7% детей с минимальными пищеварительными дисфункциями выявлено значительное количество светлой, прозрачной слизи. Отношение изомеров кислот к кислотам с неразветвленной цепью (рис. 3) у детей со слизью в кале оказалось значительно сниженным (p < 0,05) по сравнению с нормой (при ГВ – 0,257 ± 0,033 ед при норме 0,331 ± 0,064 ед, при ИВ – 0,189 ± 0,003 ед при норме 0,285 ± 0,005 ед). Данные изменения тесно связаны с нарушениями синтеза и секреции гликопротеидов и муцинообразования – снижением вязкости и увеличением количества слизи, повышением ее экскреции с калом, а также с активизацией некоторых видов анаэробов, обладающих крайне низкой способностью к протеолизу [28, 29]. Таким образом, можно констатировать, что при наличии минимальной пищеварительной дисфункции у детей развивается нарушение микробиоценоза кишечника, фиксируемое по изменению уровня и состава метаболитов микрофлоры, в частности КЖК. Изменение состава и активности кишечной флоры приводит, в свою очередь, к усугублению и поддержанию функциональной диспепсии.
Для коррекции функциональных нарушений ЖКТ у детей раннего возраста мы применяли жидкие синбиотические биокомплексы Нормофлорин Л (в состав входят L. acidophilus не менее 1010 КОЕ/мл) и Нормофлорин Б (в состав входят B. bifidum, B. longum не менее 1010 КОЕ/мл) производства ООО «Бифилюкс» (Россия), которые приготовлены на основе гидролизата белка и не содержат лактозу. Высокая эффективность данных биокомплексов обусловлена не только высоким содержанием физиологически активных клеток бифидо- и лактобацилл, но и составом органических кислот: КЖК (уксусная, масляная, пропионовая), а также янтарная и молочная кислоты. Препарат применяли по схеме: Нормофлорин Л по 2,5–5,0 мл утром и Нормофлорин Б по 2,5–5,0 мл вечером перед едой в течение 1 месяца. Биокомплексы Нормофлорин обладают антимикробной активностью за счет содержания бактериоцинов, ингибирующих рост гнилостных, газообразующих и болезнетворных бактерий. Они участвуют в формировании биопленки, предотвращающей адгезию чужеродных микробов. За счет содержащихся в биокомплексах Нормофлорин органических кислот pH кишки снижается до слабокислой реакции, что создает губительную среду для жизнедеятельности условно-патогенной микрофлоры.
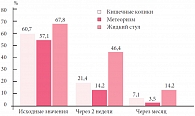
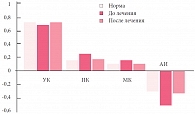
Эффективность проводимой коррекции мы оценивали на основании данных клинической симптоматики и изучения метаболической активности кишечной микрофлоры через 2 недели от начала приема биокомплексов Нормофлорин и после окончания курса коррекции. Нами отмечена положительная динамика со стороны клинических проявлений функциональных нарушений ЖКТ (рис. 4). До начала лечения кишечные колики беспокоили 42 (60,7%) новорожденных, через месяц колики наблюдались только у 5 (7,1%) детей. Метеоризм, вздутие живота до лечения наблюдались у 40 (57,1%) детей, а после окончания курса терапии отмечались только у одного ребенка. На фоне терапии отмечено значительное сокращение частоты жидкого стула в течение месяца (с 67,8 до 14,2%). Мы проанализировали изменения спектра КЖК и значения анаэробного индекса на фоне лечения Нормофлорином Л и Б (рис. 5). Исходно анализ профилей КЖК выявил резкое снижение доли уксусной кислоты, повышение долей пропионовой и масляной кислот, отклонение значений анаэробных индексов, отражающих окислительно-восстановительный потенциал внутрипросветной среды, в область резко отрицательных значений по сравнению с нормой.
Известно, что уксусная кислота является метаболитом облигатной микрофлоры и уменьшение ее доли свидетельствует о снижении активности и численности молочнокислых микроорганизмов (бифидо- и лактобактерий). Увеличение доли пропионовой и масляной кислот указывает на активацию условно-патогенной флоры и строгих анаэробов (бактероидов, эубактерий, фузобактерий, копрококков и др.). Результаты изучения значений АИ указывают на «анаэробизацию» среды, при которой происходит угнетение жизнедеятельности облигатных анаэробов за счет блокирования терминальных ферредоксинсодержащих ферментов и активации вследствие этого факультативных и остаточных штаммов. При повторном исследовании после курса лечения Нормофлорином Л и Б отмечалось формирование «нормопрофиля» С2–С4 кислот с тенденцией к нормализации значений анаэробного индекса, что соотносится с клинической симптоматикой.
Заключение
Таким образом, исследование метаболической активности микрофлоры позволяет оценить характер нарушений не только состава микрофлоры, но и пищеварения и может служить тонким биохимическим маркером наблюдаемых изменений. Результаты проведенного исследования показали, что применение Нормофлорина Л и Б у детей грудного возраста с функциональными нарушениями ЖКТ способствует быстрому купированию кишечных колик, прекращению срыгивания, нормализации стула и коррекции микрофлоры. На фоне лечения Нормофлорином отмечены положительные сдвиги в экосистеме толстой кишки, заключающиеся в восстановлении метаболической активности толстокишечной микрофлоры, тенденции к восстановлению показателей, характеризующих качественный (родовой) состав микроорганизмов и соотношение аэробных/анаэробных популяций микрофлоры.