Эстетические гинекологические операции у детей и подростков
- Аннотация
- Статья
- Ссылки
- English

Введение
Эстетические гинекологические операции у детей и подростков направлены на устранение врожденных аномалий наружных половых органов, возникающих преимущественно вследствие нарушения формирования пола. Нередко проводятся и операции для достижения косметического эффекта при гипертрофии малых половых губ, клиторомегалии, не ассоциированной с генетическими дефектами, атрофии и сужении входа во влагалище. Основная цель проведения подобных вмешательств – улучшение внешнего вида органов с анатомическими дефектами и повышение качества жизни пациенток.
На данный момент нет единого мнения, в каком возрасте проводить эстетические реконструктивные операции в случае аномалий развития наружных половых органов у пациентов педиатрического профиля. Вместе с тем разработано множество техник, которые активно применяются в клиниках всего мира.
В базах PubMed и Embase был проведен поиск обзоров литературы, систематических обзоров, метаанализов и клинических исследований на тему эстетических гинекологических операций у детей и подростков. Поиск осуществлялся с использованием комбинаций MESH-терминов: феминизирующая генитопластика, атипия наружных половых органов, педиатрия, нарушения формирования пола, врожденная гиперплазия коры надпочечников. По итогам анализа по названию и абстракту были отобраны статьи, полный текст которых находился в открытом доступе. Использовались публикации с подробным описанием хода и результатов операции, описанием клинических случаев и исследований в области детской и подростковой гинекологии, хирургического лечения врожденных нарушений половой системы. В результате поиска в базах данных PubMed и Embase при разнообразном сочетании ключевых слов было найдено 498 публикаций, которые подверглись скринингу по названию и абстракту. Для полнотекстового анализа было отобрано 120 статей, 31 из них – для цитирования.
Обсуждение
Нарушение формирования пола (НФП) – врожденное состояние, характеризующееся аномалией развития половых органов, вызванное генетическими дефектами или патологией эндокринной системы.
В основе аномалий полового развития могут лежать как хромосомные, так и не связанные с хромосомными аберрациями нарушения. Исходя из этого, все подобные заболевания можно разделить на три большие группы: хромосомные НФП; НФП 46, XX; НФП 46, XY.
В 2006 г. Педиатрическое эндокринологическое сообщество Лоусона Уилкинса (сейчас – Педиатрическое эндокринологическое сообщество) совместно с Европейским сообществом педиатрической эндокринологии пересмотрели классификацию и терминологию заболеваний, связанных с нарушением полового развития. Все заболевания разделили на пять подгрупп [1]:
- 46, XX НФП;
- 46, XY НФП;
- овотестикулярное НФП;
- 46, XX тестикулярное НФП;
- 46, XY полный гонадный дисгенез.
Мы рассматривали феминизирующие и эстетические пластические операции в детской гинекологии у пациентов с женским кариотипом – 46, XX и 45, X. Соответственно описали методики, направленные на устранение аномалий развития половых органов у пациенток, входящих в первую, третью и четвертую подгруппы, согласно указанной классификации, а также имеющих синдром Шерешевского – Тернера (хромосомное НФП).
К нарушениям формирования пола у пациенток с кариотипом 46, XX относят:
- нарушения развития яичников (овотестикулярное НФП, тестикулярное НФП);
- гиперандрогению (врожденную гиперплазию надпочечников, фетоплацентарную гиперандрогению, материнскую гиперандрогению);
- другие нарушения (экстрофию клоаки, атрезию влагалища, синдром Майера – Рокитанского – Кустера – Хаузера).
Хирургическое лечение НФП включает в себя целый ряд техник и методов, применение которых напрямую зависит от диагностированной аномалии [2]. Выделяют:
- кольпопластику с сохранением полового члена с/без сопутствующей билатеральной гонадэктомии;
- кольпопластику с погружением в подлежащую ткань губчатого и пещеристых тел с/без сопутствующей билатеральной гонадэктомии;
- кольпопластику и клиторопластику с сопутствующей билатеральной гонадэктомией;
- моделирование влагалища по способу Джузеппе Веккьетти;
- кольпопластику с использованием кожных лоскутов;
- кольпопластику кишечным сегментом.
У пациенток с низким слиянием урогенитального синуса (УГС) на уровне наружного сфинктера уретры или несколько дистальнее чаще применяют метод задней лоскутной вагинопластики. При высоком слиянии УГС активно используют метод тотальной урогенитальной мобилизации по A. Peña, иногда в сочетании с выкраиванием промежностного лоскута. У пациенток с недоразвитием или агенезией влагалища золотым стандартом лечения признан метод моделирования влагалища по Джузеппе Веккьетти.
Врожденная гиперплазия коры надпочечников (ВГКН), на долю которой в структуре НФП приходится 60%, – аутосомно-рецессивное заболевание, характеризующееся дефектом одного или нескольких ферментов, участвующих в синтезе минералокортикоидов [3]
Причиной вирилизации при кариотипе 46, ХХ является гиперсекреция андростендиона. Общемировой скрининг младенцев, включавший 6,5 млн новорожденных, показал, что частота ВГКН составляет 1 случай на 15 тыс. живорожденных. Самая высокая частота – у новорожденных еврейского, испаноязычного, славянского или итальянского происхождения [4].
Основное звено патогенеза – нарушение синтеза кортизола. Клинические проявления ВГКН зависят от типа ферментативного дефекта.
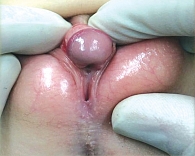
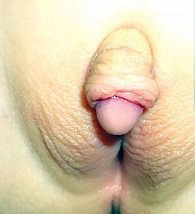
Морфологические изменения при ВГКН включают в себя увеличение фаллоса, уменьшение размера входа во влагалище и изменение его расположения (объединяются в урогенитальный синус). Насколько сильно ни была бы выражена вирилизация, внутренние мюллеровы структуры всегда присутствуют. Выделяют несколько дефектов:
- дефект 21-гидроксилазы (наиболее распространенная форма ВГКН);
- дефект 11-бета-гидроксилазы;
- дефект 3-бета-гидроксистероиддегидрогеназы (наименее распространенная форма ВГКН).
- Дефект 21-гидроксилазы в свою очередь подразделяется на три формы:
- классическую с «кризисом потери соли» (наиболее тяжелая форма, распространена в большей степени, чем вирильная);
- классическую простую вирильную;
- неклассическую с поздним началом (наиболее распространенная).
Дефект 21-гидроксилазы – наиболее распространенная форма ВГКН, наследуется по аутосомно-рецессивному признаку. Этот фермент кодирует ген CYP21A2 и гомологичный ему CYP21A1P, которые связаны с локусом кластера антигенов лейкоцитов (HLA) на коротком плече шестой хромосомы. Способствует образованию дефицита минералокортикоидов, накоплению андрогенов и 17-гидроксипрогестерона (17-ОНР), что вызывает признаки маскулинизации. В результате рождается ребенок с женским генотипом, но с разной степенью вирилизации. Клинические проявления дефицита 21-гидроксилазы – гипонатриемия, гиперкалиемия, гипотония, а также вирилизация. При любой форме классического дефицита этого фермента новорожденные с женским генотипом имеют гермафродитные наружные половые органы: увеличенный клитор, сращение больших половых губ, урогенитальный синус. Нарушена также репродуктивная функция, которая проявляется аменореей и ановуляторным циклом. При неклассической форме симптомы проявляются до подросткового возраста, однако сразу после рождения, как правило, отсутствуют. У больных девочек возможны раннее появление лобковых волос, гирсутизм и олигоменорея.
В ряде клинических исследований описана ВГКН с формой дефицита 21-гидроксилазы, но при этом без дефекта в генах CYP21A2 и CYP21A1P.
Диагноз этой формы ВГКН можно поставить еще на этапе внутриутробного развития плода. При проведении анализа амниотической жидкости во втором триместре беременности определяется повышенный уровень 17-OHP.
В постнатальном периоде диагноз подтверждается повышенным уровнем 17-OHP в сыворотке крови. У новорожденных он достигает 9–50 нг/мл. Однако уже ко второму дню после рождения его уровень в сыворотке снижается. Если подобного снижения не происходит, диагноз ВГКН с большей вероятностью подтверждается.
Отметим, что повышенный уровень 17-ОНР характерен не только для классической формы врожденной гиперплазии коры надпочечников, но и для ВГКН с дефектом 11-бета-гидроксилазы и 3-бета-гидроксисстероиддегидрогеназы.
Распространенность дефицита 21-гидроксилазы составляет от 1:14000 до 1:18000 живых новорожденных в мире [3].
Дефицит 11-бета-гидроксилазы – аутосомно-рецессивное заболевание, ассоциированное с дефектом в гене CYP11B1. Характеризуется накоплением дезоксикортикостерона, гиперпродукцией адренокортикотропного гормона и снижением выработки кортизола, что приводит к артериальной гипертензии, сокращению выведения солей из организма (дезоксикортикостерон – мощный минералокортикоид). Отмечается также чрезмерная продукция андрогенов надпочечниками (дегидроэпиандростерона, андростендиона и тестостерона), что способствует вирилизации. Подтвердить эту форму ВГКН можно с помощью анализа сыворотки крови на стероиды, а также на уровень 17-ОНР.
Дефект 3-бета-гидроксистероиддегидрогеназ приводит к накоплению прегненолона. В печени этот стероидный гормон трансформируется в тестостерон, что вызывает вирилизацию. Клинические проявления этой формы – аномальное количество потери соли в силу дефицита синтеза минералокортикоидов. Данная форма ВГКН подтверждается с помощью выявления повышенного уровня дегидроэпиандростерона или его сульфатированного метаболита в сыворотке крови.
Таким образом, каждый случай НФП подразумевает мультидисциплинарный подход, включающий ряд обязательных обследований разными специалистами: педиатром, детским хирургом-урологом, генетиком [5, 6] и хирургом-гинекологом.
Временные рамки для проведения операции
Чтобы придать анатомически правильный и физиологически функциональный вид наружным половым органам у пациентов с НФП, требуется комплексный хирургический подход, включающий:
- определение места слияния уретры и влагалища в урогенитальный синус с последующим их разделением;
- формирование характерного для пациентов женского пола урогенитального синуса (влагалище открывается на поверхность промежности);
- проведение вагинопластики, интроитопластики, лабиопластики (по необходимости), устранение явления клиторомегалии.
Исходя из последних клинических рекомендаций Российского общества акушеров-гинекологов, первый этап феминизирующей пластики наружных половых органов проводится в первые годы жизни ребенка. Выполнение последующих хирургических вмешательств (при необходимости) рекомендуется проводить в пубертатном периоде [3].
Рандомизированных клинических исследований, позволяющих четко определить время для проведения хирургического вмешательства, не проводилось. Соответственно единого мнения о возрасте пациентов, подходящем для проведения феминизирующей генитопластики, нет.
В исследовании R.M. Sturm и соавт. средний возраст пациенток, которым проводились комбинированные феминизирующие операции – клиторопластика и вагинопластика, составил 11,3 месяца. При этом вагинопластика как отдельная операция выполнялась в среднем в 53 месяца, а клиторопластика – в 70 месяцев [7].
Рекомендуется сократить время между вагинопластикой и началом половой жизни пациентки, чтобы снизить риск возможного стеноза просвета влагалища – одного из самых частых осложнений феминизирующих операций. Если вагинопластика рекомендуется пациентке в детском возрасте, лучше ее проводить в два этапа [8].
A. Oshiba и соавт. считают целесообразным выполнение вагинопластики после наступления пубертатного периода только в тех случаях, когда отмечается сильная гипоплазия влагалища, которую можно исправить только при дополнительном использовании невагинальной ткани [9].
В свою очередь основным преимуществом ранней одноэтапной вагинопластики является то, что возможно использование избытка ткани УГС для реконструкции передней стенки влагалища.
Европейское общество детской эндокринологии и Общество педиатрической эндокринологии Лоусона Уилкинса рекомендуют одноэтапную операцию при тяжелой форме вирилизации и высоком слиянии УГС в возрасте до 12 месяцев и считают нецелесообразной феминизирующую пластику между первым годом жизни и половым созреванием [10].
В исследовании D. Joshua и соавт. большинству пациенток проводилась вагинопластика как основное хирургическое вмешательство при ВГКН. Клиторопластика выполнялась менее чем в половине случаев. В целом данные показывают, что феминизирующие операции при ВГКН осуществляются в возрасте десяти месяцев и характеризуется незначительной частотой осложнений и небольшим количеством повторных операций [11].
В исследовании A. Baskin и соавт. описаны пациентки со степенью вирилизации гениталий по шкале Прадера > 2, в возрасте до двух лет и без феминизирующих пластических операций в анамнезе. Хирургическое вмешательство у пациенток, которым выполнялась ранняя генитопластика, предполагало выделение и разделение урогенитального синуса, приведение влагалища и уретры в типичное положение и устранение клиторомегалии (при необходимости). Из 57 пациенток 50 (80%) была проведена генитопластика в раннем возрасте. Всем им выполнялась вагинопластика, 38 (76%) – клиторопластика, 31 (62%) – частичная мобилизация урогенитального синуса, 4 (8%) – полная мобилизация урогенитального синуса. 3 (6%) – передний сагиттальный лоскутный трансректальный доступ (ASTRA) для оперативного вмешательства на УГС с высоким слиянием, 41 (82%) – выкраивание лоскута промежности (Fortunoff flap) для увеличения задней части влагалища. У 24 (48%) пациенток использовали избыток УГС для пластики передней части влагалища. Затем всем пациенткам была проведена интроитопластика (большая и малая пластика губ) [12].
Виды оперативных вмешательств
В качестве хирургического лечения НФП применяют феминизирующие пластические операции: кольпопластику, клиторопластику, лабиопластику, частичную/полную мобилизацию урогенитального синуса и интроитопластику [13]. Основными целями феминизирующих операций являются половая самоидентификации пациентки, социальная и психологическая адаптация ребенка в коллективе, а также возможность ведения половой жизни в будущем.
Хирургическое лечение следует проводить пациенткам с вирилизацией III–V стадий по шкале Прадера (рис. 1–3) [14]. Если острой необходимости в клиторопластике нет (стадии I и II по шкале Прадера), рекомендуется не прибегать к этому методу на ранних этапах развития ребенка.
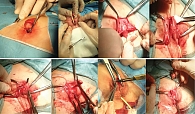
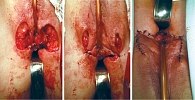
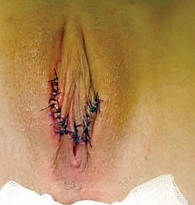
Феминизирующие операции можно выполнять в один или два этапа. При оперативном вмешательстве в несколько этапов в первую очередь выполняют рассечение УГС с последующей катетеризацией мочевого пузыря, выделением головки клитора и гипертрофированных кавернозных тел с окружающим их сосудисто-нервным пучком. Далее иссекают гипертрофированные кавернозные тела с сохранением головки клитора и сосудисто-нервного пучка с последующей фиксацией головки клитора к культе кавернозных тел. Затем формируют малые половые губы (рис. 4). Вторым этапом выполняют интроитопластику (рис. 5).
Исходя из сказанного, можно сделать вывод, что феминизирующие операции при НФП состоят из нескольких этапов: вагинопластики, клиторопластики, лабиопластики и интроитопластики.
Выделяют несколько типов вагинопластики:
- формирование неовлагалища с использованием экстравагинальной ткани;
- вагинопластику промежностным лоскутом (Fortunoff flap) для создания задней стенки влагалища;
- pull-through перитонеальную вагинопластику;
- полную/частичную мобилизацию урогенитального синуса;
- вагинопластику методом Джузеппе Веккьетти и ее лапароскопически ассоциированные модификации;
- передний сагиттальный трансректальный доступ (ASTRA) при высоком слиянии УГС.
Выбор типа кольпопластики напрямую зависит от степени атрофии влагалища, которая в свою очередь определяется выраженностью компенсаторных и декомпенсаторных факторов, влияющих на уровень эстрогенизации эпителия [15].
Формирование неовлагалища выполняется при атрезии влагалища и невозможности использования местных тканей для его создания. Для выполнения этой операции чаще используется участок толстой кишки. S. Delshad и соавт. в рандомизированном исследовании описали процедуру создания неовлагалища у 39 пациенток с использованием участка сигмовидной кишки – доступ по Пфанненштилю с дальнейшим выделением участка сигмовидной кишки размером до 10–15 см для непосредственного формирования неовлагалища. На промежности был сделан Н-образный разрез с последующим разрезом между мочеиспускательным каналом и прямой кишкой для помещения в эту область неовагинального трансплантата. Мобилизованная сигмовидная кишка была оттянута вниз к атрезированному участку влагалища с последующим наложением рассасывающихся швов. Проксимальный конец неовлагалища фиксирован к крестцовому выступу для предотвращения опущения стенок или полного выпадения. В послеоперационном периоде всем пациенткам выполнялось самостоятельное бужирование на протяжении как минимум восьми недель [16]. Эта операция более травматичная, чем перитонеальная вагинопластика, частота осложнений выше. L. Cao и соавт. сравнивали осложнения после перитонеальной и «сигмовидной» вагинопластики. У пациенток, прошедших первую процедуру, отмечались меньший объем кровопотери, меньшая продолжительность операции и быстрый период восстановления [17].
Рull-through перитонеальная вагинопластика применяется для создания неовлагалища с использованием перитонеального лоскута. Подобный метод был впервые описан С.Н. Давыдовым в 1969 г. На текущий момент этот способ модифицирован и выполняется следующим образом. В передней брюшной стенке устанавливают троакар. Через него в брюшную полость вводят диссектор, с помощью которого разделяют пространство между мочевым пузырем и прямой кишкой. В него помещают будущую неовагину. Крестцово-маточные связки пересекаются с обеих сторон для создания более широкого пространства для фиксации влагалища. Лоскуты брюшины протягивают в область между мочеиспускательным каналом и прямой кишкой, предварительно рассеченной во всех направлениях тупым способом. Верхнюю часть неовлагалища отделяют от содержимого брюшной полости, закрывая брюшину примерно в 15 см от наружного отверстия входа во влагалище [17]. Однако с учетом возможности проведения процедуры бужирования в отсутствие тотальной атрезии влагалища очень небольшое количество пациенток нуждаются в создании неовагины.
R. Dòmini и соавт. в 1997 г. впервые использовали передний сагиттальный трансаноректальный доступ (ASTRA) у пациентки с высоким слиянием УГС. В основе данного метода лежит рассечение передней стенки прямой кишки по средней линии, а также передней порции анального сфинктера, что позволяет лучше визуализировать влагалище, но значительно затрудняет задний трансаноректальный доступ [18].
При низком слиянии УГС наиболее оптимальным вариантом хирургического лечения является лоскутная вагинопластика методом Fortunoff flap. Однако при использовании данной техники выкраиваемый лоскут на промежности имеет слишком широкое основание и при его подшивании к стенке УГС не получается соблюсти косметический эффект. Сопоставление боковых лоскутов для формирования больших половых губ затруднено. Соответственно в качестве модификации данного метода предлагается выкраивать лоскуты с более узким основанием [19].
При высоком слиянии УГС активно используется метод тотальной урогенитальной мобилизации по A. Peña, предложенный в 1997 г. В ходе такой операции используется задний сагиттальный доступ. Выделяют и тотально мобилизуют урогенитальный синус на всем протяжении. С вентральной стороны отделяют УГС от лобковой кости. Диссекция проводится латерально или вентрально, чтобы сформировать доступ к позадилобковому клетчаточному пространству. Далее вытягивают края влагалища по мере выполнения циркулярной диссекции УГС с обязательным рассечением пубоуретральной связки. Это происходит до тех пор, пока края влагалища не соприкоснутся с промежностью для их сшивания [20].
Клиторопластика
По мере изучения анатомии клитора техники и методики клиторопластики совершенствуются. В середине XX в. была распространена ампутация клитора у пациенток с клиторомегалией, что на данный момент считается калечащей операцией [21]. Кроме того, проводилась клиторопластика, сопровождавшаяся тотальным удалением кавернозных тел с сохранением головки клитора. Основным осложнением такой операции был некроз [22]. С появлением тенденции к органосохраняющим операциям был предложен способ погружения гипертрофированного тела клитора в подлежащую подкожно-жировую клетчатку [23]. Далее рассматривались методы для сохранения чувствительности дорсального сосудисто-нервного пучка. Для минимизации рисков его повреждения был предложен вентральный доступ с продольным рассечением фасции Бака и частичной резекцией кавернозных тел [24]. Однако из-за риска атрофии головки клитора данный метод был несколько модифицирован: стали применять технику субтунической тотальной редукционной клиторопластики, при которой проводится продольный разрез фасции Бака и белочной оболочки тела клитора над каждым кавернозным телом по обе стороны от сосудисто-нервных пучков. Далее выделяют кавернозные тела и иссекают их дистальные отделы, проксимальный и дистальный концы прошивают лигатурами [25]. Подобный тип клиторопластики, широко применяемый в настоящее время для лечения пациенток с клиторомегалией, носит название нервосберегающей клиторопластики. В ходе операции после выделения клитора из окружающей ткани рассекают фасцию Бака по средней линии. Далее подворачивают ее кверху вместе с сосудисто-нервными пучками, располагающимися циркулярно вокруг белочной оболочки. Проводят также мобилизацию головки клитора. Участок гипертрофированных кавернозных тел удаляют на 2 см дистальнее их бифуркации. Головку клитора подшивают к оставшимся участкам. При необходимости выполняется дополнительное сближение малых половых губ с клитором [26–28].
Все современные методы хирургической коррекции клиторомегалии основаны на сохранении дорсального сосудисто-нервного пучка головки клитора для поддержания его нормального функционирования [2, 29].
Интроитопластика
При ВГКН обычно применяют интроитопластику с использованием М-образного кожного лоскута (рис. 5). Данная операция проводится в основном с разделением мочеполовых путей, чтобы избежать восходящей инфекции мочевыделительной системы, которая может быть связана с ведением половой жизни. Мочевые и половые пути можно разделять с использованием местных тканей или фрагментов урогенитального синуса. При выполнении пластики с формированием М-образного кожного лоскута отворачивают выделенный лоскут на промежность, мобилизуют стенки влагалища так, чтобы его длины хватило для опущения стенок на основание промежности без существенного натяжения. Далее стенозированную часть влагалища радиально рассекают до расширенной части. Вершины М-образных разрезов соединяют простыми узловыми швами с углами радиальных разрезов на стенке влагалища. Это приводит к формированию широкого входа во влагалище. Однако наружный сфинктер уретры при этом остается в глубине УГС, что может приводить к рецидивирующим инфекциям.
При выполнении интроитопластики с использованием М-образного кожного лоскута и разделением мочеполовых путей с помощью фрагментов УГС в мочевой пузырь вводят катетер Фолея. Далее происходят мобилизация задней стенки УГС и ее рассечение в области бифуркации в поперечном направлении. Затем осуществляют циркулярный разрез по верхнему радиусу, разделяя уретру и влагалище. Передняя стенка влагалища замещается урогенитальным синусом, а дефект в уретре пришивается двурядным швом.
Лабиопластика
Лабиопластику применяют в комплексе с вагинопластикой и клиторопластикой или как самостоятельную операцию для устранения каких-либо анатомических дефектов, вызывающих физический и эстетический дискомфорт. К данной операции чаще прибегают при выраженной гипертрофии или асимметрии малых половых губ. Выделяют несколько подходов к резекции малых половых губ:
- краевую резекцию;
- клиновидную резекцию и ее модификации (рис. 6);
- комбинированные методы краевой и клиновидной резекции.
Если сравнивать результаты операций, проведенных с использованием каждой из перечисленных методик, клиновидная резекция является наиболее эстетичным методом, поскольку способствует сохранению естественного рельефа краевой части малых половых губ после резекции. При правильном проведении операции также максимально сохраняются иннервация и кровоснабжение, не нарушается чувствительность. В то же время краевая резекция подразумевает иссечение наиболее выступающего участка гипертрофированной малой половой губы без сохранения естественного резецированного края [30].
Техника клиновидной резекции достаточно проста: после нанесения разметки, по которой выполняется резекция, на края малых половых губ накладываются зажимы Кохера, с помощью которых отводят края гипертрофированных половых губ в латеральную сторону от клитора. Далее по намеченным линиям иссекают избыток ткани. При этом коагуляцию не используют, а резецированные края ушивают непрерывным швом с использованием рассасывающегося шовного материала размером 4/0 [31].
Существует несколько модификаций классической клиновидной резекции. Так, техника заднелатеральной клиновидной резекции предполагает обязательное сохранение сосудисто-нервных пучков, находящихся в центральной части гипертрофированной половой губы. В результате данной модификации клиновидной резекции чувствительность максимально сохраняется, ишемические проявления в дистальных отделах резецируемой половой губы отсутствуют [32].
Преимущество срединной клиновидной резекции помимо сохранения естественного рельефа краев малых половых губ состоит в том, что снижается объем иссекаемой клетчатки, а следовательно, риск контрактуры рубца [33].
При нижней клиновидной резекции используется бабочкообразный метод фиксации гипертрофированных частей малых половых губ к внутренней поверхности бедра. После нанесения ориентировочной разметки проводят Z- или W-образную резекцию участка малых половых губ. В дальнейшем накладывают два ряда швов: первый – на мышечную пластинку слизистой оболочки, второй – на собственную пластинку и эпителий. Данный метод позволяет наиболее точно определить процент асимметрии и правильно подобрать объем резекции гипертрофированных участков малых половых губ [34].
Заключение
Эстетические операции в детской гинекологии направлены преимущественно на устранение врожденных дефектов развития наружных половых органов. Техники проведения постоянно совершенствуются и модифицируются для максимального сохранения функции и внешнего вида реконструируемой области. Методики выполнения операций в клиниках различны, но общие закономерности в большинстве случаев одинаковы. При грамотном подходе к выбору хирургического лечения педиатрических пациентов с НФП и пороками развития наружных половых органов можно добиться высоких результатов и улучшить качество жизни молодых пациенток.
Ye.V. Sibirskaya, PhD, Prof., I.V. Karachentsova, PhD, T.N. Ivanovskaya, I.A. Melenchuk, Yu.A. Kirillova, A.S. Annakulieva, Ye.D. Nakhapetyan
N.I. Pirogov Russian National Research Medical University
Russian Children's Clinical Hospital of the N.I. Pirogov Russian National Research Medical University
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Yelena V. Sibirskaya, elsibirskaya@yandex.ru
Aesthetic gynecological operations in children and adolescents are aimed at eliminating congenital anomalies of the structure of the external genitalia, which usually occur as a result of a violation of the formation of sex. In addition, operations are often performed to achieve a cosmetic effect in conditions such as hypertrophy of the labia minora, clitoromegaly (not associated with genetic defects), atrophy and narrowing of the entrance to the vagina. At the moment, there is no consensus on at what age to perform aesthetic reconstructive surgery for abnormalities of the development of external genitalia in pediatric patients. At the same time, many techniques have been developed that are actively used in clinics around the world. The article considers the most practical and least traumatic, with a low percentage of complications, methods of plastic surgery in children and adolescents with congenital malformations and cosmetic defects of the external genitalia. A search for literature reviews, systematic reviews, meta-analyses and clinical studies on the topic of aesthetic gynecological operations in gynecology of children and adolescents was conducted in the PubMed and Embase. The search was carried out using combinations of MESH terms: feminizing genitoplasty, atypia of the external genitalia, pediatrics, disorders of sex formation, congenital hyperplasia of the adrenal cortex. The articles were analyzed, the full text of which was in the public domain, with a detailed description of the course and results of the operation, a description of clinical cases and studies in the field of pediatric and adolescent gynecology, mainly surgical treatment of congenital disorders of the reproductive system. As a result of a search in the PubMed, Embase databases with a diverse combination of keywords, 498 publications were found that were screened by name and abstract. 120 articles were selected for full-text analysis, 31 of them were selected for citation.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.