количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Практика
Метаболическая (цитопротективная) терапия менопаузальных расстройств
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и Ангиология" № 1
- Аннотация
- Статья
- Ссылки
В статье описываются возможности отечественного метаболического препарата Милдронат в коррекции системных метаболических нарушений у женщин с климактерическими расстройствами и менопаузальным метаболическим синдромом.
Показано, что включение Милдроната в схемы лечения климактерического синдрома у женщин, не получающих заместительную гормональную терапию, способствует существенному уменьшению психовегетативных расстройств, компенсирует энергодефицит и повышает адаптационный потенциал.
Показано, что включение Милдроната в схемы лечения климактерического синдрома у женщин, не получающих заместительную гормональную терапию, способствует существенному уменьшению психовегетативных расстройств, компенсирует энергодефицит и повышает адаптационный потенциал.
Доказано кардиопротективное, антиангинальное, антигипоксическое, ангиопротективное действие Милдроната у лиц с сердечно-сосудистыми заболеваниями.
В статье описываются возможности отечественного метаболического препарата Милдронат в коррекции системных метаболических нарушений у женщин с климактерическими расстройствами и менопаузальным метаболическим синдромом.
Показано, что включение Милдроната в схемы лечения климактерического синдрома у женщин, не получающих заместительную гормональную терапию, способствует существенному уменьшению психовегетативных расстройств, компенсирует энергодефицит и повышает адаптационный потенциал.
Показано, что включение Милдроната в схемы лечения климактерического синдрома у женщин, не получающих заместительную гормональную терапию, способствует существенному уменьшению психовегетативных расстройств, компенсирует энергодефицит и повышает адаптационный потенциал.
Доказано кардиопротективное, антиангинальное, антигипоксическое, ангиопротективное действие Милдроната у лиц с сердечно-сосудистыми заболеваниями.
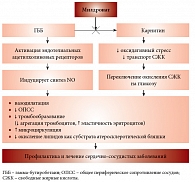
Рис. 1. Механизм действия Милдроната
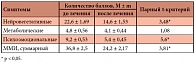
Таблица 1. Динамика модифицированного менопаузального индекса (ММИ) после негормональной терапии
На сегодняшний день существует несколько подходов к выбору средств для коррекции системных нарушений у женщин с менопаузальным метаболическим синдромом (МС). Несомненный приоритет принадлежит заместительной гормональной терапии (ЗГТ). Однако именно этот метод лечения вызывает среди ученых наибольшее число разногласий, к тому же его можно применять не у всех женщин. В реальной практике перед врачом встает сложная задача выбора препаратов, которые могли бы не только положительно влиять на различные проявления климактерических расстройств, но и как минимум не усугублять имеющиеся метаболические нарушения.
Милдронат в коррекции системных метаболических нарушений у женщин с менопаузальным МС
Новым направлением коррекции системных метаболических нарушений у женщин с климактерическими расстройствами и менопаузальным МС может стать использование отечественного препарата Милдронат. Милдронат является структурным аналогом гамма-бутиробетаина (ГББ), предшественника карнитина. При его приеме в организме увеличивается концентрация ГББ и уменьшается количество карнитина. Именно карнитин является тем транспортным средством, с помощью которого длинноцепочечные жирные кислоты поставляются в митохондрии. Преимущество Милдроната заключается в том, что препарат опосредованно тормозит бета-окисление свободных жирных кислот в митохондриях, препятствуя их транспорту. При этом при приеме Милдроната в митохондриях не возрастает концентрация недоокисленных, промежуточных продуктов метаболизма жирных кислот, которые при активации свободнорадикальных процессов служат источником образования токсических липопероксидов. Милдронат активирует оба наиболее важных фермента цикла аэробного окисления глюкозы:
Неблагоприятные атерогенные сдвиги в липидном спектре крови, возникающие в организме женщины в связи с утратой защитной роли женских половых гормонов, делают обоснованным использование Милдроната с целью коррекции данных нарушений. Некоторые исследователи показали, что на фоне приема Милдроната происходит снижение уровня холестерина липопротеидов низкой плотности (ХС ЛПНП), триглицеридов (ТГ) и холестерина липопротеидов очень низкой плотности (ХС ЛПОНП), повышается связывание ЛПНП с рецепторами аполипротеина В-100 (апоВ100) [3]. У женщин в пери- и постменопаузе нарушается баланс вазоактивных медиаторов, при этом повышается выработка эндотелием вазоконстрикторов и снижается секреция вазодилататоров, особенно оксида азота, что приводит к нарушению вазорегулирующей функции эндотелия сосудов, снижению резерва дилатации микроциркуляторного русла.
Эндотелиальная дисфункция (ЭД) и снижение выработки эндотелием оксида азота у женщин в перименопаузе усугубляет инсулинорезистентность (ИР), являющуюся следствием как дефицита эстрогенов, так и МС. Повышенное количество свободных жирных кислот при висцеральном ожирении приводит к дислипидемии, прогрессированию ИР и гипергликемии. Гипергликемия, в свою очередь, вызывает повышенное образование свободных радикалов, то есть оксидативный стресс. В развитии ЭД у женщин с МС огромную роль играют процессы свободнорадикального окисления. При этом свободные радикалы связываются с липидами и молекулами оксида азота (NO), что приводит к образованию субстрата атеросклеротической бляшки и потере защитных антиатеросклеротических свойств NO [4]. В этой связи Милдронат может служить препаратом выбора, поскольку, с одной стороны, он модулирует выработку оксида азота сосудистой стенкой, не вызывая эффекта обкрадывания, с другой стороны, уменьшает оксидативный стресс и окисление липидов, уменьшая тем самым проявления ЭД (рис. 1).
Наряду с активацией митохондриального аэробного окисления глюкозы Милдронат подавляет синтез карнитина и способствует накоплению гамма-бутиробетаина, концентрация которого возрастает в десятки раз. Оказалось, что этот процесс играет не менее важную роль в механизме действия Милдроната, чем собственно торможение бета-окисления, так как гамма-бутиробетаин структурно схож с ацетилхолином. Повышение концентрации гамма-бутиробетаина в плазме крови влечет за собой активацию ацетилхолиновых рецепторов в эндотелии кровеносных сосудов, что стимулирует синтез оксида азота и способствует увеличению эндотелий-зависимой вазодилатации. Эти же механизмы участвуют в подавлении агрегационной активности тромбоцитов [5]. Известно, что NO препятствует агрегации тромбоцитов. Такое воздействие на свертывающую систему, естественно, наблюдается и при применении Милдроната. И, наконец, именно повышенной концентрацией NO объясняется наблюдаемое в клинике увеличение эластичности эритроцитов при курсовом введении Милдроната больным ишемической болезнью сердца. В совокупности эти эффекты и обусловливают положительное влияние Милдроната на микроциркуляцию и при лечении больных с нарушениями кровообращения в мозге. Однако NO ответственен и за некоторые побочные эффекты Милдроната. Так, не рекомендуется назначать Милдронат на ночь, так как при этом повышается сексуальная активность больного. В связи с притоком кислорода в мозг у некоторых больных при этом нарушается сон.
Подчеркнем, что ингибирование ГББ-гидроксилазы Милдронатом является обратимым: препарат не блокирует этот фермент, а попросту занимает каталитический центр ГББ-гидроксилазы, препятствуя тем самым превращению ГББ в карнитин. Если применять Милдронат на фоне физической нагрузки один раз в сутки, наблюдается эффект последействия: при снижении концентрации Милдроната (например, у спортсменов после тренировки) накопившийся ГББ тут же превращается в карнитин, и в митохондрии поставляются жирные кислоты, которые способствуют производству энергии во время восстановительного периода у спортсменов, а запасы гликогена в это время интенсивно восстанавливаются (реакция гиперкомпенсации).
При отсутствии нагрузки также имеет место фармакологический тренинг миокарда – адаптация клеток к снижению потока жирных кислот и активация альтернативного пути производства АТФ – окисления глюкозы. Именно поэтому действие Милдроната оказывает на организм человека эффект прекондиционирования (precondition), который, как известно, предупреждает инциденты инфаркта в условиях ишемизации миокарда. Таким образом, при пиковых нагрузках и ишемии на фоне применения Милдроната имеет место включение кислородосберегающего окисления глюкозы, а в период восстановления при нормальном уровне кислорода – усиление процесса окисления жирных кислот.
Учитывая механизмы формирования артериальной гипертензии (АГ) у женщин в перименопаузе, препараты, ингибирующие ренин-ангиотензин-альдостероновую систему (РААС), являются основными средствами в силу их доказанной метаболической нейтральности и мощной органопротекции. В некоторых исследованиях было показано, что применение Милдроната у больных АГ в сочетании с ингибитором ангиотензинпревращающего фермента (иАПФ) способствовало усилению гипотензивного эффекта последнего, снижению показателей нагрузки давлением, нормализации суточного профиля артериального давления (АД) в большей степени, чем монотерапия иАПФ.
За последние несколько лет в отечественной литературе появилось много публикаций, посвященных вопросу менопаузальных расстройств. В большинстве своем они представлены анализом крупных зарубежных исследований, которые были выполнены с участием женщин разной этнической принадлежности, с различным социальным статусом, что делает невозможным экстраполирование данных, полученных при обследовании лиц, проживающих в другой стране, на российских женщин (по причине различий в условиях существования, образовательном и социальном статусе). В этой связи несомненный интерес представляет исследование У.В. Зимовиной, проведенное на российской популяции женщин [6].
В работе У.В. Зимовиной (2007) проведено изучение особенностей вегетативного регулирования у женщин в период ранней постменопаузы с физиологическим и патологическим ее течением, а также изучено влияние различных видов терапии климактерического синдрома на состояние вегетативной нервной системы. Изучение структуры и выраженности вегетативных нарушений проводили с помощью анкетирования; оценка вегетативного тонуса, реактивности и обеспечения физической деятельности проводилась в состоянии покоя и при выполнении экспериментально-клинических проб на основании спектрального и временного анализа вариабельности сердечного ритма методом кардиоинтервалографии.
Несмотря на возрастающий интерес к изучению вариабельности ритма сердца (ВРС), как показателя, характеризующего состояние вегетативной нервной системы, публикации, посвященные ВРС у женщин в климактерическом периоде, немногочисленны. В исследовании было показано, что период ранней постменопаузы характеризуется напряжением механизмов адаптации и формированием энергодефицитного состояния, проявляющегося снижением рефлекторной вегетативной регуляции и усилением гуморально-метаболического влияния на сердечный ритм. У женщин с физиологическим течением климактерия сохраняется нормальный уровень вегетативного обеспечения деятельности.
Развитие климактерического синдрома (КС) характеризуется психовегетативной дезадаптацией, маркерами которой являются относительная гиперсимпатикотония в покое, значительное снижение вегетативной реактивности и эрготропная ареактивность при обеспечении физической деятельности, а также психоэмоциональные нарушения в виде высокой личностной и ситуативной тревожности, эмоциональной нестабильности, выраженных депрессивных расстройств и ухудшения показателей самочувствия, активности, настроения. Заместительная гормональная терапия эффективно устраняет симптомы патологического климакса, однако не компенсирует полностью явления энергодефицита.
Автор исследования делает вывод о том, что у женщин, не получающих ЗГТ, включение в терапию КС нейротропных и метаболических препаратов (Милдронат) способствует значительному уменьшению психовегетативных расстройств, компенсирует явление энергодефицита и повышает адаптационный потенциал (табл. 1). Ранее уже были получены положительные результаты применения Милдроната при климактерической миокардиодистрофии –невоспалительном поражении миокарда, связанном с дефицитом эстрогенов и характеризующемся нарушением обменных процессов, приводящих к скрытому или явному нарушению функции миокарда. Таким образом, широкая распространенность и многообразие различных менопаузальных проявлений у женщин переходного периода диктуют необходимость комплексной терапии этих нарушений.
Эффективность Милдроната в комплексной терапии ССЗ
Возможности клинического применения Милдроната сравнительно широко изучались в странах бывшего СССР. Особенно широко эти исследования проводились в ведущих клиниках России и Украины, а также Латвии. Были проведены исследования эффективности Милдроната в качестве антиишемического средства при стенокардии, сердечной недостаточности, нарушениях кровообращения мозга или глаз. Было показано, что препарат может применяться при хроническом алкоголизме. Широко изучен опыт применения Милдроната у спортсменов и военных. Показаниями к применению Милдроната в клинике сердечно-сосудистых заболеваний являются:
Милдронат в коррекции системных метаболических нарушений у женщин с менопаузальным МС
Новым направлением коррекции системных метаболических нарушений у женщин с климактерическими расстройствами и менопаузальным МС может стать использование отечественного препарата Милдронат. Милдронат является структурным аналогом гамма-бутиробетаина (ГББ), предшественника карнитина. При его приеме в организме увеличивается концентрация ГББ и уменьшается количество карнитина. Именно карнитин является тем транспортным средством, с помощью которого длинноцепочечные жирные кислоты поставляются в митохондрии. Преимущество Милдроната заключается в том, что препарат опосредованно тормозит бета-окисление свободных жирных кислот в митохондриях, препятствуя их транспорту. При этом при приеме Милдроната в митохондриях не возрастает концентрация недоокисленных, промежуточных продуктов метаболизма жирных кислот, которые при активации свободнорадикальных процессов служат источником образования токсических липопероксидов. Милдронат активирует оба наиболее важных фермента цикла аэробного окисления глюкозы:
- гексокиназу, вовлекающую в процесс окисления не только глюкозу, но и другие гексозы;
- пируватдегидрогеназу, которая вовлекает образовавшийся из cахаров пируват в цикл Кребса, тем самым предотвращая образование лактата (ацидоз).
Неблагоприятные атерогенные сдвиги в липидном спектре крови, возникающие в организме женщины в связи с утратой защитной роли женских половых гормонов, делают обоснованным использование Милдроната с целью коррекции данных нарушений. Некоторые исследователи показали, что на фоне приема Милдроната происходит снижение уровня холестерина липопротеидов низкой плотности (ХС ЛПНП), триглицеридов (ТГ) и холестерина липопротеидов очень низкой плотности (ХС ЛПОНП), повышается связывание ЛПНП с рецепторами аполипротеина В-100 (апоВ100) [3]. У женщин в пери- и постменопаузе нарушается баланс вазоактивных медиаторов, при этом повышается выработка эндотелием вазоконстрикторов и снижается секреция вазодилататоров, особенно оксида азота, что приводит к нарушению вазорегулирующей функции эндотелия сосудов, снижению резерва дилатации микроциркуляторного русла.
Эндотелиальная дисфункция (ЭД) и снижение выработки эндотелием оксида азота у женщин в перименопаузе усугубляет инсулинорезистентность (ИР), являющуюся следствием как дефицита эстрогенов, так и МС. Повышенное количество свободных жирных кислот при висцеральном ожирении приводит к дислипидемии, прогрессированию ИР и гипергликемии. Гипергликемия, в свою очередь, вызывает повышенное образование свободных радикалов, то есть оксидативный стресс. В развитии ЭД у женщин с МС огромную роль играют процессы свободнорадикального окисления. При этом свободные радикалы связываются с липидами и молекулами оксида азота (NO), что приводит к образованию субстрата атеросклеротической бляшки и потере защитных антиатеросклеротических свойств NO [4]. В этой связи Милдронат может служить препаратом выбора, поскольку, с одной стороны, он модулирует выработку оксида азота сосудистой стенкой, не вызывая эффекта обкрадывания, с другой стороны, уменьшает оксидативный стресс и окисление липидов, уменьшая тем самым проявления ЭД (рис. 1).
Наряду с активацией митохондриального аэробного окисления глюкозы Милдронат подавляет синтез карнитина и способствует накоплению гамма-бутиробетаина, концентрация которого возрастает в десятки раз. Оказалось, что этот процесс играет не менее важную роль в механизме действия Милдроната, чем собственно торможение бета-окисления, так как гамма-бутиробетаин структурно схож с ацетилхолином. Повышение концентрации гамма-бутиробетаина в плазме крови влечет за собой активацию ацетилхолиновых рецепторов в эндотелии кровеносных сосудов, что стимулирует синтез оксида азота и способствует увеличению эндотелий-зависимой вазодилатации. Эти же механизмы участвуют в подавлении агрегационной активности тромбоцитов [5]. Известно, что NO препятствует агрегации тромбоцитов. Такое воздействие на свертывающую систему, естественно, наблюдается и при применении Милдроната. И, наконец, именно повышенной концентрацией NO объясняется наблюдаемое в клинике увеличение эластичности эритроцитов при курсовом введении Милдроната больным ишемической болезнью сердца. В совокупности эти эффекты и обусловливают положительное влияние Милдроната на микроциркуляцию и при лечении больных с нарушениями кровообращения в мозге. Однако NO ответственен и за некоторые побочные эффекты Милдроната. Так, не рекомендуется назначать Милдронат на ночь, так как при этом повышается сексуальная активность больного. В связи с притоком кислорода в мозг у некоторых больных при этом нарушается сон.
Подчеркнем, что ингибирование ГББ-гидроксилазы Милдронатом является обратимым: препарат не блокирует этот фермент, а попросту занимает каталитический центр ГББ-гидроксилазы, препятствуя тем самым превращению ГББ в карнитин. Если применять Милдронат на фоне физической нагрузки один раз в сутки, наблюдается эффект последействия: при снижении концентрации Милдроната (например, у спортсменов после тренировки) накопившийся ГББ тут же превращается в карнитин, и в митохондрии поставляются жирные кислоты, которые способствуют производству энергии во время восстановительного периода у спортсменов, а запасы гликогена в это время интенсивно восстанавливаются (реакция гиперкомпенсации).
При отсутствии нагрузки также имеет место фармакологический тренинг миокарда – адаптация клеток к снижению потока жирных кислот и активация альтернативного пути производства АТФ – окисления глюкозы. Именно поэтому действие Милдроната оказывает на организм человека эффект прекондиционирования (precondition), который, как известно, предупреждает инциденты инфаркта в условиях ишемизации миокарда. Таким образом, при пиковых нагрузках и ишемии на фоне применения Милдроната имеет место включение кислородосберегающего окисления глюкозы, а в период восстановления при нормальном уровне кислорода – усиление процесса окисления жирных кислот.
Учитывая механизмы формирования артериальной гипертензии (АГ) у женщин в перименопаузе, препараты, ингибирующие ренин-ангиотензин-альдостероновую систему (РААС), являются основными средствами в силу их доказанной метаболической нейтральности и мощной органопротекции. В некоторых исследованиях было показано, что применение Милдроната у больных АГ в сочетании с ингибитором ангиотензинпревращающего фермента (иАПФ) способствовало усилению гипотензивного эффекта последнего, снижению показателей нагрузки давлением, нормализации суточного профиля артериального давления (АД) в большей степени, чем монотерапия иАПФ.
За последние несколько лет в отечественной литературе появилось много публикаций, посвященных вопросу менопаузальных расстройств. В большинстве своем они представлены анализом крупных зарубежных исследований, которые были выполнены с участием женщин разной этнической принадлежности, с различным социальным статусом, что делает невозможным экстраполирование данных, полученных при обследовании лиц, проживающих в другой стране, на российских женщин (по причине различий в условиях существования, образовательном и социальном статусе). В этой связи несомненный интерес представляет исследование У.В. Зимовиной, проведенное на российской популяции женщин [6].
В работе У.В. Зимовиной (2007) проведено изучение особенностей вегетативного регулирования у женщин в период ранней постменопаузы с физиологическим и патологическим ее течением, а также изучено влияние различных видов терапии климактерического синдрома на состояние вегетативной нервной системы. Изучение структуры и выраженности вегетативных нарушений проводили с помощью анкетирования; оценка вегетативного тонуса, реактивности и обеспечения физической деятельности проводилась в состоянии покоя и при выполнении экспериментально-клинических проб на основании спектрального и временного анализа вариабельности сердечного ритма методом кардиоинтервалографии.
Несмотря на возрастающий интерес к изучению вариабельности ритма сердца (ВРС), как показателя, характеризующего состояние вегетативной нервной системы, публикации, посвященные ВРС у женщин в климактерическом периоде, немногочисленны. В исследовании было показано, что период ранней постменопаузы характеризуется напряжением механизмов адаптации и формированием энергодефицитного состояния, проявляющегося снижением рефлекторной вегетативной регуляции и усилением гуморально-метаболического влияния на сердечный ритм. У женщин с физиологическим течением климактерия сохраняется нормальный уровень вегетативного обеспечения деятельности.
Развитие климактерического синдрома (КС) характеризуется психовегетативной дезадаптацией, маркерами которой являются относительная гиперсимпатикотония в покое, значительное снижение вегетативной реактивности и эрготропная ареактивность при обеспечении физической деятельности, а также психоэмоциональные нарушения в виде высокой личностной и ситуативной тревожности, эмоциональной нестабильности, выраженных депрессивных расстройств и ухудшения показателей самочувствия, активности, настроения. Заместительная гормональная терапия эффективно устраняет симптомы патологического климакса, однако не компенсирует полностью явления энергодефицита.
Автор исследования делает вывод о том, что у женщин, не получающих ЗГТ, включение в терапию КС нейротропных и метаболических препаратов (Милдронат) способствует значительному уменьшению психовегетативных расстройств, компенсирует явление энергодефицита и повышает адаптационный потенциал (табл. 1). Ранее уже были получены положительные результаты применения Милдроната при климактерической миокардиодистрофии –невоспалительном поражении миокарда, связанном с дефицитом эстрогенов и характеризующемся нарушением обменных процессов, приводящих к скрытому или явному нарушению функции миокарда. Таким образом, широкая распространенность и многообразие различных менопаузальных проявлений у женщин переходного периода диктуют необходимость комплексной терапии этих нарушений.
Эффективность Милдроната в комплексной терапии ССЗ
Возможности клинического применения Милдроната сравнительно широко изучались в странах бывшего СССР. Особенно широко эти исследования проводились в ведущих клиниках России и Украины, а также Латвии. Были проведены исследования эффективности Милдроната в качестве антиишемического средства при стенокардии, сердечной недостаточности, нарушениях кровообращения мозга или глаз. Было показано, что препарат может применяться при хроническом алкоголизме. Широко изучен опыт применения Милдроната у спортсменов и военных. Показаниями к применению Милдроната в клинике сердечно-сосудистых заболеваний являются:
- хроническая ишемическая болезнь сердца;
- стабильная стенокардия;
- хроническая сердечная недостаточность;
- дисгормональная кардиомиопатия;
- дистрофии миокарда;
- острые и хронические ишемические нарушения мозгового кровообращения.
В отличие от дигоксина, при применении которого у 29% больных на пике велоэргометрической нагрузки наблюдали приступ стенокардии и ишемические изменения ST-сегмента, у больных, получавших Милдронат, этих отрицательных эффектов не наблюдали. Кроме того, не менее чем у 70% больных количество экстрасистол сократилось на 50% и более. Таким образом, клинический эффект Милдроната у больных ишемической болезнью сердца по выраженности сопоставим, а по ряду показателей превосходит действие дигоксина и не сопровождается ухудшением коронарного кровообращения. Были проведены специальные дополнительные исследования использования Милдроната в комплексной терапии манифестной сердечной недостаточности (II–IV ФК по классификации NYHA), развившейся вследствие ишемической болезни сердца.
Все больные (80 пациентов) получали рекомендованную Европейским кардиологическим обществом терапию, включающую эналаприл (5–20 мг/сут), фуросемид (120–880 мг в неделю), изосорбида динитрат (60–120 мг/сут) и дигоксин (0,25–0,5 мг/сут). После стабилизации клинического состояния половине больных к стандартной терапии был добавлен Милдронат в суточной дозе 500 мг внутрь, и лечение в обеих группах продолжили еще в течение 4 недель. При этом было установлено, что применение Милдроната позволило на 10% улучшить результаты классической терапии по критерию перехода больных на более низкий функциональный класс по NYHA (57,5% в группе Милдроната против 47,5% в группе базисной терапии), а также способствовало более значительному снижению конечного систолического объема (КСО).
Кроме того, добавление Милдроната к рекомендованной терапии сердечной недостаточности способствовало повышению фракции выброса, укорочению передне-заднего размера левого желудочка и заметно повлияло на взаимодействие между функциональным состоянием стенки левого желудочка и величиной постнагрузки. Милдронат снижал также внутримиокардиальное напряжение. Использование Милдроната привело к достоверному увеличению толерантности к физической нагрузке, уменьшению одышки и интенсивности болевых ощущений и существенному улучшению качества жизни пациентов в сравнении с традиционной терапией сердечной недостаточности, рекомендованной Европейским кардиологическим обществом (ESC). Таким образом, клинические исследования доказали, что при лечении сердечной недостаточности Милдронат в суточной дозе 1,0 г:
Применение Милдроната вызывает в кардиомиоцитах увеличение как количества митохондрий, так и содержания крист в последних. Это является естественной реакцией адаптации, при помощи которой здоровый организм реагирует на кратковременное снижение поступления жирных кислот в митохондрии в условиях отсутствия дефицита кислорода. Таким образом, при продолжительном применении Милдроната (до 6 недель) у спортсменов и здоровых людей наблюдается выраженное повышение физической выносливости, особенно если применение Милдроната сопровождается большими нагрузками, так как накопившийся ГББ по мере снижения концентрации Милдроната усиленно превращается в карнитин и стимулирует бета-окисление, а глюкоза в это время накапливается в виде гликогена (реакция суперкомпенсации). Это дает возможность применять препарат в качестве фармакологического средства, повышающего возможности адаптации в условиях повышенных нагрузок.
Все больные (80 пациентов) получали рекомендованную Европейским кардиологическим обществом терапию, включающую эналаприл (5–20 мг/сут), фуросемид (120–880 мг в неделю), изосорбида динитрат (60–120 мг/сут) и дигоксин (0,25–0,5 мг/сут). После стабилизации клинического состояния половине больных к стандартной терапии был добавлен Милдронат в суточной дозе 500 мг внутрь, и лечение в обеих группах продолжили еще в течение 4 недель. При этом было установлено, что применение Милдроната позволило на 10% улучшить результаты классической терапии по критерию перехода больных на более низкий функциональный класс по NYHA (57,5% в группе Милдроната против 47,5% в группе базисной терапии), а также способствовало более значительному снижению конечного систолического объема (КСО).
Кроме того, добавление Милдроната к рекомендованной терапии сердечной недостаточности способствовало повышению фракции выброса, укорочению передне-заднего размера левого желудочка и заметно повлияло на взаимодействие между функциональным состоянием стенки левого желудочка и величиной постнагрузки. Милдронат снижал также внутримиокардиальное напряжение. Использование Милдроната привело к достоверному увеличению толерантности к физической нагрузке, уменьшению одышки и интенсивности болевых ощущений и существенному улучшению качества жизни пациентов в сравнении с традиционной терапией сердечной недостаточности, рекомендованной Европейским кардиологическим обществом (ESC). Таким образом, клинические исследования доказали, что при лечении сердечной недостаточности Милдронат в суточной дозе 1,0 г:
- увеличивает сократимость миокарда, фракцию выброса и систолический объем;
- увеличивает толерантность к физической нагрузке и улучшает качество жизни больного;
- уменьшает сократительную активность периферических артериол;
- не вызывает существенных побочных эффектов;
- рекомендуется в качестве средства выбора при лечении сердечной недостаточности легкой формы;
- с успехом может быть включен в схемы комбинированной терапии.
- защищает мембрану кардиомиоцитов;
- сохраняет энергетический потенциал ишемизированного миокарда;
- улучшает дыхательную функцию митохондрий;
- улучшает систолическую и диастолическую функцию ишемизированного миокарда;
- вызывает расслабление коронарных артерий;
- задерживает развитие нарушений ритма сердца;
- уменьшает некротические повреждения миокарда, вызванные адренергическими эффектами;
- обеспечивает антиангинальный эффект;
- обеспечивает антиишемический эффект;
- улучшает толерантность к физической нагрузке;
- обеспечивает антиаритмический эффект;
- обеспечивает гиполипидемический эффект.
- улучшает качество жизни;
- способствует восстановлению физических и интеллектуальных функций;
- у больных с сопутствующим диагнозом «коронарная болезнь сердца» уменьшает симптоматику сердечной недостаточности;
- способствует симптоматической регрессии неврологического дефицита.
Применение Милдроната у здоровых людей
Применение Милдроната вызывает в кардиомиоцитах увеличение как количества митохондрий, так и содержания крист в последних. Это является естественной реакцией адаптации, при помощи которой здоровый организм реагирует на кратковременное снижение поступления жирных кислот в митохондрии в условиях отсутствия дефицита кислорода. Таким образом, при продолжительном применении Милдроната (до 6 недель) у спортсменов и здоровых людей наблюдается выраженное повышение физической выносливости, особенно если применение Милдроната сопровождается большими нагрузками, так как накопившийся ГББ по мере снижения концентрации Милдроната усиленно превращается в карнитин и стимулирует бета-окисление, а глюкоза в это время накапливается в виде гликогена (реакция суперкомпенсации). Это дает возможность применять препарат в качестве фармакологического средства, повышающего возможности адаптации в условиях повышенных нагрузок.
1. Михин В.П., Хлебодаров Ф.Е. Перспективы применения Милдроната у больных с сердечно-сосудистой патологией // Российский кардиологический журнал. 2010. № 4. С. 83–92.
2. Сергиенко И.В., Кухарчук В.В., Габрусенко С.А., Малахов В.В., Масенко В.П., Трипотень М.И., Балахонова Т.В. Оценка влияния комбинированной терапии Милдронатом на липидный спектр, факторы воспаления и функцию эндотелия у больных ишемической болезнью сердца // Рациональная фармакотерапия в кардиологии. 2007. № 3. С. 10–14.
3. Сергиенко И.В., Малахов В.В., Наумов В.Г. Антиангинальная и антиишемическая эффективность Милдроната в комплексном лечении у больных ИБС стабильной стенокардией напряжения // Атмосфера. Кардиология. 2005. № 2. С. 43–45.
4. Mildronate (quaterin) antianginal, antiishemic agent // Drugs Fut. 1996. Vol. 21. № 1. P. 87.
5. Хлебодаров Ф.Е., Тюриков П.Ю., Михин В.П. Дисфункция сосудистого эндотелия и ее коррекция цитопротекторами у больных стабильной стенокардией напряжения и артериальной гипертонией // Российский кардиологический журнал. 2009. № 6. С. 34–38.
6. Зимовина У.В. Синдром психовегетативной дисрегуляции у женщин в периоде ранней постменопаузы и возможности негормональной и гормональной его коррекции: Автореф. … дисс. канд. мед. наук. Пермь: ГОУ ВПО ПермГМА Росздрава, 2007. 26 с.
7. Skarda I., Klincare D., Dzerve V. et al. Modulation of myocardial energy metabolism with mildronate – an effective approach in the treatment of chronic heart failure // Proceedings of the Latvian Academy of Sciences. 2001. Vol. 55. № 2–3. P. 73–79.
Новости на тему
13.02.2025
14.05.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
В статье описываются возможности отечественного метаболического препарата Милдронат в коррекции системных метаболических нарушений у женщин с климактерическими расстройствами и менопаузальным метаболическим синдромом.
Показано, что включение Милдроната в схемы лечения климактерического синдрома у женщин, не получающих заместительную гормональную терапию, способствует существенному уменьшению психовегетативных расстройств, компенсирует энергодефицит и повышает адаптационный потенциал.
Показано, что включение Милдроната в схемы лечения климактерического синдрома у женщин, не получающих заместительную гормональную терапию, способствует существенному уменьшению психовегетативных расстройств, компенсирует энергодефицит и повышает адаптационный потенциал.
Доказано кардиопротективное, антиангинальное, антигипоксическое, ангиопротективное действие Милдроната у лиц с сердечно-сосудистыми заболеваниями.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
