Высокочувствительный тропонин в диагностике острого коронарного синдрома без подъема сегмента ST
- Аннотация
- Статья
- Ссылки
- English
Классическая диагностическая триада ОКС включает характерную клиническую картину, изменения на электрокардиограмме и повышение уровня кардиоспецифических биомаркеров. Внедрение в клиническую практику высокочувствительных тестов на сердечные тропонины (hs-cTn) позволило существенно повысить точность, скорость и безопасность диагностики инфаркта миокарда без подъема сегмента ST. Актуальные рекомендации Европейского общества кардиологов 2020 г. (обновление в 2023 г.) предусматривают использование hs-cTn в составе ускоренных диагностических протоколов с последовательным определением уровня биомаркера в первые часы после госпитализации пациента, что обеспечивает надежную стратификацию риска.
В статье обобщены современные данные о применении высокочувствительного тропонина в ранней диагностике и стратификации риска при ОКС без подъема ST, а также проанализированы методы адаптации ускоренных алгоритмов к клинической практике.
Классическая диагностическая триада ОКС включает характерную клиническую картину, изменения на электрокардиограмме и повышение уровня кардиоспецифических биомаркеров. Внедрение в клиническую практику высокочувствительных тестов на сердечные тропонины (hs-cTn) позволило существенно повысить точность, скорость и безопасность диагностики инфаркта миокарда без подъема сегмента ST. Актуальные рекомендации Европейского общества кардиологов 2020 г. (обновление в 2023 г.) предусматривают использование hs-cTn в составе ускоренных диагностических протоколов с последовательным определением уровня биомаркера в первые часы после госпитализации пациента, что обеспечивает надежную стратификацию риска.
В статье обобщены современные данные о применении высокочувствительного тропонина в ранней диагностике и стратификации риска при ОКС без подъема ST, а также проанализированы методы адаптации ускоренных алгоритмов к клинической практике.


Введение
По данным Минздрава России и Росстата, ежегодно в нашей стране регистрируется свыше 520 000 случаев острого коронарного синдрома (ОКС), причем почти половина из них – без подъема сегмента ST [1]. Согласно данным Global Burden of Disease (2019), ишемическая болезнь сердца и ОКС остаются ведущими причинами смерти.
ОКС без подъема сегмента ST включает две нозологические формы – инфаркт миокарда без подъема сегмента ST и нестабильную стенокардию. Дифференциальная диагностика указанных состояний имеет принципиальное значение для определения тактики лечения и прогноза [2].
Всем пациентам с подозрением на ОКС необходимо выполнить 12-канальную электрокардиографию (ЭКГ) в течение десяти минут с момента госпитализации. В отсутствие подъема ST ключевым инструментом становится определение уровня сердечного тропонина [3].
Согласно Четвертому универсальному определению инфаркта миокарда [3], повышение или динамика уровня тропонина на фоне клинических признаков ишемии является обязательным диагностическим критерием. Тропонины высвобождаются из поврежденных кардиомиоцитов и обладают высочайшей кардиоспецифичностью, значительно превосходя по диагностической ценности традиционные маркеры, например креатинкиназу и ее изофермент КК-МВ [4].
Внедрение высокочувствительных тестов на сердечные тропонины (hs-cTn) сделало возможным выявление концентрации биомаркера на уровне ниже 99-го перцентиля верхней референсной границы (ВРГ) с коэффициентом вариации ≤ 10%, что существенно повысило точность диагностики даже на раннем сроке ишемии [5]. Высокочувствительные маркеры способны обнаруживать измеряемые концентрации тропонина более чем у 50% здоровых лиц, что позволяет оценивать минимальные изменения уровня биомаркера, необходимые для применения ускоренных алгоритмов.
Аналитические характеристики hs-cTn обеспечивают ряд важных клинических преимуществ [5]:
- существенное сокращение «слепого периода» после начала повреждения кардиомиоцитов;
- значительное повышение диагностической чувствительности при раннем обращении пациента за специализированной помощью;
- возможность точной количественной оценки динамики биомаркера за короткий промежуток времени.
Традиционные диагностические протоколы, основанные на использовании тропониновых тестов предыдущих поколений, требовали серийного определения биомаркера с интервалом 3–6 часов [6]. Такой подход значительно увеличивал длительность пребывания пациентов в отделениях неотложной помощи и создавал избыточную нагрузку на систему здравоохранения. С внедрением высокочувствительных тропониновых тестов стала возможной разработка ускоренных алгоритмов диагностики (0/1 ч, 0/2 ч, 0/3 ч), с помощью которых классифицировать пациентов по степени риска можно на раннем сроке ишемии.
В настоящее время ускоренные диагностические протоколы определения hs-cTn признаны международными руководствами стандартом диагностики ОКС без подъема сегмента ST [2]. Правильное использование этих алгоритмов требует понимания их аналитических особенностей, клинической ценности и ограничений, а также учета специфики организации медицинской помощи в конкретных условиях.
Современные ускоренные алгоритмы диагностики ОКС
Европейское общество кардиологов (ESC) в рекомендациях по ведению пациентов с ОКС без подъема сегмента ST предлагает несколько валидированных ускоренных алгоритмов [2].
Алгоритм ESC 0/1 ч
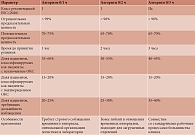
Алгоритм ESC 0/1 ч основан на серийном определении уровня hs-cTn во время госпитализации и через час после поступления в стационар, что позволяет разделить пациентов на три диагностические категории: rule-out, observe и rule-in [7].
Ключевые преимущества данной стратегии подтверждены в многоцентровом исследовании TRAPID-AMI [8], в котором безопасная классификация пациентов по уровню риска была достигнута в 77% случаев уже в первые два часа после госпитализации.
Позднее в проспективном когортном исследовании J. Boeddinghaus и соавт. продемонстрировали, что отрицательная прогностическая ценность алгоритма превышает 99%, что делает его надежным инструментом раннего исключения инфаркта миокарда [9].
Актуальные данные, полученные J. Lehmacher и соавт., подтвердили высокую воспроизводимость результатов при использовании тест-системы Access hs-cTnI (Beckman Coulter, США) [10]. Отрицательная прогностическая ценность алгоритма составила 99,3% (95%-ный доверительный интервал 99,0–99,5), положительная – 74,6%. Авторы подчеркнули, что высокая диагностическая точность сохраняется только при использовании валидированных аналитических платформ, поскольку пороговые значения hs-cTn строго тест-специфичны и не могут быть экстраполированы на другие системы.
В зависимости от результатов пациенты классифицируются на три группы:
- rule-out (исключение ОКС, возможна выписка): при продолжительности болевого синдрома свыше трех часов и крайне низком (или неопределяемом) уровне hs-cTn при госпитализации, а также в отсутствие значимого прироста показателя через час инфаркт миокарда может быть исключен с высокой степенью достоверности. Отрицательная прогностическая ценность метода превышает 99% [9]. После исключения других потенциально опасных состояний возможны ранняя выписка и амбулаторное дообследование, что позволяет оптимизировать использование ресурсов стационара;
- observe (наблюдение, требуются дополнительные исследования): пациенты, не соответствующие критериям исключения или подтверждения инфаркта миокарда, составляют промежуточную группу с повышенным риском неблагоприятных исходов [11]. Таким пациентам показаны повторное измерение уровня hs-cTn через три часа, выполнение эхокардиографии и оценка риска по шкале GRACE (Global Registry of Acute Coronary Events). Дальнейшая тактика определяется результатами дополнительного обследования: при высокой вероятности ОКС без подъема сегмента ST выполняют инвазивную ангиографию, при низкой применяют неинвазивные методы визуализации;
- rule-in (подтверждение ОКС, требуется госпитализация и лечение): на основании высокого исходного уровня hs-cTn или его значительного прироста за первый час с момента поступления в стационар пациентов относят к зоне подтверждения диагноза.
Положительная прогностическая ценность метода достигает 70–75% [9]. В ряде случаев при подтвержденном повышении уровня тропонина выявляются другие критические патологии, требующие неотложной госпитализации. Речь, в частности, идет о миокардите, синдроме такоцубо, тромбоэмболии легочной артерии, декомпенсации сердечной недостаточности.
Алгоритм ESC 0/2 ч
Алгоритм ESC 0/2 ч представляет собой оптимальную альтернативу, если соблюсти часовой интервал в рамках алгоритма 0/1 ч не представляется возможным. По структуре алгоритм 0/2 ч аналогичен алгоритму 0/1 ч, однако повторный забор крови проводится через два часа, а пороговые значения высокочувствительного тропонина адаптированы к увеличенному временному интервалу [2].
Подобная диагностическая стратегия рекомендована ESC как равноценная альтернатива алгоритму 0/1 ч (класс рекомендации – I) [2]. Особую ценность этот подход представляет в условиях высокой нагрузки на отделения неотложной помощи, когда соблюдение часового интервала между заборами крови затруднено из-за организационных или логистических факторов.
Крупномасштабное исследование с участием свыше 100 000 пациентов продемонстрировало высокие диагностические характеристики 0/2 ч-алгоритма: отрицательная предсказательная ценность составила 99,7%, положительная – 68% [12].
Исследование, в котором использовали тест-систему Hybiome hs-cTnI (Suzhou Hybiome Biomedical Engineering, Китай), подтвердило высокую эффективность 0/2 ч-модели в азиатской популяции: чувствительность составила 93,3%, общая диагностическая точность – 89%. [13]. Эти результаты демонстрируют воспроизводимость характеристик алгоритма в популяциях разного этнического состава.
Алгоритм успешно валидирован в крупных многоцентровых когортах [12, 14, 15], что обеспечивает высокую степень доказательности его применения. Как и в случае с алгоритмом 0/1 ч, особое внимание следует уделять использованию именно тех тест-систем и пороговых значений, которые были специфически валидированы для протокола 0/2 ч.
Алгоритм ESC 0/3 ч
Алгоритм ESC 0/3 ч – первый ускоренный диагностический протокол, предложенный ESC в 2011 г. [16]. Этот подход стал важным шагом в эволюции диагностики инфаркта миокарда, впервые позволив сократить время диагностического процесса с традиционных 6–9 до трех часов [16].
Согласно данной стратегии, инфаркт миокарда может быть исключен с высокой степенью достоверности (отрицательная прогностическая ценность > 98%) при нормальных значениях hs-cTn в пробах, взятых во время госпитализации и спустя три часа [16]. В актуальных рекомендациях ESC (2020) этот подход рассматривается как альтернативный алгоритм с классом рекомендаций IIa [2].
В алгоритме 0/3 ч применяется 99-й перцентиль ВРГ конкретной тест-системы [16]. Такой подход делает алгоритм универсальным для различных аналитических платформ, но требует точного знания 99-го перцентиля для используемой тест-системы.
Основные правила интерпретации в алгоритме 0/3 ч [15–17]:
- исключение острого инфаркта миокарда (rule-out) возможно при уровне hs-cTn во время госпитализации ниже 99-го перцентиля ВРГ и приросте через три часа, не превышающем 50% 99-го перцентиля (или специфической дельты);
- подтверждение острого инфаркта миокарда (rule-in):
- при исходном уровне hs-cTn выше 99-го перцентиля ВРГ и значимой динамике через три часа (прирост > 20% при исходно повышенном уровне);
- значительном повышении уровня через три часа (например, более чем в пять раз выше 99-го перцентиля), даже если исходный уровень был в норме.
Для многих тест-систем также установлены раздельные референсные значения для мужчин и женщин, что повышает точность диагностики при учете пола пациента.
Несмотря на появление более быстрых алгоритмов, протокол 0/3 ч сохраняет клиническую ценность, особенно в условиях, когда:
- невозможно обеспечить забор крови через строго фиксированные интервалы – один или два часа;
- используется тест-система, не прошедшая валидацию для алгоритмов 0/1 ч или 0/2 ч;
- имеет место поздняя обращаемость пациентов (свыше 12 часов от начала возникновения симптомов);
- имеется сопутствующая патология (например, хроническая болезнь почек (ХБП)), и более быстрые алгоритмы могут давать менее надежные результаты.
Конкретный алгоритм следует выбирать с учетом специфики лечебного учреждения, его технического оснащения, доступности валидированных тест-систем и организации логистических процессов [18]. Характеристика ускоренных алгоритмов диагностики ОКС без подъема сегмента ST представлена в табл. 1.
Валидированные тест-системы и пороговые значения для алгоритмов ESC
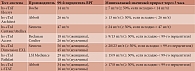
Ускоренные диагностические алгоритмы ESC предполагают использование высокочувствительных тест-систем определения сердечного тропонина, прошедших аналитическую и клиническую валидацию. Ключевым принципом является строгая платформоспецифичность пороговых значений, поскольку аналитические характеристики систем существенно различаются и исключают возможность переноса cut-off значений между тест-платформами [5, 13, 16].
Несмотря на высокую корреляцию между результатами различных тест-систем, их клинические пороги остаются несовместимыми. Так, показана высокая согласованность результатов Beckman Access hs-cTnI (Beckman Coulter, США) и Roche Elecsys hs-cTnT (Roche, Швейцария) (r > 0,9). Тем не менее даже при таком уровне соответствия пороговые значения rule-out и rule-in не совпадают и не подлежат унификации [10]. Это полностью соответствует позиции ESC, согласно которой каждая тест-система должна иметь собственные валидированные пороги в алгоритмах 0/1 ч и 0/2 ч.
В последние годы были опубликованы крупные исследования, которые расширили доказательную базу ускоренных алгоритмов. В частности, J. Wu и соавт. оценили диагностические характеристики тест-системы Hybiome hs-cTnI в китайской когорте пациентов с подозрением на ОКС. Чувствительность составила 93,3%, общая точность – 89%. Это указывает на необходимость адаптации пороговых значений с учетом этнических и демографических характеристик популяции [13].
Дополнительный вклад в оценку новых аналитических платформ внесло недавнее многоцентровое исследование MERITnI (2025) [14], подтвердившее клиническую пригодность тест-системы Mindray hs-cTnI (CL1200i/CL-2600i). Продемонстрирована возможность безопасного исключения инфаркта миокарда как по протоколу single-sample (hs-cTnI < 2 нг/л), так и по алгоритму 0/2 ч (дельта < 2 нг/л). Аналитически установленные значения 99-го перцентиля составили ≈10 нг/л в общей популяции, ≈5 нг/л среди женщин и ≈12 нг/л среди мужчин. При использовании порогов 0 ч < 15 нг/л и дельта < 5 нг/л доля безопасного исключения инфаркта миокарда достигла 42%. Полученные результаты позволяют рассматривать данную платформу как перспективную для применения в ускоренных диагностических алгоритмах, однако требуют дальнейшей внешней валидации в разных клинических когортах.
L. Cullen и соавт. выполнили внешнюю валидацию алгоритма ESC 0/2 ч с использованием платформы Siemens Atellica IM hs-cTnI (n = 1994). Алгоритм продемонстрировал чувствительность 99,1% и отрицательную прогностическую ценность 99,9%, что подтверждает его надежность при строгом соблюдении аналитической стандартизации [15].
Y. Lin и соавт. изучили применение алгоритма ESC 0/1 ч у 2345 пациентов также с помощью Siemens Atellica IM hs-cTnI. Применение ускоренного протокола позволило сократить время до клинического решения на 35% при сохранении высокой диагностической точности (наибольшая прогностическая ценность – 99,5%) [19].
Таким образом, современные данные подтверждают, что развитие лабораторной диагностики ОКС требует не только стандартизации алгоритмов, но и постоянной валидации новых тест-систем с учетом популяционных особенностей и условий оказания медицинской помощи.
Основные валидационные пороговые значения для различных тест-систем, используемых в ускоренных алгоритмах ESC, представлены в табл. 2–4.
Внедрение ускоренных алгоритмов в клиническую практику: особенности и проблемы
Эффективность внедрения ускоренных диагностических алгоритмов ESC во многом определяется сочетанием организационных, технических и клинических факторов, обеспечивающих своевременное получение и корректную интерпретацию результатов в отношении hs-cTn. Согласно данным международных исследований, ключевыми ограничениями являются доступность оперативных лабораторных исследований и соблюдение регламента выполнения анализа [18]. В частности, J.E. Andruchow и соавт. отмечают, что отсутствие стандартизированных протоколов управления временем получения результата (Turnaround Time, TAT) – одна из основных причин несостоятельности алгоритма 0/1 ч в рутинной практике [18].
Дополнительные сложности связаны с неоднородностью клинических порогов hs-cTn в разных популяциях. Надежность универсальных пороговых значений подвергается пересмотру с учетом демографических переменных. В частности, у женщин в отличие от мужчин исходные уровни тропонина ниже. Как следствие – уменьшается чувствительность стандартных критериев на 5–10%, возникает потребность в использовании раздельных пороговых значений [10].
Современные исследования указывают на необходимость адаптации диагностических пороговых значений высокочувствительного тропонина для отдельных категорий пациентов [12, 20].
У онкологических больных повышенные уровни hs-cTn наблюдаются значительно чаще, чем в общей популяции. Это связано не только с ишемическими событиями, но и с широким спектром неишемических механизмов.
Согласно данным крупного исследования TROP-MALIGNANCY, хроническое повышение тропонина фиксируется у 40–50% больных и обычно обусловлено кардиотоксичностью противоопухолевой терапии (антрациклины, HER2-ингибиторы, иммунотерапия), воздействием радиотерапии средостения, анемией, воспалительными и метаболическими нарушениями, нарушениями микроциркуляции и кахексией [20]. Указанные факторы формируют устойчивый фоновый уровень hs-cTn, который может сохраняться долгое время и не отражает острое ишемическое повреждение миокарда. В результате при использовании ускоренных алгоритмов ESC повышается доля ложных классификаций по зоне rule-in, возрастает число пациентов, попадающих в observe zone, и снижается специфичность алгоритмов по сравнению с общей популяцией.
Для пациентов с ХБП также характерно хроническое повышение уровня hs-cTn, не связанное с острым ишемическим повреждением. Крупное исследование D.G. Mark и соавт. с участием более 104 000 пациентов показало, что диагностическая точность алгоритма 0/2 ч существенно ухудшается на фоне снижения скорости клубочковой фильтрации [12]. У пациентов с ХБП IV стадии отрицательная прогностическая ценность снижается до 96%. Специфичность и положительная прогностическая ценность также заметно уменьшаются.
Представленные данные подчеркивают необходимость внедрения индивидуализированных диагностических порогов и корректировки алгоритмов ESC с учетом особенностей клинических когорт.
Несмотря на очевидную эффективность ускоренных алгоритмов, их реализация в клинических условиях сопряжена с рядом проблем:
- разнообразие тест-систем и валидация. В клинических лабораториях используются разные анализаторы hs-cTn, однако не все из них прошли клиническую валидацию для применения алгоритмов ESC 0/1 ч и 0/2 ч [5, 7, 13]. Отсутствие валидации не позволяет гарантировать сопоставимость аналитической чувствительности и специфичности между тест-системами, что делает интерпретацию результатов по алгоритмам ESC методологически некорректной и клинически небезопасной;
- время получения результата (TAT). По данным международных исследований, для эффективной реализации алгоритма 0/1 ч необходимо обеспечить TAT менее 60 минут [18]. Рациональные решения – point-of-care тестирование и оптимизация логистики проб;
- оснащенность и региональная вариабельность тест-систем. В малых и средних медицинских учреждениях часто отсутствует доступ к валидированным высокочувствительным тест-системам. Применение разных аналитических платформ в пределах одной больницы может приводить к несогласованности результатов;
- кадровые и образовательные ограничения. Исследования показывают недостаточную осведомленность медицинского персонала о принципах интерпретации результатов высокочувствительных тропониновых тестов. Необходимо дополнительное обучение, а также адаптация организационных процессов к требованиям ускоренной диагностики.
Обозначенные проблемы свидетельствуют о важности системных подходов к интеграции ускоренных алгоритмов в реальную клиническую практику, эффективность которых подтверждена в ряде крупных исследований.
Опыт внедрения ускоренных алгоритмов в клиническую практику
Эффективность ускоренных диагностических алгоритмов ESC подтверждена данными крупных проспективных исследований и внешних валидаций в разных клинических условиях.
В исследовании RAPID-TnT внедрение алгоритма 0/1 ч способствовало сокращению длительности пребывания пациентов в отделении неотложной помощи на 43% без увеличения частоты неблагоприятных исходов [21].
В одном из крупнейших исследований High-STEACS с участием более 48 000 пациентов наблюдалось увеличение выявляемости инфаркта миокарда на 22% после перехода на hs-cTn-ориентированные протоколы, особенно у женщин и пациентов старших возрастных групп [6].
Результаты внешних валидаций, в частности данные, полученные L. Cullen и соавт. [15], показали, что внедрение ускоренных алгоритмов не только повышает точность диагностики, но и способствует оптимизации маршрутизации пациентов и сокращению срока госпитализации на 17%.
Совокупность этих данных демонстрирует, что ускоренные алгоритмы ESC клинически эффективны и безопасны при условии строгого соблюдения организационных, аналитических и образовательных стандартов, включая применение валидированных тест-систем и адаптированных пороговых значений.
Рекомендации по внедрению ускоренных алгоритмов в клиническую практику
Применение ускоренных диагностических алгоритмов на основе определения уровня hs-cTn требует комплексного подхода, включающего организационные, лабораторные и образовательные меры. На основании обобщенных данных клинических исследований и международных рекомендаций можно выделить ключевые этапы эффективной реализации указанных протоколов в российской практике.
1. Оценка готовности учреждения:
- соответствие имеющегося лабораторного оборудования валидированным тест-системам hs-cTn;
- анализ логистических процессов для обеспечения времени получения результата (TAT) менее 60 минут;
- оценка кадрового потенциала и потребности в дополнительном обучении персонала.
2. Выбор оптимального алгоритма:
- алгоритм 0/1 ч предпочтителен при наличии валидированной тест-системы и отлаженной лабораторной логистики с TAT < 60 минут;
- алгоритм 0/2 ч целесообразен при высокой загруженности отделений неотложной помощи или ограниченных ресурсах;
- алгоритм 0/3 ч используется как резервный вариант в отсутствие возможности внедрения ускоренных стратегий.
3. Оптимизация логистики:
- использование систем пневмопочты или курьерской доставки для сокращения времени транспортировки проб;
- приоритетная маркировка проб пациентов с подозрением на ОКС;
- автоматизация регистрации и ускорение аналитического цикла обработки образцов.
4. Образовательные мероприятия:
- проведение циклов обучения для врачей и среднего медперсонала по интерпретации результатов hs-cTn;
- разработка и распространение локальных клинических протоколов с четко прописанным алгоритмом действий;
- регулярная проверка исполнения протоколов и анализ клинических исходов с обратной связью для персонала.
Необходимо отметить, что четкое следование рекомендованным протоколам, включая использование валидированных аналитических систем и пороговых значений, позволяет избежать увеличения числа пропущенных диагнозов инфаркта миокарда и связанных с этим неблагоприятных исходов [7, 15, 19].
Заключение
Ускоренные алгоритмы диагностики ОКС на основе определения уровня высокочувствительного тропонина представляют собой современный и клинически обоснованный инструмент оптимизации ведения пациентов с подозрением на инфаркт миокарда [2].
Применение таких алгоритмов позволяет:
- сократить период диагностики и своевременно начать соответствующее лечение;
- уменьшить длительность пребывания пациентов в отделении неотложной помощи;
- снизить нагрузку на стационары за счет безопасного раннего исключения ОКС;
- оптимизировать использование ресурсов здравоохранения.
Результаты крупных международных исследований (RAPID-TnT, High-STEACS, TRAPID-AMI), а также данные современных внешних валидаций подтверждают эффективность ускоренных алгоритмов при условии соблюдения принципов аналитической валидации и стандартизации лабораторных процессов [4, 12, 19].
Широкое внедрение данных подходов в клиническую практику позволит повысить качество и безопасность оказания неотложной кардиологической помощи, а также обеспечить соответствие международным стандартам ведения пациентов с ОКС.
B.D. Lidzhieva, N.A. Potemkina, PhD, T.A. Starovoitova, PhD, Prof., A.D. Erlikh, PhD, Prof., D.Yu. Shchekochikhin, PhD
I.M. Sechenov First Moscow State Medical University
City Clinical Hospital No. 1 named after N.I. Pirogov, Moscow
Moscow Regional Research and Clinical Institute
Russian Medical Academy of Continuous Professional Education, Moscow
N.I. Pirogov Russian National Research Medical University, Moscow
Contact person: Bulgun D. Lidzhieva, lidzhieva.b21@gmail.com
Cardiovascular diseases remain the leading cause of death and disability in the world. Acute coronary syndrome (ACS) is an urgent condition requiring timely diagnosis and treatment. Optimizing the diagnostic process in patients with suspected ACS is key to reducing mortality, preventing complications, and making rational use of healthcare resources. The classic diagnostic triad of ACS includes a characteristic clinical picture, changes in the electrocardiogram and an increase in the level of cardiospecific biomarkers. The introduction of highly sensitive cardiac troponin tests (hs-cTn) into clinical practice has significantly improved the accuracy, speed and safety of diagnosis of non-ST segment elevation myocardial infarction. Current recommendations of the European Society of Cardiology 2020 (updated in 2023) provides for the use of hs-cTn as part of accelerated diagnostic protocols with consistent determination of the biomarker level in the first hours after the patient's hospitalization, which ensures reliable risk stratification. The article summarizes current data on the use of highly sensitive troponin in the early diagnosis and risk stratification of non-ST segment elevation myocardial infarction, as well as analyzes methods for adapting accelerated algorithms to clinical practice.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.