Метаболомный компендиум по магния оротату
- Аннотация
- Статья
- Ссылки
- English
Введение
Компендиум (от лат. compendium) – сжатое изложение понятий, теорий и методик определенной области науки. Компендиум позволяет формировать целостное, но неупрощенное понимание рассматриваемой проблемы. Например, упрощенное понимание фармакологического действия магниевых препаратов порождает стереотипное отношение к ним: магний – вспомогательный препарат, магний снимает судороги, магний бесполезен. В то же время при электролитном дисбалансе, когда не нормализованы в первую очередь уровни магния, калия, кальция в крови, применение даже самых современных лекарственных средств может быть либо малоэффективным, либо совсем неэффективным. Деформированный минеральный обмен не только играет существенную роль в патогенезе заболеваний, но и изменяет фармакокинетический и фармакодинамический ответ на воздействие лекарственных средств [1].
В современной биомедицине целостное понимание механизмов действия любого фармакологического препарата основано на его влиянии на метаболом организма [2]. Под метаболомом понимают совокупность всех низкомолекулярных веществ (молекулярная масса менее 1000 дальтон) и ионов (Mg2+, Ca2+, K+, Zn2+ и др.), обнаруженных в клетках и тканях макроорганизма [3]. Именно анализ действия препарата в контексте метаболома человека позволяет сформировать объективное понимание как терапевтических, так и побочных эффектов.
Недостаточность магния – патологическое состояние метаболома человека, ассоциированное с достоверным повышением риска ряда хронических патологий [4]. Чтобы компенсировать дефицит магния, следует использовать препараты на основе органических солей магния, которые по сравнению с неорганическими солями характеризуются более высокой биоусвояемостью [1].
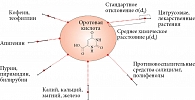
Высокой биоусвояемостью обладают препараты на основе солей магния с органическими кислотами, в которых анион кислоты служит переносчиком магния внутрь клеток. Вместе с тем анион-переносчик характеризуется самостоятельными целевыми эффектами, направленными на поддержание систем организма. Таким анионом является оротат-анион (анион оротовой кислоты) с уникальным фармакологическим действием.
Оротовая кислота, или витамин В13, – предшественник в биосинтезе пиримидиновых оснований, стимулирующий рост животных, растений и микроорганизмов.
Соли оротовой кислоты повышают биодоступность ионов различных металлов, содержащихся в минеральных пищевых добавках и препаратах на основе минералов. Оротовая кислота содержится в молоке (коровьем, козьем), молочных продуктах, а также в моркови и свекле [5, 6]. В коровьем молоке ее уровень достигает в среднем 80 мкг/мл [7], в сухой молочной сыворотке – от 64 до 146 мг на 100 г [8]. Что касается других продуктов, содержание в них оротовой кислоты не изучено.
Потребность взрослого человека в оротовой кислоте около 500–1500 мг/сут. У кормящих матерей этот показатель достигает 3000 мг/сут, у интенсивно тренирующихся спортсменов – 3000–5000 мг/сут.
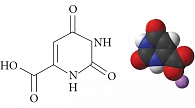
Оротовая кислота представляет собой гетероциклическое соединение – 2,6-диоксипиримидин-4-карбоновая кислота (рис. 1), синтезируется во всех клетках организма и является промежуточным продуктом синтеза пиримидиновых нуклеотидов (оротидинфосфата, уридинтрифосфата, цитидинтрифосфата) [9]. Ферменты биотрансформаций оротата обнаружены во всех известных тканях.
Важный момент: оротовая кислота и ее производные являются нутриентами для микробиоты [10]. Например, геномы молочнокислых бактерий Lactobacillus содержат гены, кодирующие специальные белки для транспорта и биотрансформаций оротовой кислоты [11].
Оротовая кислота участвует во многих основных метаболических процессах, в частности:
-
переработке глюкозы;
-
поддержании резервов аденозинтрифосфата (АТФ);
-
синтезе рибозы;
-
создании резервов карнозина в скелетных мышцах и миокарде;
-
росте и развитии клеток и тканей, например мышечной (за счет синтеза РНК);
-
активации сократительных возможностей мышечных тканей [12].
Эти и другие биохимические аспекты действия оротовой кислоты и оротат-аниона в составе магния оротата обусловливают эффекты оротовой кислоты и ее магниевой соли.
Оротовая кислота оказывает стимулирующее действие на белковый обмен, благотворно влияет на функциональное состояние печени, способствует снижению уровня холестерина в крови, улучшает сократительную способность миокарда [5, 6, 12].
Следует отметить, что к настоящему моменту выполнено свыше 6500 биомедицинских исследований оротовой кислоты и оротат-аниона. Каждый год публикуется от 120 до 150 работ по результатам проведенных исследований. Казалось бы, свойства оротовой кислоты, в частности биохимические и физиологические, хорошо известны. Тем не менее точные молекулярные механизмы кардиопротективных эффектов оротат-аниона остаются не до конца изученными.
Рассмотрим данные систематического анализа имеющихся биохимических, экпериментальных и клинических результатов исследований оротовой кислоты и магния оротата, свидетельствующие об их противовоспалительных, нейро- и кардиопротективных свойствах.
Экспериментальные и клинические исследования оротат-аниона и оротовой кислоты
Оротовая (от греч. oros – молочная сыворотка) кислота была впервые выделена в 1905 г. из сыворотки коровьего молока [13]. К 1930-м гг. была описана структура оротовой кислоты как 4-урацил-карбоновой кислоты, производного урацила [14].
В 1947–48 гг. H.K. Mitchell и соавт. установили, что оротовая кислота является промежуточным продуктом биосинтеза пиримидиновых нуклеотидов и компонентом всех живых клеток [15].
В 1948 г. был открыт фактор роста крыс и цыплят, названный витамином B13. Животные, находившиеся на диете с дефицитом данного фактора, производили неполноценное потомство, плохо росли, характеризовались высокой смертностью в период лактации [16].
В 1953 г. L. Manna и S.M. Hauge доказали, что витамин B13 и оротовая кислота – идентичные вещества [17]. Оротовая кислота вызывает заметное ускорение роста молодых крыс, ее длительный прием повышает плодовитость животных [18].
Впоследствии были установлены и другие эффекты оротовой кислоты. Речь идет о гепатопротективном свойстве [19] и замедлении развития экспериментального цирроза печени [20]. Оротовую кислоту и ее магниевую соль можно использовать в качестве действенного защитного вещества против ионизирующей радиации [21]. Заметим, что достаточная обеспеченность магнием также защищает от радиации и интоксикации свинцом [22].
Результаты более поздних метаболомных исследований показали, что воздействие оротовой кислоты приводит к пертурбациям различных метаболических путей – метаболизма жирных кислот, триглицеридов, фосфолипидов, бета-окисления, синтеза нуклеотидов и метаболизма углеводов [23]. Оротовая кислота повышает уровень диацилглицеридов и снижает активность супероксиддисмутазы в печени крыс [24] за счет увеличения активности фосфатидат-фосфогидролазы [25]. В то же время пероральный прием оротовой кислоты тормозит секрецию печенью липопротеинов низкой и очень низкой плотности, что способствует снижению уровня триглицеридов в крови [26, 27].
Измерение уровня оротовой кислоты в моче является ценным лабораторным тестом для изучения нарушений обмена веществ, связанных с биосинтезом аргинина – аминокислоты, имеющей особое значение для функционирования миокарда. Аргинин метаболизируется в оксид азота (II) – важнейший вазодилататор и фактор ангиогенеза.
В настоящее время в клинической практике оптимальным препаратом для восполнения дефицита магния признан Магнерот (магния оротат). Препарат оротовой кислоты используется как в свободном виде, так и в виде солей (магния или калия). Пероральный прием оротовой кислоты обычно рекомендуется после хирургических операций на сердце (три недели – два месяца). Оротовая кислота может использоваться при вскармливании недоношенных детей [28], заболеваниях печени и клиническом постгепатитном синдроме [29], мегалобластических анемиях [12], остром и хроническом гепатите, циррозе печени [30].
Биологические эффекты оротовой кислоты
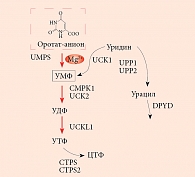
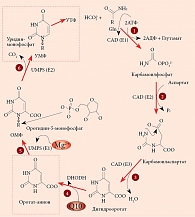
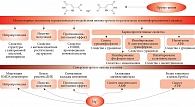
В организме человека оротовая кислота синтезируется в печени из аспартата и карбамоилфосфата. Метаболические эффекты оротата ограничены синтезом пиримидинов, точнее уридинмонофосфата (УМФ). Синтез УМФ осуществляется посредством трех ферментов, каждый из которых катализирует несколько последовательных реакций (рис. 2). Этими ферментами являются CAD (карбамоилфосфат синтаза 2 – аспартат карбамоилтрансфераза – дигидрооротаза), DHODH (дигидрооротат дегидрогеназа) и UMPS (уридинмонофосфат синтаза). Предполагается, что все три фермента – CAD, DHOHD и UMPS ассоциированы друг с другом на внешней стороне митохондриальной мембраны, что обеспечивает эффективную передачу субстратов/продуктов от фермента к ферменту [23].
Увеличение концентрации оротата через сдвиг равновесия реакций, катализируемых ферментом УМФ-синтазой, приводит к увеличению концентраций УМФ. В отличие от оротата УМФ вовлечен в гораздо большее число биохимических взаимодействий с клетками, и для рассмотрения метаболических эффектов УМФ необходимо воспользоваться метаболическим контекстом (рис. 3). Метаболический контекст определенного метаболита предусматривает специфическое описание биохимических процессов, в которые этот метаболит вовлечен.
Анализ метаболического контекста УМФ показывает, что активность уридин-цитидин киназ (UCK1, UCK2), цитидилат киназы (CMPK1), U-C киназы-1-подобного белка (UCKL1) и UMPS увеличивает концентрацию УМФ и двух других производных фосфатов (уридиндифосфат (УДФ), уридинтрифосфат (УTФ)). В то же время активность CTP-синтаз (CTPS, CTPS2), дигидропиримидин дегидрогеназы (DPYD) и уридин фосфорилаз (UPP1, UPP2) уменьшает концентрацию УМФ, УДФ и УTФ. Поскольку скорости образования УМФ из оротат-аниона и уридина сравнимы, повышение концентрации оротата за счет приема солей оротовой кислоты значительно влияет на увеличение концентраций УМФ, УДФ и УTФ. Вероятно, эти три уридинфосфата и являются сигнальными молекулами, опосредующими положительное воздействие оротата на сердечно-сосудистую систему.
Результаты экспериментальных исследований на животных подтверждают, что пероральный прием оротовой кислоты увеличивает концентрацию уридинфосфатов плазмы и приводит к уменьшению глобальной ишемии при инфаркте миокарда [31]. УМФ, равно как УДФ и УТФ, обладает значительным кардиопротективным воздействием, особенно в острый период инфаркта [32, 33]. Действие УTФ характеризуется уменьшением перегрузки кальцием митохондрий кардиомиоцитов [34], а также вазодилатационным и легким седативным эффектом [35].
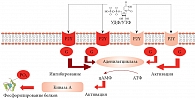
Физиологическое действие уридинфосфатов осуществляется через пуринергические рецепторы – G-белок-зависимые рецепторы, вовлеченные в вазореактивные реакции, апоптоз и секрецию цитокинов. Подобно адренергическим и аденозин-рецепторам пуринергические рецепторы активируют G-белки, а через них аденилатциклазу для внутриклеточной передачи сигнала в кардиомиоцитах (рис. 4).
Существует четыре класса этих рецепторов. Например, класс P2Y содержит 12 пуринергических рецепторов. Обратите внимание: именно рецепторы класса P2Y связывают УДФ и УTФ [36].
Из 12 пуринергических рецепторов класса P2Y особый интерес представляют рецепторы P2RY2, P2RY4, P2RY6 и P2RY14. Эти четыре рецептора действуют через один и тот же G-белок Gq/11. Кардиопротективные эффекты УТФ соответствуют вовлечению именно рецепторов P2Y [37]. P2Y6-рецепторы воздействуют на внутриклеточные пути, предотвращая апоптоз, вызванный фактором некроза опухоли альфа [38] и осуществляя вазодилатационный эффект УТФ [39]. Таким образом, оротат-анион, трансформируясь в УМФ, может осуществлять и кардиопротекцию, и дилатацию коронарных сосудов за счет активации пуринергических рецепторов P2Y6.
Молекулярные механизмы кардиопротективного воздействия магния в составе магния оротата
Обеспеченность организма магнием принципиально важна для здоровья. Ионы магния жизненно необходимы для функционирования нервной, сердечно-сосудистой, мочевыделительной и других систем организма. Магний обладает значительным собственным кардиопротективным эффектом [40], а также усиливает протективный эффект нуклеозидов, в частности аденозина [41]. Применение магния на моделях инфаркта у экспериментальных животных позволяет уменьшить размер инфаркта и увеличить выживаемость клеток в ишемической области [42]. Кардиопротективный эффект обусловлен снижением уровня кальция в области инфаркта [43], ингибированием роста уровня P-селектина [44], а также уменьшением вазоконстрикции и улучшением коронарного кровотока [45]. Кроме того, магний необходим для нормального энергетического метаболизма, внутриклеточной передачи сигнала и поддержания структуры соединительной ткани. Дефицит магния отрицательно сказывается на всех этих процессах.
Взаимодействие магния и АТФ играет важную роль в энергетическом метаболизме. В дополнение к взаимодействию магния и АТФ Mg-зависимые белки участвуют в синтезе важных коферментов, метаболизме углеводов (в гликолизе). В митохондриях Mg-зависимые белки участвуют в метаболизме пирувата и жирных кислот [46]. В частности, гликолитические ферменты енолаза (ENO1, ENO2), фосфоглюкомутаза (PGM1, PGM2, PGM3) и 6-фосфофруктокиназа (PFKP) требуют магний в качестве кофактора (рис. 5). Помимо известных функций в заключительном этапе гликолиза енолаза участвует в ряде других процессов – контроле роста клеток, гипоксии и аллергическом иммунном ответе. Фосфоглюкомутаза-1 является биосинтетическим белком, который участвует как в гликолизе, так и в глюконеогенезе. Фосфофруктокиназа конвертирует D-фруктозу-6-фосфат в 1,6-фруктозу-дифосфат и имеет значение для гликолитической деградации углеводов.
Вазоконстрикция/вазодилатация осуществляется посредством воздействия нейротрансмиттеров на рецепторы мышечных клеток, передачи сигнала внутри клеток и изменения мембранного потенциала с помощью ионных каналов. Ряд Mg-зависимых плацентарных белков участвует в этих процессах. Катехол-О-метилтрансфераза (КOMT) (рис. 6) инактивирует катехоламины. Дефицит магния приводит к уменьшению активности КOMT и, следовательно, к повышенной констрикции гладкой мускулатуры сосудов, даже при низких уровнях стресса.
Внутриклеточный сигнал от рецепторов катехоламинов, а также от пуринергических рецепторов, активируемых УДФ и УТФ, передается внутрь клетки через вторичную сигнальную молекулу – циклический аденозин 3', 5'-монофосфат (цАМФ). Амплитуда сигнала ограничена активностью Mg-зависимых аденилатциклаз (ADCY1, ADCY2 и т.д., около 10 генов). Недостаточная активность аденилатциклаз (рис. 7), вызванная внутриклеточным дефицитом магния, приводит к замедлению передачи сигнала, а значит, к снижению чувствительности клеток к внешним стимулам (в частности, к эффектам уридинфосфатов, связанных с пуринергическими рецепторами).
Соединительная ткань скрепляет различные компоненты плаценты и формирует основу хориона. Как уже отмечалось, магний влияет на структуру соединительной ткани [47]. В целом в Mg-зависимое регулирование состояния соединительной ткани вовлечены по меньшей мере 20 белков. Возможные механизмы влияния дефицита магния на синтез и деградацию соединительной ткани включают активацию матричных металлопротеиназ, лизилоксидазы, глутаминазы, замедление синтеза коллагена, эластина и гиалоуронана. При дефиците магния белковый синтез соединительной ткани замедляется, активность матричных металлопротеиназ увеличивается и внеклеточная матрица прогрессивно деградирует, поскольку структурная поддержка ткани (коллагеновые волокна) разрушается быстрее, чем синтезируется.
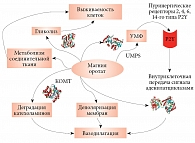
Приведенный выше анализ биохимии и системной биологии оротата позволяет сформулировать обобщенную модель его физиологического воздействия на молекулярном уровне (рис. 8). Ионы магния и оротата оказывают терапевтическое воздействие через различные молекулярные механизмы. Магний также воздействует на синтез УМФ и внутриклеточную передачу сигнала от пуринергических рецепторов. Вазодилатация тоже влияет на выживаемость клеток при ишемии, поскольку увеличение размера люмена улучшает кровообращение и способствует более интенсивному обмену веществ в области инфаркта.
Результаты экспериментов на кроликах показывают, что оротовая кислота и магния оротат способствуют улучшению липидного профиля (соотношение LDL/HDL) плазмы крови [48]. Накопление липидов в печени, вероятно, обусловлено повышением экспрессии арилацетамид-деацетилазы [49] и фосфатидат-фосфогидролазы, в то время как вызванное оротовой кислотой снижение в сыворотке крови липидов скорее всего результат повышения уровня и активности фосфолипазы C [50]. Степень влияния оротовой кислоты на липиды печени зависит от вида пищевого белка: более высокое возрастание уровня липидов наблюдалось при использовании диет, обогащенных казеином [51].
Показано положительное влияние магния оротата на выживание пациентов, перенесших инфаркт миокарда. В исследовании 79 больных с тяжелой сердечной недостаточностью прошли одногодичный курс лечения с использованием магния оротата. Согласно полученным данным, выживание составило 76% по сравнению с 52% в группе плацебо [52]. Использование магния оротата увеличивает переносимость физических нагрузок у пациентов с ишемической болезнью сердца (ИБС) [53]. На фоне применения магния оротата у пожилых пациентов с ИБС улучшаются параметры качества жизни и наблюдаются позитивные изменения психоэмоционального статуса [54]. Позитивное влияние оротата магния в этих случаях может быть связано как с увеличением вазодилатации и энергетического метаболизма кардиомиоцитов, так и с положительным воздействием на структуру соединительной ткани миокарда, что наглядно показывает успешная терапия препаратом Магнерот пролапса митрального клапана (ПМК) [55–57].
В метаанализ исследований применения магния оротата в кардиологии вошли данные 19 рандомизированных исследований, суммарно включавших 603 пациента из группы «случай» (прием Магнерота) и 587 из группы «контроль» (плацебо) [58]. Установлены достоверные ассоциации между приемом препарата и снижением:
-
гипомагниемии (относительный риск (ОР) 0,06; 95%-ный доверительный интервал (ДИ) 0,04–0,09; p = 2,5 × 10-46);
-
непереносимости физической нагрузки (ОР 0,41; 95% ДИ 0,27–0,62; p = 0,0004);
-
синдрома вегетативной дистонии (ОР 0,08; 95% ДИ 0,04–0,14; p = 2,4 × 10-21);
-
головной боли утром (ОР 0,16; 95% ДИ 0,09–0,29; p = 1,6 × 10-8);
-
головной боли напряжения (ОР 0,16; 95% ДИ 0,09–0,27; p = 5,4 × 10-10);
-
головокружения (ОР 0,28; 95% ДИ 0,15–0,50; p = 0,0004);
-
ПМК 1-й степени (ОР 0,05; 95% ДИ 0,03–0,09; p = 1,2 × 10-25);
-
регургитации 1-й степени (ОР 0,29; 95% ДИ 0,14–0,60; p = 0,0075);
-
наджелудочковой экстрасистолии (ОР 0,30; 95% ДИ 0,21–0,44; p = 1,0 × 10-8);
-
желудочковой экстрасистолии (ОР 0,48; 95% ДИ 0,30–0,76; p = 0,019);
-
пароксизмальной наджелудочковой тахикардии (ОР 0,28; 95% ДИ 0,15–0,50; p = 0,0002);
-
гипертонии (ОР 0,32; 95% ДИ 0,17–0,58; p = 0,0027).
Метаанализ показал, что использование магния оротата перспективно не только для терапии ПМК и компенсации гипомагниемии, но и для профилактики и лечения нарушений ритма сердца, регуляции артериального давления и улучшения функционирования вегетативной нервной системы [58].
Хемоинформационный анализ молекулы оротовой кислоты
У оротовой кислоты/оротат-аниона зафиксированы собственные фармакологические эффекты – синтез УМФ, активация пуринергических рецепторов и др. Возникают закономерные вопросы: все ли возможные биологические эффекты магния оротата изучены? Можно ли оценить перспективы дальнейшего исследования молекулярно-фармакологических свойств магния оротата по неочевидным направлениям?
Метаболомный подход к анализу эффектов оротата позволил оценить эти перспективы. Как известно, многие лекарственные средства мимикрируют под определенные молекулы метаболома, за счет чего оказывают как основное фармакологическое действие, так и побочные эффекты. Поэтому установление схожести молекулярной структуры действующего начала препарата (в данном случае магния оротата) с молекулярными структурами других молекул метаболома принципиально важно для выявления всех эффектов воздействия оротата на организм [2]. Имеется в виду некий спектр фармакологических возможностей магния оротата.
Такой анализ схожести молекулярных структур на уровне метаболомов возможен в рамках методологий хемоинформатики – области исследований на стыке структурной химии, фармакологии и биоинформатики, в которой взаимосвязь «химическая структура – свойство вещества» исследуется методами современной информатики. Анализ фармакологических возможностей химической структуры оротовой кислоты проводится путем сравнения химической структуры молекулы оротата с десятками тысяч других молекул метаболома на основании современных методов прикладной математики и интеллектуального анализа данных научной школы акад. РАН Ю.И. Журавлева [59–62]. Хемоинформационный подход позволяет вычислять химическое расстояние dχ между двумя произвольными молекулами, позволяющее оценить схожесть молекул по структуре [63].
На основании хемоинформационного анализа молекулы оротовой кислоты было установлено сходство между молекулой оротат-аниона и рядом молекул метаболома человека и различными лекарственными средствами. Кардиопротективные эффекты оротовой кислоты могут осуществляться за счет регуляции фермента N-ацетилглюкозамин трансферазы, ингибирования фосфодиэстераз и, возможно, противовоспалительного действия. Кроме того, результаты хемоинформационного анализа указывают на противовоспалительные, антиоксидантные, иммуномодулирующие, нейропротективные эффекты, которые остаются практически неисследованными.
С помощью хемоинформационного метода был проведен анализ схожести химической структуры молекулы оротовой кислоты (оротат-аниона) с молекулами в базе данных метаболома человека и базах данных лекарственных средств [64]. В результате при анализе свыше 40 000 молекул метаболома человека и 2700 молекул известных лекарственных средств установлено, что 632 молекулы наиболее близки к оротату по химической структуре. На основании информации (в частности, ключевых слов), содержащейся в HMDB и PubChem, для каждой из этих молекул были проанализированы средние химические расстояния. Результаты оказались весьма интересными (рис. 9).
Во-первых, среди схожих с оротат-анионом веществ значительное число компонентов растительных экстрактов. Оротат схож со многими алкалоидами коры, корней и плодов цитрусовых и других растений (например, антиоксидант метил-2-аминобензойная кислота (dχ = 0,68) содержится в эфирных маслах бергамота, жасмина, черного чая, рисовых отрубей, кожуры апельсина и лимона), а также с рядом алкалоидов руты (гидрокси-3-метокси-10-митилакридон и др.). В наpодной медицине экстракты руты (Ruta graveolens) используются как средства, снижающие ревматические и невралгические боли. На достаточно близком расстоянии (dχ = 0,58) расположены антиоксиданты авенантрамиды А, В, С, D экстракта зерен овса (Avena sativa). Многие из растительных экстрактов характеризуются противовоспалительными свойствами, например салицилаты (dχ = 0,70–0,75), полифенолы типа циннамовой, кофеиновой кислот (dχ = 0,7–0,8) и апигенин (dχ = 0,63). Заметим, что полифенол апигенин входит в состав прополиса, сельдерея, петрушки, аптечной ромашки и обладает отчетливыми противораковыми свойствами.
Во-вторых, анализ схожих по структуре с оротовой кислотой молекул позволил выделить несколько десятков соединений, характеризующихся известной фармакологической активностью.
Противовоспалительное действие
Оротовая кислота является одним из промежуточных продуктов пиримидинового метаболизма. Неудивительно, что структура оротат-аниона схожа со структурами различных производных мочевой кислоты (dχ = 0,40–0,50): 1-метилмочевой кислоты (один из трех основных метаболитов теофиллина [65]), 1,3-диметилмочевой кислоты (продукт метаболизма теофиллина [66]), 1,7-диметилмочевой кислоты (основной метаболит кофеина в моче, образуется при посредстве цитохрома CYP2A6 [67]). Мочевая кислота служит маркером старения. Ее повышенные уровни в организме ассоциированы с диабетом и формированием камней в почках [68].
Сходство структур мочевой и оротовой кислот позволяет предположить, что оротовая кислота может тормозить эффекты мочевой кислоты (в частности, ингибировать образование уратных камней в почках и снижать воспаление).
Хемоинформационный анализ показал сходство структуры молекулы оротовой кислоты со структурами ряда нестероидных противовоспалительных препаратов (НПВП), такими как мефенамовая кислота (dχ = 0,64), меклофенамовая кислота (dχ = 0,67), 3-аминосалициловая кислота, антипирин, салициламид, индометацин, толметин и нифлумовая кислота (dχ = 0,73–0,75). Основываясь на сходстве молекулярной структуры оротата с НПВП, можно предположить, что оротат способен взаимодействовать с циклооксигеназой, несколько замедляя синтез провоспалительных простагландинов. В эксперименте прием оротовой кислоты снижал уровни омега-6-полиненасыщенных жирных кислот, из которых синтезируются провоспалительные эйкозаноиды и за счет которых осуществляется регуляция простагландинового метаболизма [69].
Иммуномодуляция и противоопухолевое действие
Ряд молекул, схожих по структуре с оротатом, характеризуются иммуномодулирующим эффектом. Например, тимин (dχ = 0,50) – одно из четырех оснований, образующих последовательность ДНК и обладающих противовирусным действием (по отношению к вирусу гриппа) [70]. Соединение 5-гидроксиметилурацил (dχ = 0,50) – иммуномодулятор клеточного и гуморального ответа используется для лечения язвенной болезни желудка и при эрозивном поражении кишечника [71, 72], а 5-гидроксиметил-4-метилурацил стимулирует лейкоцитопоэз (dχ = 0,60).
Иммуномодулирующее действие присуще антиоксидантам растительных экстрактов – темурину, авенантрамидам, муконину, пиперолактаму. Темурин, или теакрин (dχ = 0,52), – пуриновый алкалоид плодового дерева купуасу (Theobroma grandiflorum, семейство «Мальвовые») и камелии (Camellia assamica, семейство «Чайные») характеризуется противовоспалительным и обезболивающим действием [73]. Полифенол овса авенантрамид L и другие авенантрамиды (dχ = 0,52) отличаются антиоксидантным потенциалом и противовоспалительной активностью [74]. Пиперолактам А (dχ = 0,61), алкалоид корней особого вида индийского перца (Piper longum), оказывает противоопухолевое действие [75].
Нейропротективные эффекты
Отмечено сходство структуры молекулы оротата с рядом нейропротективных метаболитов, прежде всего с кинуреновой кислотой (dχ = 0,45). Кинуреновая кислота – эндогенный антагонист глутаматных ионотропных (NMDA) рецепторов с нейропротективным и противосудорожным действием [76, 77].
Кардиопротективные эффекты
Традиционно кардиопротективные эффекты магния оротата связывали с компенсацией дефицита магния у пациентов с острым инфарктом миокарда, ПМК, алкогольной миокардиодистрофией, тахиаритмией и др. Результаты хемоинформационного анализа указывают на иные многочисленные молекулярные механизмы, посредством которых молекула оротата может стимулировать кардиопротекцию. К таким механизмам относятся прежде всего регуляция фермента N-ацетилглюкозамин трансферазы и ингибирование фосфодиэстераз.
Регуляция N-ацетилглюкозамин трансферазы. Оротовая кислота характеризуется высокой степенью сходства с урацилом (dχ = 0,44). Урацил и его фосфат-производные (например, УДФ) служат аллостерическими регуляторами и коферментами для ряда биохимических реакций. В частности, УДФ-глюкоза регулирует превращение глюкозы и галактозы в печени и в других тканях. Урацил является регулирующим компонентом метаболизма бета-аланина, биосинтеза пантотената и кофермента А, а также фермента N-ацетилглюкозамин трансферазы (ген OGT) [78], который участвует в поддержке резистентности к инсулину в мышцах и клетках адипоцитов. Фермент ингибируется УДФ [78] и, возможно, непосредственно оротовой кислотой. Торможение активности фермента схожим с УДФ оротат-анионом соответственно способствует активации углеводного метаболизма и снижению апоптоза кардиомиоцитов.
Ингибирование фосфодиэстераз. Хемоинформационный анализ показал существенное сходство между оротовой кислотой и рядом соединений – ингибиторов ферментов фосфодиэстераз (эноксимон, амринон, теофиллин, милринон). Как известно, фосфодиэстеразы участвуют в регуляции внутриклеточной передачи сигнала от рецепторов различных типов (адренергических, метаботропных ацетилхолиновых и глутаматных, дофаминовых, аденозиновых, гистаминовых, глюкагоновых и др.) [79]. Фермент 3',5'-фосфодиэстераза деградирует циклический АМФ, тем самым ослабляя передачу сигналов от соответствующих рецепторов. И наоборот, ингибирование фосфодиэстеразы улучшает передачу сигнала по сигнальным каскадам. Например, эноксимон (dχ = 0,56) – селективный ингибитор фосфодиэстераз. Характеризуется сосудорасширяющим действием и ноотропной активностью, которая не вызывает изменений в потреблении кислорода миокардом. Используется у пациентов с хронической сердечной недостаточностью [80].
Хемоинформационный анализ указал и на другие возможные механизмы осуществления кардиопротективного эффекта оротат-аниона. Например, схожая с оротовой кислотой 2-индолкарбоновая кислота (dχ = 0,50), один из полифенольных компонентов женьшеня и других растительных экстрактов, является сильным ингибитором перекисного окисления липидов [81]. Схожий с оротатом оксипуринол (dχ = 0,55) – ингибитор ксантиноксидазы используется для лечения хронической сердечной недостаточности [82]. Теобромин (dχ = 0,73) обладает не только бронхолитическим и слабым мочегонным, но также сосудорасширяющим и кардиостимулирующим действием [83].
Взаимодействие оротата магния с другими веществами и лекарственными средствами
Оротат-анион и магния оротат плохо растворяются в воде и органических растворителях. Магния оротат разрушается под воздействием прямых солнечных лучей. При совместном приеме с фолиевой кислотой и фолатами значительно улучшает их биодоступность. Оротовая кислота при гиповитаминозе В12 способна нивелировать дефицит цианокобаламина. Прием магния оротата во время курса антибиотиков потенцирует эффективность антибактериального действия антибиотиков разных классов (пенициллины, цефалоспорины и др.), снижает риск побочных эффектов от применения антибиотиков (снижение слуха, поражение почек, нейротоксические проявления, дисбиоз кишечника и т.д.).
Заключение
Долгое время клинические эффекты, наблюдаемые при использовании органических солей магния, приписывались исключительно магнию, а роль органических анионов ограничивалась повышением биодоступности магния при пероральном приеме препаратов. Независимые позитивные эффекты анионов на физиологию человека, как правило, не рассматривались, и оротат-анион оставался одним из наименее исследованных анионов, который, как считалось, просто участвует в транспорте магния внутрь кардиомиоцитов и других клеток.
Анализ молекулярных механизмов физиологического воздействия оротат-аниона, входящего в состав магния оротата, показал, что наиболее вероятный механизм осуществляется через увеличение синтеза УМФ и других уридинфосфатов. Уридинфосфаты являются сигнальными молекулами, взаимодействующими с пуринергическими рецепторами, активация которых приводит к вазодилатации и позитивным изменениям липидного профиля.
Анализ схожести химической структуры оротат-аниона с молекулами метаболома человека (хемоинформационный анализ) позволил предположить фармакологическую предопределенность иммуномодулирующего, противовоспалительного, нейро- и кардиопротективного вектора действия магния оротата (рис. 10). Кардиопротективные свойства могут осуществляться за счет образования кардиопротективных УДФ, воздействия на аденозиновые рецепторы, регуляции N-ацетилглюкозамин трансферазы, ингибирования фосфодиэстераз и ксантин оксидазы, антиоксидантного эффекта. Полученные результаты указывают на перспективные направления дальнейших экспериментальных и клинических исследований оротовой кислоты.
Таким образом, с физиологической точки зрения совместное применение магния и оротата имеет яркий синергизм для оптимизации кровоснабжения зоны инфаркта. Как показывают данные ряда исследований по доказательной медицине и наша собственная клиническая практика, применение магния оротата в комплексной программе (наряду с другими метаболическими, физическими и психологическими мерами терапевтического воздействия) положительно влияет на выживание и самочувствие пациентов с ИБС.
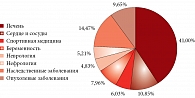
Согласно предварительному анализу 6500 публикаций по оротовой кислоте и магния оротату, значительное число исследований сконцентрированы в таких областях, как гепатология, сердечно-сосудистая система, спортивная медицина, наследственные заболевания (связанные с нарушением метаболизма оротата и других пиримидинов). Перспективными направлениями исследования являются антионкологические эффекты, нутриционная поддержка магния оротатом при беременности, использование оротовой кислоты и магния оротата в лечении неврологических заболеваний (рис. 11).
O.A. Gromova, I.Yu. Torshin, A.G. Kalacheva
Ivanovo State Medical University
Russian Satellite Centre of Trace Element – Institute for Unesco
Moscow Institute of Physics and Technology (State University)
Contact person: Olga Alekseyevna Gromova, unesco.gromova@gmail.com
Orotic acid and its magnesium salt are used in a fomr of pharmacological agents belonging to group of anabolics. Magnesium orotate is widely applied in cardiology practice. Here we present the results from the latest studies pointing at a broad range of molecular mechanisms, whereby therapeutic effects of magnesium orotate are fulfilled.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.