количество статей
7154
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Перспективы применения препаратов на основе оротата магния у пациентов с сердечно-сосудистыми заболеваниями
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и Ангиология" № 2 (33)
- Аннотация
- Статья
- Ссылки

Рис. 1. Взаимосвязь уровня потребления магния с пищей и риска развития сердечно-сосудистых заболеваний (а) и взаимосвязь концентрации магния в сыворотке крови и риска развития сердечно-сосудистых заболеваний (б)
Рис. 2. Дозозависимый кардиопротекторный эффект магния (результаты метаанализа)
Рис. 3. Функциональные классы магнийзависимых белков ССС
Рис. 4. Функции магнийзависимых белков ССС
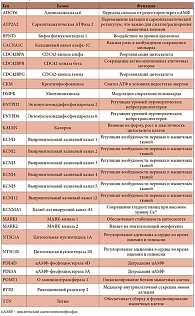
Таблица 1. Магнийзависимые белки, поддерживающие функционирование сердечной мышцы, и соответствующие гены
Рис. 5. Пространственные структуры некоторых магнийсвязывающих белков, поддерживающих функционирование сердечной мышцы
Таблица 2. Магнийзависимые белки энергетического метаболизма сердечной мышцы
Рис. 6. Магнийзависимые белки гликолиза
Таблица 3. Магнийзависимые белки клеточного цикла (митотическое деление клетки)
Таблица 4. Магнийзависимые белки репарации ДНК
Рис. 7. Основные формы оротовой кислоты
Рис. 8. Внутриклеточная передача сигнала от пуринергических рецепторов
Таблица 5. Магнийзависимые белки выживания и роста клеток
<p class="x-podzag-"><b>Введение</b></p>
<p class="x-text">При дефиците в организме микронутриентов (ионов металлов, элементоорганических соединений, витаминов) метаболизм макронутриентов, таких как жиры, белки и углеводы, существенно затруднен. Микронутриенты непосредственно воздействуют на физиологические процессы, поскольку в подавляющем большинстве случаев являются кофакторами ферментов или факторами стабилизации пространственной структуры белков и рибонуклеиновых кислот (РНК). В ходе крупномасштабных исследований подтверждено, что функционирование сердца и всей сердечно-сосудистой системы (ССС) резко нарушается в условиях дефицита ряда микронутриентов, в частности магния.</p>
<p class="x-text">Например, корреляция между смертностью от сердечно-сосудистых заболеваний и уровнями магния в питьевой воде известна достаточно давно [1]. Сравнительно недавнее шведское исследование с участием 1679 пациентов показало, что риск смерти от инфаркта миокарда в группе лиц с высоким уровнем магния в питьевой воде (> 0,83 ммоль/л) был ниже, чем в группе с меньшими уровнями (< 0,75 ммоль/л). Риск смерти от острого инфаркта миокарда составил 0,64 (95% доверительный интервал (ДИ) [0,42, 0,97]) для группы с самым высоким содержанием магния в питьевой воде [2].</p>
<p class="x-text">По данным исследования смертности после коронарного шунтирования в когорте из 957 пациентов, низкий (< 0,8 ммоль/л) уровень магния в сыворотке связан с повышением риска смерти или инфаркта миокарда в два раза [3]. Как показали результаты исследования Фрамингемской когорты из 3327 человек, более низкие уровни калия (р = 0,002) и магния (р = 0,01) связаны с повышенным риском желудочковой аритмии [4].</p>
<p class="x-text">Метаанализ исследований применения препаратов магния для экстренной терапии тахисистолической формы фибрилляции предсердий свидетельствует о том, что магний эффективен для нормализации частоты сердечных сокращений (ЧСС) (отношение шансов (ОШ) составило 1,96; 95% ДИ [1,24, 3,08]) и восстановления ритма (ОШ = 1,60; 95% ДИ [0,7, 2,39]). Восстановление ритма или контроль ЧСС достигался у 86% пациентов в группе магния и только у 56% пациентов в контрольной группе (ОШ = 4,61; 95% ДИ [2,67, 7,96]) [5].</p>
<p class="x-text">Изучение в течение 8 лет когорты из 5511 участников в возрасте от 28 до 75 лет без артериальной гипертонии (АГ) на момент начала исследования показало, что риск развития АГ (диастолическое артериальное давление (АД) ≥ 140 мм рт. ст. или систолическое АД ≥ 90 мм рт. ст.) снижался с увеличением содержания магния в суточной моче. Более высокие уровни магния в моче говорят о более высоком потреблении магния с пищей и препаратами. Увеличение содержания магния на каждые 2 ммоль приводило к снижению риска АГ на 21% (ОШ = 0,79; 95% ДИ [0,71–0,88]) [6].</p>
<p class="x-text">Метаанализ проспективных когортных исследований суммарно включил 532 979 участников из 19 исследований, в том числе 19 926 пациентов с установленными сердечно-сосудистыми заболеваниями (ССЗ). Сравнение подгруппы участников с самыми высокими уровнями потребления магния с пищей с подгруппой участников с самым низким потреблением магния показало, что риск ССЗ при высоком уровне потребления магния снижался в среднем на 15% (ОШ = 0,85; 95% ДИ [0,78, 0,92]; рис. 1). При сравнении пациентов с высоким и низким уровнем магния в плазме крови в группе высоких концентраций показано снижение риска ССЗ на 23% (ОШ = 0,77; 95% ДИ [0,66, 0,87]). Подтвержденный кардиопротекторный эффект магния был дозозависимым: увеличение уровня магния в плазме крови на 0,2 ммоль/л соответствовало снижению риска ССЗ в среднем на 25% (рис. 2) [7].</p>
<p class="x-text">Таким образом, кардиопротекторный эффект магния не подлежит сомнению. При недостатке магния сердечная мышца утрачивает способность выдерживать значительную физическую нагрузку, что может приводить к развитию инфаркта миокарда из-за физической перегрузки миокарда. Магний поддерживает энергетические и пластические процессы, стабилизирует АТФ, участвует в окислении жирных кислот, гликолизе и биосинтезе белка, синтезе оксида азота в эндотелии сосудов и др. Магний также является физиологическим регулятором возбудимости клетки и необходим для нормального течения процессов деполяризации нервных и мышечных клеток [1, 8].</p>
<p class="x-podzag-"><b>Функциональные группы магнийзависимых белков ССС</b></p>
<p class="x-text">Несмотря на что о роли ионов магния известно давно, информация о молекулярных механизмах данного процесса до сих пор полностью не систематизирована. В литературе, а также в специализированных базах данных по биоинформатике и биохимии (MEDLINE (http://www.ncbi.nlm.nih.gov/pubmed/) и ExPASy – Bioinformatic Resourse Portal (www.expasy.ch)) описано свыше 100 магнийзависимых белков, влияющих на функциональное состояние тканей сердца и сосудов.</p>
<p class="x-text">Все эти белки могут быть подразделены на 8 основных классов в зависимости от функции: поддержание деятельности сердечной мышцы, сохранение структуры соединительной ткани сердечной мышцы; энергетический метаболизм, внутриклеточный транспорт, клеточный цикл, репарация ДНК, апоптоз и пролиферация клеток. Многие из белков одновременно относятся к нескольким функциональным классам. Например, магнийзависимые МАР-киназы (MAPK (<span class="x-2">mitogen-activated protein kinase</span> – активируемая митогеном протеинкиназа), MAP2K и т.д.) участвуют не только в процессах апоптоза, но также в сигнальных путях пролиферации клеток и репарации ДНК. Но для простоты изложения каждый из белков был отнесен нами только к одному классу (рис. 3). Большинство магнийзависимых белков относятся к функциональным классам, обеспечивающим поддержание функционирования сердечной мышцы (27), энергетический метаболизм (17) и пролиферацию клеток (18).</p>
<p class="x-podzag-"><b>Магнийзависимые белки, поддерживающие функционирование сердечной мышцы</b></p>
<p class="x-text">Уровень магния значительно влияет на сократимость миокарда, а дефицит этого минерала приводит к снижению сократимости и аритмиям. Например, исследование эффектов длительного магниевого дефицита у крыс (8 недель на диете, обедненной магнием) показало снижение содержания внутриклеточных адениннуклеотидов, повышение уровня креатинфосфата и уменьшение силы сокращения миокарда без изменения ЧСС [8]. Эти и другие последствия дефицита магния опосредуются рядом магнийзависимых белков, непосредственно влияющих на функцию сердечной мышцы. Эти белки можно подразделить на ферменты, регулирующие уровни сигнальных молекул, магнийзависимые белки, управляющие потоком катионов через мембраны, и белки, поддерживающие цитоскелет мышечных клеток. Полный список белков всех трех категорий приведен в табл. 1.</p>
<p class="x-text">Достаточные уровни магния необходимы для сбалансированного управления ионными каналами клеточных мембран. При недостатке магния и нервные, и мышечные клетки становятся сверхвозбудимыми. В осуществлении процесса нервно-мышечной проводимости ионы кальция и магния выступают в качестве естественных антагонистов. Ионы Са<font size="2"><sup>2+</sup></font> пособствуют взаимодействию актина и миозина, а также активируют актомиозиновую аденозинтрифосфатазу (АТФазу), которая участвует в сокращении гладких мышц скелетной мускулатуры. В противоположность ионам Са<font size="2"><sup>2+</sup></font> ионы Mg<font size="2"><sup>2+</sup></font> ингибируют актомиозиновую АТФазу и активируют гидролиз ацетилхолина через холинэстеразу, что приводит к торможению возбудимости нервных окончаний и расслаблению мышцы.</p>
<p class="x-text">К данной категории белков относятся прежде всего АТФ-зависимые выпрямительные калиевые каналы (KCNJ1, KCNJ2, KCNJ3 и проч.). Они активируются G-белками (которые в свою очередь опосредуют внутриклеточную передачу сигнала от адренергических и других видов рецепторов) и участвуют в создании действующего потенциала, регулируя таким образом возбудимость нервных и мышечных тканей. Регуляция происходит через «выпрямительный эффект» (то есть путем увеличения притока калия внутрь клеток), который основан на блокировании магнием транспорта калия из клетки. Генетические дефекты в KCNJ2 и других выпрямительных калиевых каналах являются причиной синдрома удлиненного интервала Q – T, периодического паралича [9]. При дефиците магния блокировка транспорта магния из клетки будет уменьшена, «выпрямительный эффект» значительно снизится, что также приведет к удлинению интервала Q – T на кардиограмме и аритмиям соответствующего типа. Модель пространственной структуры выпрямительных калиевых каналов приведена на рис. 5а.</p>
<p class="x-text"><i>Калий-активируемый канал</i> <i>А1 </i>(ген KCNMA1, рис. 5а) контролирует сокращение гладких мышц при высоком уровне Cа<font size="2"><sup>2+</sup></font> вследствие активации рианодиновых рецепторов. Активация канала А1 способствует снижению возбуждающих стимулов, приводящих к увеличению концентрации кальция в клетке (то есть данный канал непосредственно влияет на реполяризацию клетки и восстановление мембранного потенциала). Дефекты в гене KCNMA1 приводят к судорогам эпилептоидного типа и пароксизмальным дискинезиям. Исследования моделей животных с делецией гена показали задержку развития плода и наличие ярко выраженной атаксии, нарушения координации движений и значительное уменьшение спонтанной активности в клетках Пуркинье вследствие сниженной способности клеток к реполяризации [10]. Дефицит магния будет приводить к потере функции этого магнийзависимого белка и схожим физиологическим проявлениям и клинической симптоматике вследствие ингибирования магнием кальциевых каналов.</p>
<p class="x-text">В частности,<i> магний ингибирует кальциевый канал альфа-1C</i> (CACNA1C) и калий-активируемый канал А1 (KCNMA1). Кальциевый канал альфа-1C – посредник проникновения ионов кальция в возбудимых клетках, играющий важную роль в стимуляции сокращения миокарда. В других тканях канал альфа-1С участвует в секреции гормонов, нейротрансмиттеров, цитокинезе, делении и апоптозе клеток. Исследования животных показали, что этот белок также является транспортером железа внутрь кардиомиоцитов при избыточном уровне железа в крови [11]. Дефекты в гене, кодирующем CACNA1C, приводят к синдрому Бругада [12], характеризующемуся картиной блокады правой ножки пучка Гиса и подъемом ST-сегмента в отведениях V1–V3 на электрокардиограмме, а также пароксизмами желудочковой тахикардии/фибрилляции желудочков, в том числе с летальным исходом. Недостаток магния, необходимого для функции кальциевого канала CACNA1C, приведет к уменьшению функциональной активности канала и схожим (хотя, конечно, намного менее интенсивным) клиническим проявлениям.</p>
<p class="x-text">Заметим, что ионы кальция и магния выступают в качестве естественных антагонистов. Магний также модулирует функции и самих рианодиновых рецепторов (RYR2 и др.), которые являются важнейшими медиаторами внутриклеточной секреции ионов кальция. Рианодиновые рецепторы саркоплазматического ретикулума – основное место связывания кальция, необходимого для сокращения сердечной мышцы. Название рецепторов данного типа происходит от алкалоида «рианодин», который специфически связывается рецепторами и модулирует их активность. Дефекты в RYR2 приводят к аритмогенной дисплазии правого желудочка, характеризующейся частичной деградацией его миокарда. Кроме того, дефекты гена приводят к катехоламинзависимой тахикардии [13, 14], которая может вызвать внезапную остановку сердца, особенно при стрессе. Как показали исследования на крысах, магний модулирует активность рианодиновых рецепторов: при высоких концентрациях – ингибирует [15], при низких – активирует [16]. Ингибирующий эффект магния может сниматься кофеином [17].</p>
<p class="x-text"><i>Саркоплазматическая АТФаза 2</i> (ген ATP2A2, синоним: SERCA2; рис. 5б) – магнийзависимый ионный канал, функция которого заключается в транспорте магния внутрь саркоплазматического ретикулума мышечных клеток за счет энергии гидролиза АТФ. Белок SERCA2 был обнаружен в различных типах клеток – от эпидермиса до тромбоцитов, и может регулировать тромбинстимулированную активацию тромбоцитов [18]. Однако наиболее высокие уровни белка АТФазы-2 выявлены именно в миокарде, поскольку перемещение кальция в саркоплазматический ретикулум важно для сокращения/расслабления мышечных волокон. Исследование моделей животных с гетерозиготной делецией гена показало снижение сократимости кардиомиоцитов [19]. Дефицит магния будет сопровождаться схожими эффектами в отношении функции этого белка и, следовательно, физиологии кардиомиоцитов, со снижением минутного объема сердца.</p>
<p class="x-text">Магнийзависимые белки влияют на функцию сердечной мышцы через <i>регулировку уровней сигнальных молекул</i>, таких как цАМФ, аденозин и другие нуклеотиды. Эти сигнальные молекулы, как и калиевые выпрямительные каналы, вовлечены в каскады внутриклеточной передачи сигнала от G-белков. Например, в случае сигнального каскада аденозиновых рецепторов магний вовлечен в регулирование уровней аденозина, цАМФ, а также в фосфорилирование белков. Аденозин – сигнальная молекула, основной функцией которой является цитопротекция при гипоксии, ишемии или других видах стресса. Аденозин также характеризуется сильным противовоспалительным эффектом. В ряде случаев он применяется как средство предотвращения желудочковой тахикардии.</p>
<p class="x-text">К цАМФ-зависимой внутриклеточной передаче сигнала имеет прямое отношение <i>фермент аденилатциклаза </i>(рис. 5в), который, собственно, и синтезирует цАМФ. Аденилатциклазы активируются или тормозятся G-белками, которые в сочетании с мембранными рецепторами обеспечивают реакцию клетки на гормональные и другие стимулы. цАМФ является важной молекулой передачи сигнала от клеточных рецепторов к регуляторам транскрипции. В то же время кальций ингибирует сердечную форму аденилатциклазы (ген ADCY6), замещая функционально необходимые ионы магния [20]. Все аденилатциклазы имеют весьма схожую пространственную структуру и действуют по каталитическому механизму, в котором задействованы два ключевых иона магния [21]. Понижение активности аденилатциклаз при дефиците магния также будет уменьшать сократимость клеток миокарда и, как следствие, может приводить к избыточной секреции адреналина, поскольку уменьшается минутный объем сердца.</p>
<p class="x-text">Магний необходим для функции белков, отвечающих за <i>стабильность и реорганизацию цитоскелета мышечных клеток</i>. К таким белкам относятся прежде всего MARK-киназы (MARK1, MARK2), CDC42-киназы (CDC42BPA, CDC42BPB, CDC42BPG), миотонинкиназа (DMPK), калирин (KALRN) и O-маннозилтрансфераза 1 (POMT1). Последний белок отвечает за гликозилирование белков, и дефекты в гене POMT1 являются причиной мышечных дистрофий [22]. Уровни миотонинкиназы DMPK понижены в тканях у пациентов, страдающих миотонической дистрофией [23]. Титин (TTN) – ключевой компонент в сборке и функционировании мускулатуры, обеспечивающий связь на уровне отдельных микрофиламентов и взаимодействующий с тропомиозином и миозином. Дефекты в TTN являются причиной наследственных кардиомиопатий [24]. Таким образом, дефицит магния не только отрицательно влияет на сократимость миокарда, но и способен приводить к долговременным неблагоприятным изменениям структуры и самих мышечных клеток.</p>
<p class="x-text"><i>Креатинфосфокиназа </i>(ген СKM, рис. 5г) катализирует превращение аденозиндифосфата в АТФ, используя фосфокреатин как источник фосфата и образуя креатин как продукт реакции. В тканях с интенсивным метаболизмом (таких как миокард, мозг) фосфокреатин служит резервуаром энергии для быстрого синтеза АТФ при метаболической потребности. В клинической практике достаточно часто используется тест с определением активности креатинфосфокиназы. Нормальные значения должны быть в диапазоне 25–200 МЕ/л, а повышенное содержание свидетельствует о повреждении мышечной ткани, прежде всего миокарда. Таким образом, креатинфосфокиназа необходима для оперативного поддержания энергетического метаболизма сердечной мышцы. Магний необходим для функции креатинфосфокиназы [25], его недостаток будет способствовать снижению метаболизма миокарда.</p>
<p class="x-podzag-"><b>Магнийзависимые белки метаболизма соединительной ткани</b></p>
<p class="x-text">Мы подробно проанализировали механизмы влияния магния на структуру соединительной ткани [26]. В магнийзависимое регулирование состояния соединительной ткани вовлечены по меньшей мере 20 белков. Возможные механизмы влияния дефицита магния на синтез и деградацию соединительной ткани включают активацию матричных металлопротеиназ, лизилоксидазы, глутаминазы, замедление синтеза коллагена, эластина и гиалоуронана, а также устранение ингибирования магнием металлопротеиназ и гиалоуронидаз, способствующих деградации соединительной ткани.</p>
<p class="x-text">При дефиците Mg<font size="2"><sup>2+</sup></font> белковый синтез соединительной ткани замедляется, активность матричных металлопротеиназ увеличивается и внеклеточная матрица прогрессивно деградирует, поскольку структурная поддержка ткани (в частности, коллагеновые волокна) разрушается быстрее, чем синтезируется. На структуру соединительной ткани, в частности хряща, могут также оказывать влияние магнийзависимые белки сигнальных путей пролиферации клеток и прежде всего активин рецептор типа 2B (ACVR2B), активирующий SMAD-транскрипционные регуляторы, что приводит к активации фибробластов и ускорению заживления ран.</p>
<p class="x-podzag-"><b>Энергетический метаболизм</b></p>
<p class="x-text">Энергетический метаболизм – достаточно широкое понятие, включающее анаболические и катаболические процессы с участием белков, жиров и углеводов, которые в конечном итоге способствуют накоплению резерва клеточного АТФ, этой универсальной молекулы энергопереноса в биологических системах. Всего лишь 1 мМ ионов магния находится в организме в свободном состоянии, остальная часть связана с белками и растворимыми соединениями (такими как АТФ, миозин скелетной мышцы, тропонин C миокарда), аминокислотами (в частности, с глицином, аланином, аспарагиновой кислотой) и различными ферментами. Взаимодействия магния с АТФ наиболее важны для энергетического метаболизма: Mg<font size="2"><sup>2+</sup></font> стабилизирует молекулу АТФ путем нейтрализации избыточного отрицательного заряда фосфатов.</p>
<p class="x-text">Дефицит магния негативно сказывается на функционировании многих белков ССС, которые поддерживают энергетический метаболизм и требуют магний в качестве кофактора. Эти магнийзависимые белки участвуют в синтезе важных коферментов, в метаболизме углеводов (например, в гликолизе), а в митохондриях – в метаболизме пирувата и жирных кислот (табл. 2). Снижение активности этих ферментов, прежде всего гликолитических, служит наиболее вероятным объяснением формирования инсулинорезистентности.</p>
<p class="x-text">Никотинамидмононуклеотид (НАД), флавинмононуклеотид (ФМН), флавинадениндинуклеотид (ФАД) и кофермент-А (КоА) служат коферментами многих различных ферментов и прежде всего ферментов, участвующих в реакциях энергетического метаболизма. Никотинамид-мононуклеотид-аденилтрансферазы 1 и 2 (гены NMNAT1, NMNAT2) катализируют формирование НАД из никотинамидрибонуклеотида и АТФ. Пероксисомальная кофермент-А-дифосфатаза (NUDT7) регулирует уровни КоА и ацил-КоА в ответ на требования метаболизма. Кофермент А играет ключевую роль в синтезе и окислении жирных кислот, а также в окислении пирувата в цикле лимонной кислоты.</p>
<p class="x-text">Гликолитические ферменты енолаза (ENO2), фосфоглюкомутаза (PGM3) и 6-фосфофруктокиназа (PFKP) нуждаются в магнии в качестве кофактора (рис. 6). Енолаза, помимо известных функций в заключительном этапе гликолиза, участвует в ряде других процессов, таких как контроль роста клеток, гипоксия и аллергический иммунный ответ. Фосфоглюкомутаза-1 является биосинтетическим белком, который участвует и в гликолизе, и в глюконеогенезе. Фосфофруктокиназа конвертирует D-фруктозо-6-фосфат в 1,6-фруктозодифосфат и имеет важное значение для гликолитической деградации углеводов.</p>
<p class="x-text">Магнийзависимые ферменты митохондриальной фракции ткани сердца участвуют в метаболизме пирувата и жирных кислот. Дефицит магния будет снижать активность каждого из этих ферментов, приводя к снижению количества АТФ, производимого в митохондриях.</p>
<p class="x-podzag-"><b>Другие механизмы воздействия магнийзависимых белков на функционирование ССС</b></p>
<p class="x-text">Помимо рассмотренных выше белков, участвующих в поддержании функционирования миокарда, структуры соединительной ткани и энергетическом метаболизме, магнийзависимые белки необходимы и для ряда других молекулярных физиологических механизмов, важных для сердечно-сосудистой системы. К этим механизмам относятся транспорт катионов, белки клеточного цикла, магнийзависимого восстановления ДНК, апоптоза и выживания клеток.</p>
<p class="x-text">Транспорт катионов металлов не менее важен, чем транспорт жиров и высокомолекулярных соединений (белков, нуклеиновых кислот) посредством пузырьков. Катионы макро- и микроэлементов имеют решающее значение для поддержания здоровья материнского организма и плода. Кальциевые транспортеры ATP2B1 и ATP2B4 гидролизуют АТФ для удаления избыточного кальция из клетки. Медь-транспортирующая АТФаза (ATP7A) поддерживает транспорт меди для медь-зависимых белков в аппарате Гольджи, а при повышенном содержании внеклеточной меди регулирует ее отток из клетки. SLC41A1 является транспортером магния, а серин/треонинкиназа «без лизина» 1 (WNK1) контролирует транспорт хлорида натрия. Дефекты в гене WNK1 являются причиной гипоальдостеронизма, характеризующегося тяжелой гипертонией и гиперкалиемией, возникающими как результат хлоридного шунта в почечном дистальном нефроне [27].</p>
<p class="x-text">В молекулярной биологии клеточным циклом называется последовательность закономерно сменяющих друг друга фаз от образования клетки в результате деления до разделения ее на две дочерние клетки следующего поколения. Клеточный цикл контролируется в основном двумя классами молекул: циклинами и циклинзависимыми киназами [28]. Однако помимо этих основных регуляторов цикла сотни других белков вовлечены в поддержку прогрессии цикла, и 12 из них – магнийзависимые белки, высокие уровни экспрессии которых обнаружены в сердечной мышце (табл. 3). Дефицит магния приведет к снижению активности этих белков, что затормозит прогрессию клеточного цикла и сможет инициировать процессы апоптоза.</p>
<p class="x-text"><b><i>Магнийзависимое восстановление ДНК</i></b>. Репарация ДНК подразумевает совокупность различных внутриклеточных процессов, направленных на выявление и исправление повреждений геномной ДНК. Умеренное количество повреждений ДНК может привести к ингибированию деления клеток («арест клеточного цикла») и индукции генов, ответственных за пострепликационный ремонт, рекомбинацию, вырезание нуклеотидов генов и контроль стабильности мРНК (матричной рибонуклеиновой кислоты) [28]. Активность ряда белков репарации ДНК, найденных в тканях сердца, зависит от магния (табл. 4). Таким образом, дефицит магния приведет к замедлению процессов репарации ДНК, что негативно скажется на выживании клеток миокарда и других тканей сердца, особенно в условиях стресса.</p>
<p class="x-text"><b><i>Магний и белки, ответственные за апоптоз и выживание клеток</i></b>. Регуляция выживания и роста клеток включает ряд перекрывающихся каскадов внутриклеточной сигнализации. Магнийзависимые белки, связанные с процессами пролиферации клеток, принадлежат к нескольким из этих молекулярных каскадов. Все они поддерживают процессы пролиферации, и дефицит магния приведет к менее интенсивной пролиферации и, следовательно, к менее интенсивному восстановлению клеток сердечной мышцы (особенно клеток, пострадавших при ишемии).</p>
<p class="x-text">Полный список магнийзависимых белков, связанных с пролиферацией, представлен в табл. 5. Большинство белков являются MAPK-киназами, активность которых важна для передачи внутриклеточных сигналов, апоптоза и выживания клеток. Некоторые из магнийзависимых белков относятся к сигнальным путям TGF-бета (transforming growth factor beta – трансформирующий фактор роста бета). TGF-бета играет важнейшую роль в регенерации тканей, клеточной дифференциации, эмбриональном развитии и регулировании иммунной системы. Воздействие TGF на клетки в культуре приводит к сверхпролиферации клеток и их перерастанию. TGF-бета сигнальные пути вовлечены в патогенез преэклампсии [29]. TGF-бета-рецептор (TGFBR1) активизирует транскрипционные регуляторы SMAD-типа. Активин рецептор-подобный белок 1 (ACVRL1) связывает и TGF-бета, и активин и необходим для развития артерий и вен. Серин/треонинпротеинкиназы типа WNK модулируют сигнальные пути типа SMAD.</p>
<p class="x-podzag-"><b>Терапевтическое применение органических солей магния</b></p>
<p class="x-text">Как показывают приведенные выше результаты систематического анализа, магний оказывает разностороннее воздействие на метаболизм, структуру и функцию сердца и всей ССС. С учетом того, что дефицит магния встречается с частотой 30–50% случаев в различных популяциях, становится очевидным, что у значительного количества пациентов с заболеваниями ССС будет наблюдаться определенная степень дефицита магния. Соответственно многие из рассмотренных выше молекулярных функций будут нарушены, что приведет к увеличению риска, например, инфаркта миокарда. Постинфарктное восстановление функционального состояния сердечной мышцы также будет затруднено при дефиците магния (вследствие дисбаланса апоптоза и пролиферации, ослабленной структуры соединительной ткани и т.д.).</p>
<p class="x-text">При коррекции дефицита магния необходимо учитывать его биодоступность в различных препаратах и содержание в продуктах питания. Наилучшей биодоступностью обладает магний из натуральных источников – овощей, фруктов, орехов и т.д. Однако восполнение магниевого дефицита при заболеваниях ССС не может проводиться только за счет коррекции диеты. Фармакологическая поддержка магниевыми препаратами чрезвычайно важна. Препараты неорганического магния, такие как магния сульфат, обладают крайне низкой биодоступностью магния и рядом выраженных побочных эффектов [1]. Использование препаратов магния II поколения, основанных на органических солях магния и обладающих высокой биодоступностью, наиболее перспективно. Одним из таких препаратов является Магнерот – соль магния и оротовой кислоты. Оротовая кислота – один из продуктов биосинтеза пиримидинов. В организме человека оротовая кислота (рис. 7) синтезируется в печени из аспартата и карбамоилфосфата при условии физиологического состояния гепатоцитов. Пероральный прием оротовой кислоты рекомендуется после хирургических операций на сердце [30].</p>
<p class="x-text">В фармакологии соли оротовой кислоты используются в качестве переносчика минералов, поскольку оротовая кислота повышает клеточную биодоступность катионов и имеет ряд дополнительных преимуществ по сравнению с неорганическими солями. Например, препарат Магнерот (оротат магния) не вступает в реакцию с хлористоводородной кислотой в желудке и не оказывает слабительного действия. Показана эффективность оротата магния при состояниях, сопровождающихся дефицитом магния, в том числе у больных, подвергшихся коронарной хирургии [31–33]. Оротат оказывает антиаритмическое, сосудорасширяющее и кардиопротекторное воздействие. Повышая устойчивость кардиомиоцитов к ишемии, оротат магния благоприятно влияет на клиническое течение инфаркта миокарда и сердечной недостаточности [34].</p>
<p class="x-text">Повышение концентрации оротата в результате приема солей оротовой кислоты значительно увеличивает концентрацию уридинмонофосфата, уридиндифосфата и уридинтрифосфата. Эти три уридинфосфата, возможно, и являются сигнальными молекулами, опосредующими положительное воздействие оротата на ССС. Они обладают значительным кардиопротекторным действием, особенно в раннем периоде острой ишемии [35, 36]. Наиболее вероятно, что физиологическое действие уридинфосфатов осуществляется через пуринергические рецепторы, которые вовлечены в вазореактивные реакции, апоптоз и секрецию цитокинов. Подобно адренергическим и аденозиновым рецепторам, пуринергические рецепторы активируют G-белки, а через них – внутриклеточные магнийзависимые аденилатциклазы (рис. 8) [37, 38], которые обсуждались выше.</p>
<p class="x-text">Эксперименты показывают, что оротовая кислота и оротат магния (на примере препарата Магнерот) способствуют улучшению липидного профиля (соотношение липопротеинов низкой и высокой плотности) [39]. Действие оротовой кислоты на липиды опосредовано также скорее всего пуринергическими рецепторами, которые действуют на транскрипцию многих генов с помощью фосфорилирования транскрипционного регулятора CREB.</p>
<p class="x-text">Результаты исследований клинических применений препарата Магнерот подтверждают результаты фундаментальных исследований. Исследование, проведенное у 79 больных с тяжелой сердечной недостаточностью, получавших лечение оротатом магния, показало, что однолетняя выживаемость составила 76% по сравнению с 52% в группе плацебо [40]. Использование оротата магния увеличивает продолжительность физических нагрузок у больных ишемической болезнью сердца (ИБС) [41]. Прием препарата Магнерот у пожилых пациентов с ИБС улучшал параметры качества жизни и психоэмоционального статуса [42]. Позитивное влияние оротата магния в этих случаях может быть связано с коронарной вазодилатацией и повышением энергетического метаболизма кардиомиоцитов.</p>
<p class="x-text">В случае идиопатического пролапса митрального клапана, который часто рассматривается как разновидность дисплазии соединительной ткани, положительный эффект обеспечивается не только через вазодилатацию и улучшение энергетического метаболизма, но также за счет структурных изменений соединительной ткани. Систематическое использование препарата Магнерот оказалось эффективным при лечении детей с синдромом дисплазии сердечной соединительной ткани (в частности, пролапсом митрального клапана и аномальными сухожильными хордами) [43]. Исследование, включавшее 144 пациентов с идиопатическим пролапсом митрального клапана, показало, что использование оротата магния приводило к снижению максимального систолического и диастолического АД, а также среднего диастолического АД, снижению числа эпизодов тахикардии [44]. Шесть месяцев терапии полностью или частично уменьшают симптомы, сопутствующие пролапсу, более чем у половины пациентов [45].</p>
<p class="x-podzag-"><b>Заключение</b></p>
<p class="x-text">В данной работе проведен анализ молекулярных функций магнийзависимых белков тканей сердца. К соответствующим механизмам относятся, в частности, управление ионными каналами, регулировка уровней сигнальных молекул, гликолиз, везикулярный транспорт, внутриклеточная сигнализация от цитокинов, влияние на метаболизм соединительной ткани, апоптоз и деление клеток. Сформулированная обобщенная картина влияния магния на ССС на молекулярном уровне также позволяет выявить множественные механизмы, через которые осуществляется терапевтическое воздействие препаратов органического магния у пациентов с сердечно-сосудистыми заболеваниями. Восполнение дефицита магния посредством пищевых добавок или правильно сбалансированной диеты будет способствовать восстановлению нормального функционирования данных молекулярных каскадов, оказывая, таким образом, положительное влияние на ССС. В целом магний положительно воздействует на энергетический метаболизм, структуру соединительной ткани и сосудистый тонус, способствуя уменьшению уровня катехоламинов в плазме. Оротат магния, используемый как ион-переносчик магния, способствует активации пуринергических рецепторов, что приводит к вазодилатации и к позитивным изменениям липидного профиля. Таким образом, с физиологической точки зрения магний и оротат являются синергистами. На практике показано, что применение оротата магния в комплексной терапии положительно влияет на выживаемость и качество жизни пациентов с ишемической болезнью сердца.</p>
1. Torshin I.Yu., Gromova O.A. Magnesium and pyridoxine: fundamental studies and clinical practice // NY: Nova Science Publishers, Inc, 2009. 196 p.
2. Rubenowitz E., Molin I., Axelsson G. et al. Magnesium in drinking water in relation to morbidity and mortality from acute myocardial infarction // Epidemiology. 2000. Vol. 11. № 4. P. 416–421.
3. Booth J.V., Phillips-Bute B., McCants C.B. et al. Low serum magnesium level predicts major adverse cardiac events after coronary artery bypass graft surgery // Am. Heart J. 2003. Vol. 145. № 6. P. 1108–1113.
4. Tsuji H., Venditti F.J. Jr, Evans J.C. et al. The associations of levels of serum potassium and magnesium with ventricular premature complexes (the Framingham Heart Study) // Am. J. Cardiol. 1994. Vol. 74. № 3. P. 232–235.
5. Onalan O., Crystal E., Daoulah A. et al. Meta-analysis of magnesium therapy for the acute management of rapid atrial fibrillation // Am. J. Cardiol. 2007. Vol. 99. № 12. P. 1726–1732.
6. Joosten M.M., Gansevoort R.T., Mukamal K.J. et al. Urinary magnesium excretion and risk of hypertension: the prevention of renal and vascular end-stage disease study // Hypertension. 2013. Vol. 61. № 6. P. 1161–1167.
7. Qu X., Jin F., Hao Y. et al. Magnesium and the risk of cardiovascular events: a meta-analysis of prospective cohort studies // PLoS One. 2013. Vol. 8. № 3. e57720.
8. Qu X., Jin F., Hao Y. et al. Magnesium and the risk of cardiovascular events: a meta-analysis of prospective cohort studies // PLoS One. 2013. Vol. 8. № 3. e57720.
9. Schimpf R., Borggrefe M., Wolpert C. Clinical and molecular genetics of the short QT syndrome // Curr. Opin. Cardiol. 2008. Vol. 23. № 3. P. 192–198.
10. Sausbier M., Hu H., Arntz C. et al. Cerebellar ataxia and Purkinje cell dysfunction caused by Ca2+-activated K+ channel deficiency // Proc. Natl. Acad. Sci. USA. 2004. Vol. 101. № 25. P. 9474–9478.
11. Oudit G.Y., Sun H., Trivieri M.G. et al. L-type Ca2+ channels provide a major pathway for iron entry into cardiomyocytes in iron-overload cardiomyopathy // Nat. Med. 2003. Vol. 9. № 9. P. 1187–1194.
12. Antzelevitch C., Pollevick G.D., Cordeiro J.M. et al. Loss-of-function mutations in the cardiac calcium channel underlie a new clinical entity characterized by ST-segment elevation, short QT intervals, and sudden cardiac death // Circulation. 2007. Vol. 115. № 4. P. 442–449.
13. Priori S.G., Napolitano C., Tiso N. et al. Mutations in the cardiac ryanodine receptor gene (hRyR2) underlie catecholaminergic polymorphic ventricular tachycardia // Circulation. 2001. Vol. 103. № 2. P. 196–200.
14. Lehnart S.E., Mongillo M., Bellinger A. et al. Leaky Ca2+ release channel/ryanodine receptor 2 causes seizures and sudden cardiac death in mice // J. Clin. Invest. 2008. Vol. 118. № 6. P. 2230–2245.
15. Hymel L., Schindler H., Inui M. et al. Reconstitution of purified cardiac muscle calcium release channel (ryanodine receptor) in planar bilayers // Biochem. Biophys. Res. Commun. 1988. Vol. 152. № 1. P. 308–314.
16. Chugun A., Sato O., Takeshima H. et al. Mg2+ activates the ryanodine receptor type 2 (RyR2) at intermediate Ca2+ concentrations // Am. J. Physiol. Cell Physiol. 2007. Vol. 292. № 1. P. 535–544.
17. Pessah I.N., Stambuk R.A., Casida J.E. Ca2+-activated ryanodine binding: mechanisms of sensitivity and intensity modulation by Mg2+, caffeine, and adenine nucleotides // Mol. Pharmacol. 1987. Vol. 31. № 3. P. 232–238.
18. Redondo P.C., Salido G.M., Pariente J.A. et al. SERCA2b and 3 play a regulatory role in store-operated calcium entry in human platelets // Cell. Signal. 2008. Vol. 20. № 2. P. 337–346.
19. Louch W.E., Vangheluwe P., Bito V. et al. Phospholamban ablation in hearts expressing the high affinity SERCA2b isoform normalizes global Ca²+ homeostasis but not Ca²+-dependent hypertrophic signaling // Am. J. Physiol. Heart Circ. Physiol. 2012. Vol. 302. № 12. P. 2574–2582.
20. Collins T.P., Terrar D.A. Ca(2+)-stimulated adenylyl cyclases regulate the L-type Ca(2+) current in guinea-pig atrial myocytes // J. Physiol. 2012. Vol. 590. Pt 8. P. 1881–1893.
21. Zimmermann G., Zhou D., Taussig R. Mutations uncover a role for two magnesium ions in the catalytic mechanism of adenylyl cyclase // J. Biol. Chem. 1998. Vol. 273. № 31. P. 19650–19655.
22. Van Reeuwijk J., Maugenre S., van den Elzen C. et al. The expanding phenotype of POMT1 mutations: from Walker-Warburg syndrome to congenital muscular dystrophy, microcephaly, and mental retardation // Hum. Mutat. 2006. Vol. 27. № 5. P. 453–459.
23. Ishigaki K., Muto A., Osawa M. Clinical features and care of patients with congenital and childhood-onset myotonic dystrophy // Rinsho Shinkeigaku. 2012. Vol. 52. № 11. P. 1264–1266.
24. Itoh-Satoh M., Hayashi T., Nishi H. et al. Titin mutations as the molecular basis for dilated cardiomyopathy // Biochem. Biophys. Res. Commun. 2002. Vol. 291. № 2. P. 385–393.
25. Yang Y.C., Kao L.S. Regulation of sodium-calcium exchanger activity by creatine kinase // Adv. Exp. Med. Biol. 2013. Vol. 961. P. 163–173.
26. Грачева О.Н., Громова О.А. Дисплазия соединительной ткани во время беременности. М.: Миклош, 2012. 156 с.
27. Wilson F.H., Disse-Nicodeme S., Choate K.A. et al. Human hypertension caused by mutations in WNK kinases // Science. 2001. Vol. 293. № 5532. P. 1107–1112.
28. Alberts B., Johnson A., Lewis J. et al. Molecular Biology of the Cell 4th edition. NY: Garland Science, 2002.
29. Taki A., Abe M., Komaki M. Expression of angiogenesis-related factors and inflammatory cytokines in placenta and umbilical vessels in pregnancies with preeclampsia and chorioamnionitis/funisitis // Congenit. Anom. (Kyoto). 2012. Vol. 52. № 2. P. 97–103.
30. Шилов А.М., Святов И.С., Чубарев М.В. и др. Результаты применения магнийсодержащих препаратов для лечения и профилактики гипер- и дислипидемии // Клиническая медицина 1998. Т. 76. № 4. С. 35–37.
31. Salerno C., Crifo C. Diagnostic value of urinary orotic acid levels: applicable separation methods // J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 2002. Vol. 781. № 1–2. P. 57–71.
32. Motyl T., Krzeminski J., Podgurniak M. et al. Variability of orotic acid concentration in cow's milk // Endocr. Regul. 1991. Vol. 25. № 1–2. P. 79–82.
33. Classen H.G. Magnesium orotate – experimental and clinical evidence // Rom. J. Intern. Med. 2004. Vol. 42. № 3. P. 491–501.
34. Степура О.Б., Томаева Е.Е., Зверева Т.В. Оротовая кислота как метаболический агент // Вестник РАМН. 2002. № 2. С. 39–41.
35. Бульон В.В., Крылова И.Б., Родионова О.М. и др. Сравнительное изучение кардиопротекторных эффектов уридин-5'-монофосфата и уридин-5'-трифосфата на ранних сроках острой ишемии миокарда // Бюллетень экспериментальной биологии и медицины. 2007. Т. 144. № 9. С. 297–300.
36. Krylova I.B., Kachaeva E.V., Rodionova O.M. et al. The cardioprotective effect of uridine and uridine-5'-monophosphate: the role of the mitochondrial ATP-dependent potassium channel // Exp. Gerontol. 2006. Vol. 41. № 7. P. 697–703.
37. Wee S., Peart J.N., Headrick J.P. P2 purinoceptor-mediated cardioprotection in ischemic-reperfused mouse heart // J. Pharmacol. Exp. Ther. 2007. Vol. 323. № 3. P. 861–877.
38. Guns P.J., van Assche T., Fransen P. et al. Endothelium-dependent relaxation evoked by ATP and UTP in the aorta of P2Y2-deficient mice // Br. J. Pharmacol. 2006. Vol. 147. № 5. P. 569–574.
39. Jellinek H., Takacs E. Course of the progression of experimentally induced arteriosclerotic vessel wall changes after treatment with magnesium orotate // Arzneimittelforschun. 2000. Vol. 50. № 12. P. 1071–1077.
40. Stepura O.B., Martynow A.I. Magnesium orotate in severe congestive heart failure (MACH) // Int. J. Cardiol. 2009. Vol. 131. № 2. P. 293–295.
41. Geiss K.R., Stergiou N., Neuenfeld H.U. et al. Effects of magnesium orotate on exercise tolerance in patients with coronary heart disease // Cardiovasc. Drugs Ther. 1998. Vol. 12. Suppl. 2. P. 153–156.
42. Ezhov A.V., Pimenov L.T. Effect of adjuvant magnesium therapy on the quality of life and emotional status of elderly patients with stable angina // Adv. Gerontol. 2002. № 10. P. 95–98.
43. Домницкая Т.М., Дьяченко А.В., Куприянова О.О., Домницкий М.В. Клиническое применение магния оротата у подростков с синдромом дисплазии соединительной ткани сердца // Кардиология. 2005. Т. 45. № 3. С. 79–84.
44. Акатова Е.В., Суханова Е.Д., Мельник О.О. и др. Динамика показателей функционального состояния сердечно-сосудистой системы у больных с идиопатическим пролапсом митрального клапана на фоне терапии магнеротом и алпразоламом // Клиническая медицина. 2008. Т. 86. № 3. С. 55–58.
45. Шехтер А.Б., Мартынов А.И., Степура О.Б. и др. Новые подходы к лечению больных с идиопатическим пролабированием митрального клапана // Терапевтический архив. 2000. Т. 72. № 9. С. 67–70.
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.