О циркадианном ритме и хронофармакологии оротата магния
- Аннотация
- Статья
- Ссылки
- English
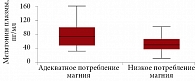
У здоровых добровольцев концентрация магния в крови снижается в ночное время (02.00–05.00) на фоне повышения экскреции магния с мочой. У пациентов с рядом патологий падение уровня магния в ночное время усиливается, что служит патогенетическим фактором обострения клинической картины заболевания в это время суток. У таких пациентов обосновано назначение препарата Магнерот в вечернее и ночное время.
У здоровых добровольцев концентрация магния в крови снижается в ночное время (02.00–05.00) на фоне повышения экскреции магния с мочой. У пациентов с рядом патологий падение уровня магния в ночное время усиливается, что служит патогенетическим фактором обострения клинической картины заболевания в это время суток. У таких пациентов обосновано назначение препарата Магнерот в вечернее и ночное время.

Введение
Выбор времени суток для приема препарата – важный хронофармакологический фактор, определяющий эффективность терапии. Например, снотворные препараты традиционно принимают перед сном, в вечерние часы [1]. У пациентов с утренней гипертензией эффективность ряда антигипертензивных средств, используемых в утренние часы, существенно снижена [2, 3]. Бронходилататоры пролонгированного действия, предназначенные для лечения астмы, наиболее эффективны при приеме вечером для поддержания легочной функции утром [4].
Указанные хронофармакологические эффекты лекарственных средств обусловлены тем, что каждая из 12 систем организма человека характеризуется уникальным циркадианным (суточным) ритмом, обычно тесно связанным с ритмом сна и бодрствования. Примером ярко выраженного циркадианного ритма служит температурный ритм: во время ночного сна температура тела опускается в среднем на 0,3–0,5 °С (вследствие замедления энергетических процессов организма). Кроме того, в эти часы замедляется ритм дыхания, уменьшается частота сердечных сокращений (ЧСС) и др. Состояние циркадианных «молекулярных часов» кардиомиоцитов является важным фактором сердечно-сосудистого здоровья [5]. С точки зрения фармакокинетики и фармакодинамики особенно важны циркадианные ритмы:
1) абсорбции лекарственных средств в желудочно-кишечном тракте;
2) изменений уровней белков-рецепторов препаратов (так называемых таргетных белков);
3) уровней белков, связывающих лекарственные средства при переносе в крови;
4) уровней печеночных ферментов, участвующих в метаболизме лекарственных средств (в частности, уровней различных цитохромов Р450);
5) клиренса препаратов и их метаболитов [6].
Циркадианные ритмы активности систем органов определяют не только эффективность воздействия фармакологических препаратов, но и интенсивность проявления патологических состояний. Так, гипертонические кризы чаще отмечаются утром – после пробуждения [2, 7]. Как правило, пик кожного зуда приходится на период с 18.00 до 21.00. Суточная статистика родов также указывает на циркадианные эффекты: число родов значительно выше в ночное время, число патологических родов (например, дискоординация и задержка родовой деятельности) несколько выше в дневные часы [8].
Приступы бронхиальной астмы чаще возникают в ночное время, с пиком в 04.00 [4]. Снижение запаса магния в депо организма наряду с нарушениями ритма циркадианных часов стимулирует обострение астмы. Приступы астмы ночью, когда уровень магния в крови снижается вследствие циркадианных колебаний, имеют место более чем у 60% больных астмой [9].
Воспалительные процессы и болевой синдром при системном заболевании суставов (ревматоидный артрит) заметно усиливаются в вечерние часы и достигают пика ночью [10], что приводит к утренней скованности. Частота развития инфаркта миокарда в ночные часы в три-четыре раза превышает частоту возникновения инфаркта в дневное время [11]. Судороги икроножных мышц и аритмия по типу «пируэт» также возникают преимущественно в ночное время [12].
При изучении циркадианных ритмов одним из наиболее перспективных направлений является исследование циркадианных вариаций уровней макро- и микроэлементов в крови [13]. В частности, уровень магния в крови является одним из фундаментальных факторов электролитного баланса, определяющих развитие хронических заболеваний [14].
Как показали результаты клинических исследований, существует циркадианный ритм концентраций магния в крови с достоверным минимумом ночью – 02.00–05.00 [13, 15]. На этот же период времени приходится большая частота и тяжесть приступов бронхиальной астмы, развития инфаркта миокарда, судорог икроножных мышц, аритмий, сочетающихся с ночным дефицитом магния.
Клинические исследования циркадианных ритмов магния у здоровых добровольцев
Клинические исследования позволили установить наличие циркадианных ритмов магния в плазме крови, моче, слюне и других биосубстратах. Анализ изменчивости концентраций магния в плазме крови индивидуальных пациентов показал достаточно резкие изменения концентраций между 07.00 и 10.00, а также между 10.00 и 22.00 (р < 0,001) [16].
Циркадианные изменения уровня магния в сыворотке крови ассоциированы с циркадианными колебаниями уровней кальция и ряда микроэлементов в сыворотке крови и моче. Образцы крови и мочи собирались каждые три часа в течение суток у здоровых мужчин (n = 11) в возрасте 41–60 лет. Достоверный циркадианный ритм установлен для концентраций Mg, Ca и микроэлементов Cu, Zn, Fe, Cr в сыворотке крови и для концентраций Mg, Ca, Cu, Zn и Cr в моче. Наибольшая экскреция магния и других элементов приходилась на ночной период [13].
Установлены возрастные особенности циркадианных ритмов магния в сыворотке крови. Пациенты разных возрастных групп (от 20 до 90 лет) были синхронизированы по времени дневной деятельности (07.00–21.00) и ночного отдыха. Венозная кровь отбиралась с четырехчасовым интервалом в определенные часы (07.45, 11.45, 15.45, 19.45, 23.45, 03.45) в течение 24 часов. Амплитуда циркадианного ритма уровней магния у пожилых мужчин (60–90 лет) была выше, чем у более молодых. Пик концентрации магния в сыворотке приходился на 11.40 у пожилых лиц и на 16.40 у молодых [17]. С учетом того, что магний необходим для поддержания синтеза аденозинтрифосфата, активности нейромедиаторов, сохранение высоких уровней магния в крови у более молодых пациентов в течение всего рабочего дня (почти до 17.00) соответствует более высокой работоспособности.
Циркадианный ритм концентрации магния в сыворотке и плазме крови может существенно отличаться от такового у здоровых мужчин и женщин молодого и среднего возраста. Результаты измерения суточных колебаний уровня магния в сыворотке крови у здоровых лиц (n = 20) показали, что концентрации магния у мужчин изменялись от более низких значений (0,81 ± 0,04 ммоль/л) утром (08.00) к более высоким (1,03 ± 0,08 ммоль/л) вечером (18.00). У женщин наблюдались два пика концентрации магния сыворотки: первый пик (0,99 ± 0,10 ммоль/л) – около 20.00, второй (0,98 ± 0,09 ммоль/л) – рано утром (04.00). Самые низкие уровни магния (0,79 ± 0,04 ммоль/л) отмечались в полдень [18].
Суточные вариации уровней магния и других электролитов в моче существенно превосходят таковые в сыворотке или плазме крови [19]. Именно циркадианный ритм обусловливает низкую степень корреляции между уровнями магния в суточной моче и образцах мочи, собранных в утреннее время [20].
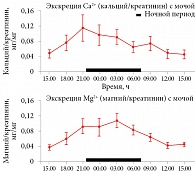
У здоровых детей в возрасте от четырех до 15 лет (n = 220) пик экскреции магния и кальция приходится на ночное время [21]. Анализ суточной экскреции кальция, магния и фосфора у здоровых детей (n = 9, мальчики 10–11 лет) указал на достоверные различия между дневными (07.00–21.00) и ночными (21.00–07.00) уровнями экскреции магния (р < 0,001), кальция (р < 0,05), фосфора (p < 0,01), а также на более высокую экскрецию ночью [22]. Среднесуточное значение отношения «магний/креатинин» составило 0,069 ± 0,008 мг/мг, а вариации амплитуды отношения – 0,042 ± 0,006. Пик экскреции магния отмечался в 01.55 (01.24–02.15), пик экскреции кальция – в 23.40 (22.15–00.00) (рис. 1).
Суточная экскреция магния у здоровых детей в возрасте от трех до десяти лет (n = 10) составила 2,82 ± 0,79 мг/кг/сут. Минимальный разброс значений наблюдался во вторых образцах утренней мочи, взятых между 07.00 и 10.00. Зафиксирована достоверная корреляция между циркадианными ритмами соотношений «кальций/креатинин» и «магний/креатинин» (коэффициент корреляции 0,71). Пик экскреции магния приходился на ночные часы (20.00–04.00) [23].
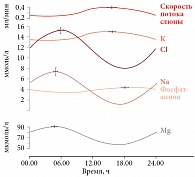
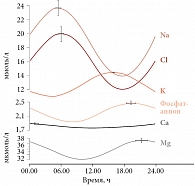
Циркадианный ритм магния также изучали посредством анализа его концентраций в слюне как при естественной, так и вынужденной секреции (с использованием капель лимонного сока). Статистическую значимость существования циркадианного ритма оценивали с помощью статистического теста Рэлея, показывающего, насколько случайно пики концентраций распределены в течение суток. Установлены циркадианные ритмы концентраций магния, натрия, калия, хлорида и фосфата в слюне [24]. На рис. 2 и 3 приведены синусоидальные аппроксимации циркадианных ритмов исследуемых электролитов в слюне, которые были достоверны по тесту Рэлея для группы в целом.
Установлено существование циркадианных ритмов магния и в других биосубстратах. В частности, концентрации магния и цинка в материнском молоке (первый – шестой месяцы лактации) проявляют значительные циркадианные колебания. Амплитуда суточных колебаний составляет 17% среднесуточного значения концентрации магния и 48% среднесуточного значения концентрации цинка. Независимо от изменчивости концентраций магния его содержание в образце молока, полученном с 10.00 до 14.00, коррелирует со среднесуточным значением концентрации [25].
Молекулярно-физиологические механизмы, относящиеся к циркадианным эффектам магния
Вопрос, каким образом формируется циркадианный ритм магния, остается открытым. С одной стороны, известно, что в организме здорового человека циркадианный паттерн внеклеточного магния не модулируется гормональными механизмами, регулирующими концентрацию глюкозы [26]. С другой стороны, многочисленные биохимические и гормональные факторы способны оказывать существенное влияние на уровни магния в биосубстратах. Например, предсердный натрийуретический фактор вызывает увеличение экскреции натрия, хлорида, магния и кальция и воздействует на суточные ритмы этих электролитов [27]. Дотации лития тормозят биохимические циркадианные ритмы концентраций пролактина, паратгормона, кортикостерона, альдостерона, кальция, магния в сыворотке крови [28], повышают уровни Mg2+ в плазме крови на фоне инактивации норадреналина [29].
В то же время результаты фундаментальных исследований показывают, что магний имеет принципиальное значение для функционирования циркадианных часов, расположенных в супрахиазматическом ядре (СХЯ) переднего отдела гипоталамуса. Циркадианные часы в СХЯ синхронизируют суточные ритмы с циклом «свет – темнота». Этот процесс синхронизации опосредован, в частности, глутаматергическими синапсами между ганглиями сетчатки и нейронами СХЯ. Блокировка ионом Mg2+ всех типов субъединиц NMDA-рецептора – NR2A, NR2B, NR2C и NR2D, расположенных на нейронах СХЯ, стимулирует сдвиг акрофазы циркадианного цикла организма при синхронизации со световым циклом [30].
При синхронизации циркадианного и светового цикла NMDA-рецепторы в ответ на воздействие света стимулируют увеличение внутриклеточной концентрации Са2+ в нейронах. Циркадианные изменения в уровнях Ca2+ в СХЯ опосредуются ГАМК-рецепторами (гамма-аминомасляная кислота) и Mg-зависимыми NMDA-рецепторами нейронов ядра [31].
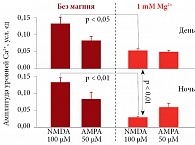
В эксперименте увеличение уровней Ca2+, обусловленное NMDA (агонист NMDA-рецепторов), было значительно снижено в среде с 1 ммоль/л Mg2+ как в течение дня (-59%, р < 0,05), так и в течение ночи (-79%, p < 0,01). Важный момент: при Mg-дефицитных условиях интенсивность реакции нейронов (секреция Ca2+) на стимуляцию NMDA или АМРА не зависела от времени суток. Однако при концентрации 1 ммоль/л Mg2+ в среде уровни секретируемого Ca2+ днем достоверно выше (в 1,9 раза), чем ночью (p < 0,05) (рис. 4) [31].
Mg-зависимые NMDA-рецепторы необходимы для поддержания ритма циркадианных часов, формируемых, в частности, дофаминергическими нейронами гипоталамуса. Дофаминергические нейроны проявляют два функционально различных режима электрофизиологической активности: низкочастотный (стимулируется активацией AMPA-рецепторов) и высокочастотный (стимулируется активацией NMDA-рецепторов). Механизм действия NMDA-рецепторов на дофаминергические нейроны основан на уменьшении амплитуды колебаний концентрации ионов Са2+ за счет частичного блокирования ионами Mg2+ канала NMDA-рецептора, что определяет свойство последнего включать высокочастотный режим работы дофаминергического нейрона [32].
Ионы Mg2+ являются естественным антагонистом NMDA-рецепторов и агонистом ГАМК-рецепторов и необходимы для поддержания циркадианного цикла «сон – бодрствование». ГАМК считается важным тормозящим нейромедиатором. ГАМКергические синапсы СХЯ проявляют циркадианный ритм изменений синаптической пластичности [33].
Во время ночного сна (22.00–07.00) ионы Mg2+ снижают секрецию адренокортикотропного гормона, повышают мощность сигнала ЭЭГ в диапазоне частот (11,0–12,9 Гц), который соответствует сигма-ритму – одному из основных и наиболее четко выраженных элементов спонтанной ЭЭГ, регистрируемой в состоянии естественного физиологического сна, без изменений в интенсивности дельта-волн. Полученные данные согласуются с данными о том, что Mg2+ проявляет ГАМК-агонистические и NMDA-антагонистические эффекты [34].
Особое значение имеют взаимодействия магния и гормона сна – мелатонина. Рецепторы мелатонина в СХЯ характеризуются различной чувствительностью к катионам: Са2+ способствует связыванию мелатонина рецептором, Na+ вызывает дозозависимое снижение связывания мелатонина, а Mg2+ противодействует эффектам Na+ и частично восстанавливает связывание мелатонина рецепторами [35]. Таким образом, обеспеченность ионами магния – одно из условий физиологического сна.
Магний, мелатонин и циркадианный ритм «сон – бодрствование»
Между мелатонином и магнием существуют двунаправленные взаимодействия. Мелатонин секретируется шишковидной железой, магний играет важную роль в росте и развитии этого органа. И наоборот, уровни магния снижаются при нарушении функции эпифиза [36].
Магний стимулирует повышение активности серотонин-N-ацетилтрансферазы, фермента биосинтеза мелатонина, который катализирует ацетилирование N-серотонина в N-ацетилсеротонин. Следовательно, дефицит магния в диете приводит к снижению биосинтеза мелатонина.
В эксперименте Mg-дефицитная диета (150 ppm магния, четыре недели) приводила к значительному снижению уровней мелатонина плазмы животных (50 ± 6,4 пг/мл) по сравнению с Mg-адекватной диетой (1000 ppm, 75 ± 6,6 пг/мл, р = 0,01) (рис. 5) [37].
Заметим, что индуцированное светом подавление синтеза мелатонина за счет ингибирования серотонин-N-ацетилтрансферазы опосредуется Mg-зависимыми NMDA-рецепторами [38].
Ответ синтеза/секреции мелатонина в шишковидной железе на уровни магния зависит от стадии циркадианного цикла. В эксперименте перфузия шишковидных желез с физиологическими концентрациями кальция (5,2 ммоль/л) и магния (1,34 ммоль/л) в состоянии, соответствовавшем середине темного периода, приводила к стимуляции синтеза мелатонина. Между тем в течение светового периода эффектов воздействия магния на синтез мелатонина не наблюдалось [39].
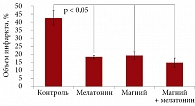
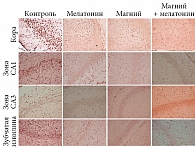
И магний, и мелатонин характеризуются цитопротекторными свойствами. И тот и другой проявляют нейропротекторные эффекты на модели неонатальной ишемии головного мозга. По сравнению с плацебо объем инфаркта мозга значительно снижается на фоне применения магния, мелатонина или их комбинации (рис. 6). Кроме того, анализ иммуногистологических маркеров апоптоза (окрашивание TUNEL и окрашивание на проапоптотический фермент каспазу-3) (рис. 7) показал заметное снижение числа апоптотирующих нейронов на единицу площади в коре, зонах СА1, СА3 и зубчатой извилине гиппокампа (рис. 8) [40].
На фоне дефицита магния повышенная концентрация мелатонина в дневное время оказывает парадоксальное эпилептогенное действие на гиппокамп. Так, при низком уровне Mg2+
мелатонин в физиологической концентрации
10 нМ/л не влияет на эпилептическую активность. Однако при концентрации 1000 нМ/л мелатонин увеличивает эпилептическую активность на 140% в течение дня, но не ночью [41]. Мелатонин также снижает эпилептиформную активность в лобных долях, провоцируемую глубоким дефицитом магния. Частота возникновения эпилептиформных сигналов уменьшается в два раза при использовании мелатонина (10–100 нмоль/л) [42].
Цитопротекторные и другие эффекты мелатонина и магния не являются полностью эквивалентными. Например, мелатонин не защищает гранулярные нейроны мозжечка в культуре от глутаматной эксайтотоксичности. Магний, наоборот, ингибирует чрезмерную активность NMDA-рецепторов, обеспечивая защиту от глутаматной нейротоксичности [43].
Клинические результаты подтверждают данные фундаментальных исследований о взаимосвязи между магнием и мелатонином. Ежедневный прием препарата магния (500 мг/сут) в течение восьми недель приводит к статистически значимому увеличению общей продолжительности сна (p = 0,002), улучшению его качества (p = 0,03), возрастанию концентрации мелатонина (p = 0,007) и кортизола (p = 0,008) в сыворотке крови [44].
Пероральный прием смеси магния и мелатонина улучшает состояние пожилых пациентов, страдающих бессонницей
(n = 43, возраст 78,3 ± 3,9 года). Эффективность смеси 5 мг мелатонина, 225 мг магния и 11 мг цинка в 100 г грушевого сока, применявшейся в течение восьми недель за час перед сном, сравнивали с эффектом плацебо (100 г сока). Качество сна оценивали по шкале Pittsburgh (PSQI), Leeds (LSEQ), качество жизни – по шкале SF-36. Эффективность смеси магния и мелатонина превысила таковую плацебо согласно оценке пациентов по шкале PSQI (+6,8; 95%-ный доверительный интервал 5,4–8,3; p < 0,001), легкости засыпания (р < 0,001), качества сна (р < 0,001), сниженной трудности при пробуждении (р = 0,005), общего времени сна (р < 0,001) и баллу по шкале SF-36 (р = 0,006) [45].
Обратите внимание: средняя точка сна (точка времени в середине между засыпанием и пробуждением, соответствующая, как правило, максимальной секреции мелатонина) зависит от обеспеченности организма магнием. В клинико-эпидемиологическом исследовании с участием 3304 студенток (будущих диетологов) в возрасте 18–20 лет из 53 учебных заведений Японии потребление магния оценивали по дневнику диеты. Риск сдвига средней точки сна в более поздний период времени снижался при более высоком потреблении белка, магния, калия, кальция, а также ряда витаминов (А, D, В1, В2, В6, В9). Более высокий риск «запоздалой» средней точки сна ассоциировался с повышенным потреблением алкоголя, жиров, кондитерских изделий и мяса в течение дня [46].
Двунаправленность взаимодействий между циркадианным ритмом, уровнями мелатонина и магния в плазме крови указывает на важные аспекты компенсации дефицита магния. Так, уровни магния в крови непосредственно влияют на циркадианный ритм, регулируемый СХЯ гипоталамуса и шишковидной железой. В то же время нарушения циркадианных часов усиливают потери магния организмом. Поэтому коррекция циркадианных часов (например, с помощью фототерапии или, наоборот, посредством максимально возможного снижения освещенности ночью) [47] может быть важным компонентом для компенсации недостаточности магния [9].
Циркадианные ритмы магния и сердечно-сосудистая система
Как в дневное, так и в ночное время сниженные уровни магния в плазме крови и эритроцитах ассоциированы с повышенным артериальным давлением (АД), воспалением эндотелия и эндотелиальной дисфункцией, инсулинорезистентностью, воспалением и атеросклерозом сосудов, повышенным общим периферическим сопротивлением сосудов, снижением сердечного выброса [48], а также с более высокой инцидентностью аритмии, тахикардии и инфаркта миокарда [14, 49].
Влияние факторов риска смертности от ишемической болезни сердца (АД, свертываемость крови, аритмия и др.) усиливается в ночное время. Результаты клинических исследований с участием взрослых здоровых добровольцев продемонстрировали снижение ЧСС и АД в ночные часы. Минимальные значения гематокрита и вязкости крови наблюдаются между 24.00 и 04.00, уровня общего белка – в 04.00, магния и кальция – с 02.00 до 04.00. Уровни кортикостероидов в плазме крови достигают пикового значения незадолго до пробуждения пациентов [50]. Увеличение внезапной сердечной смерти у пациентов с утренней гипертонией связано с увеличением частоты желудочковых аритмий, обусловленных в свою очередь циркадианными колебаниями уровня магния в крови [51]. Заметим, что аритмия беременных и внезапная смерть новорожденных возникают преимущественно в ночное время [52].
Патофизиологические факторы формирования острого инфаркта миокарда также включают циркадианные эффекты. В частности, лишение сна (очевидное нарушение циркадианного ритма, приводящее к сильному стрессу и формированию глубокого дефицита магния) достаточно частая причина инфаркта миокарда. Так, хроническое недосыпание отмечается у 27% пациентов с острым инфарктом миокарда. Данные клинических исследований показали, что частота случаев острого инфаркта миокарда выше в первой четверти суток (когда активность парасимпатической ветви нейрогуморальной регуляции быстро снижается, активность симпатической нервной системы возрастает, уровни магния в крови достигают низких значений) [53].
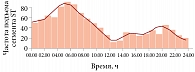
При спонтанной стенокардии (стенокардия Принцметала, вариантная стенокардия) отмечается переходный подъем сегмента ST на ЭКГ во время приступа боли. Ишемические эпизоды спонтанной стенокардии проявляют циркадианную изменчивость и часто наблюдаются с полуночи до раннего утра (рис. 9). Спазм коронарных артерий – основной механизм формирования ишемических эпизодов при вариантной стенокардии. Патогенетическими факторами формирования спазма коронарных артерий являются недостаточная секреция оксида азота (NO) при дисфункции эндотелия сосудов, повышение окислительного стресса и хроническое воспаление эндотелия, усиленная сократимость гладкой мускулатуры сосудов при дефиците магния [54].
Колебания концентрации внутриклеточного Mg2+ ассоциированы со спонтанными ритмическими сокращениями кардиомиоцитов [55]. Это обусловлено тем, что магний участвует в циркадианной регуляции плотности бета-адренорецепторов и активности аденилатциклаз (ферментов биосинтеза циклического аденозинмонофосфата, цАМФ) в кардиомиоцитах. Плотность бета-1-адренорецепторов в желудочках сердца претерпевает существенные циркадианные изменения с пиками в середине светлого и темного периода. Плотность бета-адренорецепторов 2-го подтипа не проявляет циркадианной ритмичности. Стимуляция активности аденилатциклаз, что указывает на передачу сигнала от бета-1-адренорецепторов, происходит в начале светлого и темного периода, за шесть часов до формирования пика плотности бета-1-рецепторов. Инициация синтеза цАМФ посредством аденилатциклаз невозможна без взаимодействия между адренорецепторами и G-белками. Подобное взаимодействие опосредуется ионами Mg2+. Кроме того, ионы Mg2+ необходимы для реализации каталитической активности аденилатциклаз. Таким образом, циркадианные изменения концентрации Mg2+ в крови могут регулировать активность аденилатциклаз, активируемых бета-1-адренорецепторами [56].
Заключение
Как показывает клиническая практика, назначение препаратов с учетом циркадианного ритма (асимметричное дозирование) позволяет достичь более высокой эффективности лечения, снизить побочные эффекты и дозу препаратов (например, снотворных, противовоспалительных, бронходилататоров) [3].
При назначении препаратов магния (например, препарат Магнерот, магния оротат) целесообразно учитывать циркадианный ритм индивидуального пациента. В терапии и акушерстве для перорального приема используются органические соли магния, характеризующиеся высокой биодоступностью и минимумом побочных эффектов. Как правило, препараты магния принимают три-четыре раза в день (например, первая таблетка – в 08.00, вторая – в 12.00, третья – в 16.00, четвертая – в 20.00). Очевидно, что такой прием не учитывает циркадианный ритм с акрофазой в дневное время и батифазой – в ночное.
Вместе с тем асимметричное дозирование препарата Магнерот может существенно оптимизировать магниевую терапию у пациентов с обострением симптомов заболевания в ночное время. Например, согласно инструкции по применению, Магнерот рекомендуется применять по две-три таблетки вечером при ночных судорогах икроножных мышц. Скорее всего такой режим приема будет способствовать сглаживанию падающей циркадианной кривой концентрации магния в ночное время, когда клинические проявления магниевого дефицита и гипомагнеземии наиболее ярки.
Действующее вещество препарата Магнерот – магния оротат. В фармакологии соли оротовой кислоты используются в качестве переносчика минералов, поскольку оротовая кислота повышает клеточную биодоступность катионов и имеет ряд дополнительных преимуществ по сравнению с неорганическими солями.
Во-первых, оротовая кислота – эндогенный метаболит человека. В организме человека она синтезируется в печени из аспартата и карбамоилфосфата и является важным продуктом метаболизма пиримидиновых нуклеотидов.
Во-вторых, оротовая кислота поддерживает функцию миокарда. Пероральный прием оротовой кислоты часто рекомендуется после хирургических операций на сердце. Наиболее вероятным механизмом кардиотропного действия оротовой кислоты/оротата является увеличение синтеза уридинмонофосфата и других уридинфосфатов. Уридинфосфаты – сигнальные молекулы, взаимодействующие с пуринергическими рецепторами. Активация этих рецепторов приводит к вазодилатации, позитивным изменениям липидного профиля и улучшению энергообеспечения кардиомиоцитов [57].
Циркадианные колебания оротовой кислоты детально не изучены. Тем не менее данные о метаболизме пиримидинов указывают на возможные циркадианные эффекты оротата. Так, доказано наличие внутрисуточных вариаций содержания различных пиримидинов в моче [58]. Существует циркадианный ритм уровней и активности ключевых ферментов метаболизма пиримидина и оротовой кислоты – оротат-фосфорибозилтрансферазы (EC 2.4.2.10), уридинфосфорилазы (2.4.2.3) и дигидроурацил-дегидрогеназы (1.3.1.2) [59]. Кроме того, установлены циркадианные ритмы колебаний интенсивности синтеза и деградации пиримидинов в печени [60]. Все эти данные фундаментальных исследований позволяют предположить существование циркадианных колебаний концентрации оротовой кислоты.
Назначение препарата Магнерот вечером или на ночь в количестве двух-трех таблеток позволит достичь более высокой эффективности при использовании стандартных препаратов для поддержания сердечно-сосудистой системы (сердечные гликозиды, антиаритмические препараты, ингибиторы ангиотензинпревращающего фермента,
блокаторы АТ1-рецепторов ангиотензина II и т.д.). Как следствие – имеет место более отчетливое купирование ночных обострений приступов стенокардии, подъема АД, приступов желудочковой аритмии, в том числе аритмии беременных, улучшение качества сна.
Магния оротат (препарат Магнерот) выравнивает циркадианный ритм сна и бодрствования, предупреждает удлинение сегмента QT в ночное время, гармонизирует взаимовлияния симпатическо-парасимпатической вегетативной нервной системы.
Многолетний практический опыт ночных дежурств кардиологов, акушеров-гинекологов, реаниматологов позволяет утверждать, что ночь – период обострений. Советский писатель-фантаст Иван Ефремов в романе «Час Быка» четко обозначил три-четыре часа предрассветного безвременья как временной порог, преодолеть который без энергии сложно. Любые назначения врачей и применение самых современных лекарственных средств без нормализации электролитного баланса магния, калия, кальция и микроэлементов будут либо недостаточны, либо безуспешны. Деформированный минеральный обмен не только вносит свой вклад в патогенез заболеваний, но и изменяет фармакокинетический
и фармакодинамический ответ на воздействие лекарственных средств. Магний относится к ключевым энергетическим биоэлементам, необходимым для синтеза аденозинтрифосфата.
O.A. Gromova, I.Yu. Torshin, A.G. Kalachyova, T.R. Grishina, Ye.Yu. Yegorova
Ivanovo State Medical Academy
Russian Joint Institute for Microelements, UNESCO
Moscow Institute of Physics and Technology
Contact person: Olga Alekseyevna Gromova, unesco.gromova@gmail.com
Here we present the results of analysis based of empirical data on circadian rhythm and chronopharmacology of magnesium, which is important to measure for conducting effective magnesium-based therapy. The results of clinical studies on circadian rhythm of magnesium concentration and corresponding molecular mechanisms, a link between levels of magnesium, melatonin and „sleep – wake“ cycle as well as between magnesium circadian rhythm and state of cardiovascular system.
In healthy volunteers concentration of magnesium in the blood declines at night time (02.00–05.00 am) accompanied by excretion of magnesium into urine. Patients with some pathologies were shown to have upregulated nocturnal decline in magnesium level which is a pathogenetic factor for exacerbations in clinical picture at this time of day. Such patients were justified to take drug Magnerot in the evening and at night.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.