Метилтетрагидрофолат – превосходная альтернатива фолиевой кислоте
- Аннотация
- Статья
- Ссылки
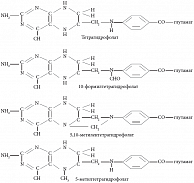
Фолатные коферменты в природе
Фолаты – соединения, которые включают около 10 разных форм витамина группы B [1]. Молекула любого соединения из этой группы содержит птеридиновое кольцо, парааминобензоатную группу, а также одну или несколько глутаминовых боковых цепей (рис. 1). У естественных форм витаминов группы B птеридиновое кольцо восстановлено до тетрагидрофолата – одного или с различными присоединенными к нему одноуглеродными группами, такими как формильная (-CHO), метиленовая (-CH2-), метенильная (-CH=) или метильная (-CH3). Единственным исключением является дигидрофолат, образующийся в результате действия фермента тимидилат-синтазы. Дигидрофолат участвует в превращении основания урацил (входит в состав рибонуклеиновой кислоты (РНК)) в основание тимин (входит в состав дезоксирибонуклеиновой кислоты (ДНК)). Во всех клетках к фолатам присоединены не один, а несколько глутаминовых боковых цепей, связанных друг с другом посредством гамма-карбоксильной группы. Во время всасывания в кишечнике эта полиглутаматная цепь удаляется ферментом глутамилкарбоксипептидазой (конъюгазой), который присутствует в щеточной кайме клеток слизистой оболочки двенадцатиперстной кишки. Данный фермент превращает все естественные фолаты полиглутаматы в фолаты моноглутаматы.
Всасывание фолатов из кишечника
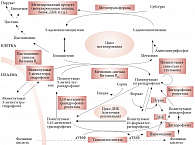
Фолаты моноглутаматы, например, тетрагидрофолат, 10-формилтетрагидрофолат и 5-метилтетрагидрофолат, абсорбируются в кишечнике и поступают в кровь только в виде 5-метилтетрагидрофолата, который проникает в клетки посредством эндоцитоза при участии специфических фолатных рецепторов [2]. Скорее всего, поглощение этого кофермента клетками происходит посредством пассивной, или облегченной, диффузии. В клетке есть только один фермент, который использует 5-метилтетрагидрофолат в качестве субстрата, – витамин-B12-зависимый фермент метионин-синтаза. Данный фермент является частью цикла метилирования (рис. 2). Его роль заключается в повторном метилировании гомоцистеина в метионин, который затем активируется аденозинтрифосфатом (АТФ) с целью продуцирования S-аденозилметионина (САМ). Данная форма метионина, иногда называемая «активным метионином», является донором метила для ряда метилтрансфераз, присутствующих во всех клетках. Эти метилтрансферазы метилируют широкий спектр разнообразных субстратов, включающий гормоны (например, допамин); липиды (например, фосфатидилэтаноламин) и белки (например, основной белок миелина).
Клетки используют реакцию метионин-синтазы для удержания 5-метилтетрагидрофолата [3]. 5-метилтетрагидрофолат – это слабый субстрат для полиглутамат-синтазы, но после действия на него данного фермента в процессе цикла метилирования он превращается в тетрагидрофолат. Этот кофермент, а также другие восстановленные однозамещенные фолаты (например, 10-формилтетрагидрофолат) являются хорошими субстратами для полиглутамации [3]. Таким образом, после того как 5-метилтетрагидрофолат моноглутамат метаболизируется до тетрагидрофолата моноглутамата, он становится полиглутаматом и будет удержан клеткой.
Решающим фактором для использования метионин-синтазой нового захваченного 5-метилтетрагидрофолата моноглутамата является его концентрация относительно концентрации полиглутамата метилтетрагидрофолата, уже присутствующего в клетке. Метионин-синтаза может использовать как моноглутаматную форму, так и полиглутаматную форму 5-метилтетрагидрофолата. Чаще всего в клетках, насыщенных фолатами, концентрация полиглутамата выше, а концентрация моноглутамата ниже, следовательно, очень небольшая часть моноглутамата преобразуется в тетрагидрофолат и удерживается в клетке, а непреобразованный моноглутамат покидает клетку путем диффузии. Однако если в клетках количество фолатов уменьшается и концентрация клеточных фолатов полиглутаматов относительно фолатов моноглутаматов снижается, то метионин-синтаза, используя все больше 5-метилтетрагидрофолата моноглутамата, трансформирует его в тетрагидрофолат моноглутамат и в 10-формилтетрагидрофолат моноглутамат.
Поскольку тетрагидрофолат моноглутамат и 10-формилтетрагидрофолат моноглутамат являются хорошими субстратами для полиглутамат-синтазы, они превращаются в полиглутаматы и удерживаются в клетках. По мере того как эти коферменты подвергаются полиглутамации и удерживаются в клетках, они вновь преобразуются в 5-метилтетрагидрофолаты полиглутаматы, которые все больше конкурируют за метионин-синтазу с новыми захватываемыми 5-метилтетрагидрофолатами моноглутаматами. Когда в клетках наступает состояние насыщения фолатами, они удерживают все меньше и меньше недавно захваченного 5-метилтетрагидрофолата. В результате клеткам нужно захватывать и удерживать больше фолатов из-за их дефицита. Кроме того, при делении клеток дочерние клетки имеют половину от исходной концентрации фолатов, которая была в родительских клетках. Это приводит к более низкой, чем оптимальная, концентрации доступного для метионин-синтазы 5-метилтетрагидрофолата полиглутамата. Следовательно, метионин-синтаза будет использовать 5-метилтетрагидрофолат моноглутамат, захваченный из циркулирующей плазмы. Поскольку он превращается в тетрагидрофолат и удерживается, концентрация фолатов в клетке начинает повышаться.
Концентрация 5-метиотетрагидрофолата также растет, поэтому все меньше и меньше моноглутамата используется метионин-синтазой и удерживается. Другим фактором, который влияет на конечную концентрацию моноглутамата, удерживаемого в клетках, является концентрация 5-метилтетрагидрофолатов моноглутаматов в плазме. Чем выше эта концентрация, тем выше концентрация моноглутамата в клетках и тем больше шансов, что он будет использован метионин-синтазой и, таким образом, удержан.
Поглощение фолиевой кислоты клетками
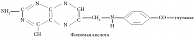
Фолиевая кислота, впервые выделенная из листьев шпината (от лат. folium – лист) [4], представляет собой синтетическую форму витамина группы В (рис. 3) и отличается от естественных фолатов невосстановленным птеридиновым кольцом. Из клеток можно выделить очень небольшое количество фолиевой кислоты, все клеточные формы витамина находятся в восстановленном состоянии по типу тетрагидро- или дигидро- (рис. 1). В настоящее время признано, что фолиевая кислота получается в результате окисления некоторых естественных тетрагидрофолатов in vitro. Синтетическая фолиевая кислота, поступающая в организм в виде принимаемой добавки или вместе с обогащенным ею пищевым продуктом, может превращаться, как и другие фолаты моноглутаматы, в 5-метилтетрагидрофолат в процессе абсорбции в кишечнике. Было показано, что в дозе выше 300 мкг в плазме выявляется неизмененная фолиевая кислота [5]. Такая синтетическая форма витамина быстро выводится почками, однако за период своего нахождения в плазме крови она поступает к клеткам в процессе кровообращения. Как и 5-метилтетрагидрофолат, она проникает в клетки путем диффузии.
Можно было бы предположить, что фолиевая кислота не будет активна в клетках, поскольку не встречается в естественном виде, однако выяснилось, что она подвергается действию фермента дигидрофолат-редуктазы. Этот фермент обычно служит для перехода дигидрофолатов, возникающих в процессе действия фермента тимидилат-синтетазы, обратно в тетрагидрофолаты. Тимидилат-синтетаза превращает дезоксиуридинмонофосфат (дУМФ) в дезокситимидин монофосфат (дТМФ) в процессе биосинтеза пиримидина (рис. 2). Кофермент с замещенной одноуглеродной группой, использованный ферментом, а именно 5,10-метилентетрагидрофолат, является уникальным в фолат-зависимой отдаче одного атома углерода, поскольку продуктом является не тетрагидрофолат, а дигидрофолат. Его нужно постоянно повторно переводить в тетрагидрофолат, чтобы клетка могла продолжать метаболизм фолатов, что достигается с помощью фермента дигидрофолат-редуктазы. После преобразования фолиевой кислоты в дигидрофолат этот же фермент превращает его в тетрагидрофолат, после чего образуется полиглутамат, который удерживается клетками. Таким образом, фолиевая кислота действительно является неактивным провитамином, но подвергается влиянию фолат-зависимого фермента, участвует в метаболизме клетки и удерживается клетками благодаря превращению в полиглутамат.
В отличие от фолиевой кислоты, 5-метилтетрагидрофолат моноглутамат – единственная циркулирующая в организме человека естественная форма витамина В – должен деметилироваться до тетрагидрофолата, прежде чем превратится в полиглутамат и будет удержан клетками. Посредством увеличения или уменьшения потребления 5-метилтетрагидрофолата моноглутамата вместо 5-метилтетрагидрофолата полиглутамата клетки контролируют число циркулирующих фолатов. Повышенное удержание фолатов происходит в тех клетках, где был дефицит 5-метилтетрагидрофолата полиглутамата или где клеточное деление сократило его внутриклеточное содержание относительно содержания соответствующего моноглутамата. Кроме того, повышение уровня содержания 5-метилтетрагидрофолата в крови оказывает некоторое влияние на повышение внутриклеточного уровня его содержания, в результате чего в реакции с метионин-синтазой участвует (и, соответственно, удерживается в виде полиглутамата) большее количество 5-метилтетрагидрофолата моноглутамата. Таким образом, данная система призвана регулировать удержание новых фолатов соразмерно потребностям клетки. В отличие от сказанного выше, поглощение фолиевой кислоты не имеет такого ограничения в части удержания. После экспрессии клетками фермента дигидрофолат-редуктазы, характерной особенности всех делящихся клеток, они будут метаболизировать и удерживать фолиевую кислоту. Чем выше будет уровень содержания фолиевой кислоты в плазме крови и, следовательно, уровень ее внутриклеточного содержания, тем в большей степени она будет поглощаться и удерживаться. Следовательно, фолиевая кислота не подвержена обычному контролю клеточного поглощения, которому подвергается 5-метилтетрагидрофолат.
Роль витамина B12 в удержании клетками 5-метилтетрагидрофолата и фолиевой кислоты
Как указывалось выше, фермент метионин-синтаза зависит от витамина B12 (рис. 2). Хорошо известно, что дефицит витамина B12 приводит к двум различным клиническим последствиям – анемии и невропатии. Установлено, что невропатия возникает в результате прерывания цикла метилирования [6], что по ряду причин вызывает деструкцию миелиновой оболочки [7, 8]. При пернициозной анемии также наблюдается анемия, идентичная анемии, наблюдаемой при дефиците фолатов [9], поэтому представляется вероятным, что прерывание действия метионин-синтазы каким-то образом нарушает нормальную функцию фолатов. Это объяснение, которое, возможно, подходит для большей части экспериментальных и клинических доказательств, называется «гипотезой метильной ловушки». Она предполагает, что в клетках с дефицитом витамина B12 клеточные фолаты захватываются в форме 5-метилтетрагидрофолатов полиглутаматов.
Согласно этой гипотезе, при пернициозной анемии все больше и больше клеточных фолатов превращаются в эту форму, захватываются и становятся неспособными к дальнейшему метаболизму. Такое непрерывное захватывание приводит к сильному уменьшению содержания в клетках других форм фолатов, необходимых для биосинтеза пурина (10-формилтетрагидрофолата) и пиримидина (5,10-метилентетрагидрофолата). Таким образом, клетки начинают испытывать своего рода псевдодефицит фолатов: в них есть фолаты, но в той форме, которую невозможно использовать для биосинтеза пурина и пиримидина. Впоследствии прекращаются биосинтез ДНК и клеточное деление, как если бы в клетках был дефицит фолатов. Если это происходит в костном мозге, развившаяся в результате анемия идентична анемии, которая имеет место при дефиците фолатов.
При дефиците витамина B12, в связи со снижением уровня метионин-синтазы, повторное превращение гомоцистеина обратно в метионин также замедляется. Это, в свою очередь, вызывает снижение уровня САМ. Поскольку САМ является жизненно важным донором метила для ряда метилтрансфераз во всех клетках млекопитающих, клетки с дефицитом витамина B12 начинают восстанавливать уровень САМ путем стимулирования синтеза метионина и синтеза САМ с его участием. Для того чтобы производить больше метионина, клеткам нужно повысить клеточную концентрацию двух субстратов для синтеза метионин-синтазы, зависимой от витамина B12, – гомоцистеина и 5-метилтетрагидрофолата. Это повышает уровень гомоцистеина посредством снижения САМ-зависимого ингибирования фермента 5,10-метилентетрагидрофолат-редуктазы (МТГФ-редуктазы). Данное ингибирование достигается с помощью фермента, имеющего аллостерический участок связывания для САМ. Когда САМ связывается с ферментом, его активность снижается, что сигнализирует клетке о достаточных концентрациях составляющих элементов цикла метилирования.
С точки зрения гипотезы метильной ловушки важнее, что на редуктазу, фермент, который образует 5-метилтетрагидрофолат, также влияют низкие уровни содержания САМ. Когда уровень САМ начинает уменьшаться, активность редуктазы прогрессивно повышается и, следовательно, все больше и больше фолатных коферментов превращаются в 5-метилтетрагидрофолат. Кроме того, гипотеза метильной ловушки предполагает, что действие МТГФ-редуктазы необратимо, и, скорее всего, это предположение является верным, поскольку для обращения редуктазы нужно наличие очень сильного акцептора электронов. Это условие достижимо in vitro путем использования искусственного акцептора электронов, такого как менадион, однако в клетках такого акцептора, по всей вероятности, нет. Кроме того, гипотеза метильной ловушки подразумевает, что единственным ферментом, который может метаболизировать 5-метилтетрагидрофолат, является витамин-B12-зависимый фермент метионин-синтаза. Это предположение подтверждается тем, что никакой другой фермент, обладающий подобным действием, до сих пор не обнаружен. Следовательно, при возникновении дефицита витамина B12 в костном мозге 5-метилтетрагидрофолат метаболически захватывается и не может использоваться в фолат-зависимом биосинтезе ДНК. Это, в свою очередь, препятствует делению клеток и приводит к анемии, идентичной анемии, развивающейся при дефиците фолатов.
Лечение анемии при дефиците фолатов фолатами или фолиевой кислотой приведет к пополнению клеточных запасов фолатов и, таким образом, повторному запуску биосинтеза пурина и пиримидина, а с ним и биосинтеза ДНК и клеточного деления. Назначение витамина B12 не даст результата, поскольку метионин-синтаза уже находится в полностью активном состоянии.
Лечение анемии при дефиците витамина B12, например, пернициозной анемии, витамином B12 приведет к реактивации метионин-синтазы и высвобождению захваченного метилтетрагидрофолата для производства тетрагидрофолата и других фолатных коферментов. В результате возобновится биосинтез пурина и пиримидина, синтез ДНК и клеточное деление, результатом будет излечение от анемии. Восполнение дефицита витамина B12 с помощью фолатного кофермента 5-метилтетрагидрофолата, предположительно, не приведет к успеху. 5-метилтетрагидрофолат просто добавится к уже захваченному количеству фолата такой же формы. Как и эндогенный фолат аналогичной формы, он не сможет участвовать в реакции с ферментом метионин-синтазой, неактивным в этот период из-за недостаточного количества витамина B12. Можно предположить, что 5-метилтетрагидрофолат даже не будет удержан клетками с дефицитом витамина B12, поскольку, не являясь субстратом для полиглутамат-синтетазы, он просто покинет клетку. Существует убедительное доказательство того, что это происходит естественным образом, если 5-метилтетрагидрофолат находится в системе кровообращения. Особенность дефицита витамина B12 заключается в том, что уровни содержания фолатов в клетках значительно снижены, даже если уровень 5-метилтетрагидрофолата в плазме соответствует норме или даже превышает ее.
Однако если при дефиците витамина B12 в клетках костного мозга принимать фолиевую кислоту, можно увидеть другую картину. Как описывалось выше, при проникновении фолиевой кислоты в клетки, например, в клетки костного мозга, которые делятся и содержат фермент дигидрофолат-редуктазу, фолиевая кислота ферментативно восстанавливается в дигидрофолат. Он, в свою очередь, превращается в тетрагидрофолат и формил- и метилен-производные, которые участвуют, соответственно, в биосинтезе пурина и пиримидина. Последние формы также переходят в полиглутаматы, гарантируя, таким образом, удержание клетками поглощенной метаболизированной фолиевой кислоты. Такой процесс идет и в здоровых клетках, и в клетках с дефицитом витамина B12, поскольку метионин-синтаза не вовлечена в вышеуказанный процесс. Следовательно, в здоровых клетках и в клетках с дефицитом витамина B12 фолиевая кислота быстро и напрямую обеспечивает синтез фолатных коферментов, необходимых для биосинтеза пурина и пиримидина, и инициирует процессы биосинтеза ДНК и деления клеток.
В результате эти производные фолатов транспортируются к МТГФ-редуктазе, которая в это время очень активна из-за низкого уровня содержания САМ, и захватываются клетками. Если человек с дефицитом витамина B12 постоянно получает фолиевую кислоту, костный мозг отвечает на терапию, имеющаяся анемия будет излечиваться. Может показаться, что данная терапия является верным решением, однако невропатию, которая также является характерной особенностью пернициозной анемии, намного сложнее распознать клинически. Маскировка анемии будет препятствовать своевременной диагностике пернициозной анемии, и, хотя анемия будет излечиваться, невропатия станет прогрессировать. Причиной невропатии является отсутствие цикла метилирования, поскольку сама по себе фолиевая кислота, даже в случае метаболизирования до дигидро-, тетрагидро- или соответствующих формил- и метилен-фолатов, не может повторно запустить цикл метилирования. Не приведет к повторному запуску цикла метилирования и конечное превращение фолиевой кислоты в результате метаболизма в 5-метилтетрагидрофолат, поскольку цикл будет прерываться из-за неактивности метионин-синтазы, играющей в нем важнейшую роль. Таким образом, терапия фолиевой кислотой будет препятствовать диагностике пернициозной анемии из-за маскировки анемии и не обеспечит лечения невропатии. Существуют данные, что лечение фолиевой кислотой усугубляет невропатию, способствуя ее более быстрому прогрессированию, которое становится все более и более необратимым [10].
Обоснование необходимости улучшения фолатного статуса
Ранее считалось, что прием три-четыре раза в день разнообразной пищи обеспечивает поступление достаточного количества всех питательных веществ. Однако на сегодняшний день даже в большинстве развитых стран Европы и Северной Америки рацион питания не является оптимальным для профилактики некоторых заболеваний. Так, было показано, что у большинства женщин риск рождения ребенка с расщеплением позвоночных дуг можно значительно снизить путем дополнительного потребления фолатов/фолиевой кислоты в период до и после зачатия [11]. Существует очень убедительное (и, по мнению некоторых специалистов, практически неопровержимое) доказательство того, что любое повышение уровня гомоцистеина в плазме крови вызывает повышенный риск развития заболеваний сердца [12] и инсульта [13]. Гомоцистеин – это аминокислота, которая естественным образом присутствует в плазме. Она возникает при расщеплении пищевой аминокислоты – метионина, который обнаруживается в большей части пищи в количестве, примерно на 60% превышающем потребности организма (рис. 2).
Уровень гомоцистеина строго контролируется как в клетках, так и в плазме крови посредством его разложения или обратного превращения в метионин, последний используется для поддержания уровня содержания САМ и обеспечения достаточного количества метильных групп для цикла метилирования. Это достигается с помощью трех ферментов. Двум из них для функционирования нужны фолатные коферменты. Очевидно, что питание не обеспечивает то количество фолатов, которое бы позволило этим ферментам оптимально функционировать [14]. Таким образом, большинство практически здоровых людей имеют повышенный уровень гомоцистеина, который может быть снижен путем приема небольших физиологических доз фолиевой кислоты [15]. В целом рацион питания, не обогащенный фолиевой кислотой/фолатами, обусловливает риск развития заболеваний сердца и инсульта [16].
Был выдвинут ряд доказательств, что потребление фолиевой кислоты/фолатов с пищей уменьшает риск колоректального рака [17]. Так, исследование 1998 г. показало, что длительный прием витаминной добавки, содержащей фолиевую кислоту, значительно снизил частоту случаев возникновения колоректального рака у женщин [18]. Следует подчеркнуть, что данный защитный эффект был выявлен только у тех, кто принимал витаминные добавки в течение длительного времени – от нескольких лет до десятилетий, чего следовало ожидать, учитывая биологические предпосылки.
Сравнение фолиевой кислоты и 5-метилтетрагидрофолата в отношении улучшения фолатного статуса
Можно выделить три способа, посредством которых можно достичь улучшения фолатного статуса:
- изменение моделей пищевого рациона с целью включения в рацион пищи, богатой естественными фолатами;
- прием витаминных добавок;
- обогащение пищи витаминами.
Первый вариант трудно реализуем на практике. Обычному человеку сложно изменить привычки питания и придерживаться новой модели пищевого рациона. Кроме того, несмотря на то что фолаты широко распространены в природе, их содержание в пищевых продуктах невысоко, исключением является печень. Таким образом, повысить содержание фолатов можно либо за счет приема витаминных добавок, либо за счет потребления пищевых продуктов, обогащенных витаминами группы В. В обоих случаях это будет дополнительный прием фолиевой кислоты.
Эта форма, как указывалось выше, не существует в природе и в действительности является провитамином. Фолиевая кислота химически чрезвычайно стабильна и, по всей вероятности, полностью всасывается в организме. Однако прием свыше 300 мкг фолиевой кислоты приводит к тому, что в кровотоке появляется синтетический провитамин. В рекомендуемых нормах потребления (Recommended Dietary Allowances (RDA)) оптимальная норма потребления эквивалента пищевых фолатов в сутки для взрослых повышена до 400 мкг [19]. Это соответствует 200 мкг чистой фолиевой кислоты.
Употребление обогащенных витамином продуктов питания может привести к повышению уровня неизмененной фолиевой кислоты в плазме крови, поскольку практически невозможно контролировать потребление продуктов, обогащенных фолиевой килотой. Существует один очевидный способ избежать этой ситуации, который заключается в том, чтобы добавки или обогащенные продукты содержали вместо фолиевой кислоты естественную форму витамина, а именно 5-метилтетрагидрофолат.
5-метилтетрагидрофолат в виде витамина или в обогащенных продуктах питания
Для того чтобы иметь возможность использовать 5-метилтетрагидрофолат в витаминных добавках или в обогащенных продуктах питания, необходимо преодолеть две технические проблемы: получить химическим путем природный изомер и его стабилизировать.
Получение природного изомера
Восстановление птеридинового кольца фолиевой кислоты до тетрагидро-формы приводит к возникновению асимметричной молекулы. Таким образом, традиционный химический синтез дает одинаковое количество обоих эпимеров C-6, то есть биологически активного (6S) диастереомера и биологически неактивного (6R) диастереомера [20]. Именно данная смесь является исходным материалом для получения 5-метилтетрагидрофолата, который имеется в продаже и используется в добавках. Соответствующее ферментативное восстановление фолиевой кислоты до дигидрофолата и тетрагидрофолата дает только активный (6S) диастереоизомер. Когда фолаты синтезируются в растениях и бактериях, производится только активный диастереомер (6S), так что все существующие в природе восстановленные фолаты будут представлены именно этой формой. Только эта форма является биологически активной, она распознается всеми системами транспорта фолатов и задействуется во всех фолат-зависимых реакциях. Изомер (6R), будучи зеркальным отражением активной формы, не связывается ни с одним из биологически активных фолат-связывающих веществ и не связывается с системами транспорта. Аналогичным образом он не встраивается в активный участок фолат-зависимых ферментов. Таким образом, хотя его химические и физические свойства (например, стабильность, диффузия и растворимость) идентичны свойствам активного (6S) изомера, он полностью лишен какой-либо биологической функции. Следовательно, исходя из химических и биологических предпосылок, он пассивно всасывается в слизистой оболочке кишечника с той же скоростью, что и активный изомер. Он проникает в клетки с такой же скоростью, но не подвергается воздействию фермента метионин-синтазы. В отличие от активной формы, он не переходит в тетрагидро-форму, которая превращается в полиглутамат, удерживаемый клетками. В конце концов он выводится из организма, не выполнив никакой биологической функции. В некоторых научных исследованиях было установлено, что комбинация из двух изомеров терапевтически не оказывала никакого явно вредного воздействия. Однако невозможно абсолютно точно предсказать, что данный диастереомер не будет взаимодействовать ни с одной из биологических систем. Несмотря на то что доказательств существования каких-либо проблем при использовании рацемической смеси не выявлено, очевидно, было бы лучше использовать только биологически активный (6S) диастереомер.
Стабилизация природного изомера
Молекула фолиевой кислоты отличается химической стабильностью [21]. Однако химические свойства молекулы сильно изменяются, если птеридиновое кольцо восстановлено до дигидро- или тетрагидро-формы. И дигидрофолат, и тетрагидрофолат чрезвычайно чувствительны к окислительному расщеплению молекулы в области связи C9-N10 с образованием двух продуктов распада: птеридина и p-аминобензоилглутамата [22]. Обе эти молекулы сами по себе неактивны и не могут биологическим путем обратно превратиться в какую-то активную форму фолата. Подключение группы к азоту N-5 оказывает стабилизирующий эффект на процесс окислительного расщепления, поэтому 5-метилтетрагидрофолат не расщепляется, как тетрагидрофолат, однако он чувствителен к другому типу окислительного воздействия. Этот химический процесс сначала дает 5-метилдигидрофолат, который может подвергнуться обратному восстановлению до 5-метилтетрагидрофолата под воздействием фермента МТГФ-редуктазы (рис. 2). Хотя обычным исходным субстратом для этого фермента является 5,10-метилентетрагидрофолат, вероятно, что 5-метилдигидрофолат представляет собой промежуточную форму при получении 5-метилтетрагидрофолата, продукта реакции данного фермента. Подвергнувшаяся частичному окислению форма 5-метилдигидрофолата становится чувствительной к дальнейшему химическому окислению, которое включает перестройку кольца для образования нового производного. Сперва оно было приписано структуре 4a-гидрокси-5-метилдигидрофолата [22], но позднее было определено, что у него иная химическая структура [23]. В любом случае данная структура абсолютно неактивна биологически. Кроме того, она ни химически, ни ферментативно не может быть превращена обратно в активный фолат.
Что касается стабильности 5-метилтетрагидрофолата, следует обратить внимание на два важных аспекта. Первый – вопрос его стабильности в препарате, который мог бы использоваться в витаминных добавках или добавляться в пищевые продукты в целях их обогащения витамином. Технически удалось добиться создания препарата, который представляется достаточно стабильным для этих целей. Второй аспект заключается в вопросе стабильности 5-метилтетрагидрофолата на разных этапах его поглощения и всасывания в организме, а также его общей биодоступности. Для получения ответа на эти вопросы нужна информация о возможной стабильности 5-метилтетрагидрофолата в кислой среде желудка и далее в кишечнике. Есть некоторые прогнозы относительно возможной стабильности в данных условиях: высока вероятность того, что он достаточно стабилен, чтобы оставаться активным на этих этапах. Однако условия окисления и химического воздействия, которые будут иметь место в ходе этого сложного процесса, трудно смоделировать. Для решения этого вопроса необходимо провести полное сравнительное исследование биодоступности фолиевой кислоты и 5-метилтетрагидрофолата.
Возможные преимущества 5-метилтетрагидрофолата по сравнению с фолиевой кислотой в добавках или обогащенных продуктах питания
Сравнение природного витамина и провитамина
Одно из преимуществ 5-метилтетрагидрофолата по сравнению с фолиевой кислотой заключается в том, что, учитывая одинаковую биодоступность и т.д., природная форма витамина предпочтительней, поскольку можно предположить, что эволюция гарантировала его безопасность и переносимость.
Терапия пернициозной анемии
Главное преимущество 5-метилтетрагидрофолата заключается в том, что он не маскирует пернициозную анемию. Любой 5-метилтетрагидрофолат, поступающий к клеткам костного мозга с дефицитом витамина B12, предположительно, плохо метаболизируется и удерживается, потому что для метаболизма необходим витамин-B12-зависимый фермент метионин. Как обсуждалось ранее, именно пониженная активность этого фермента или полное его отсутствие приводит к возникновению ловушки для такого клеточного фолата, как 5-метилтетрагидрофолат. Очевидно, что внутриклеточные полиглутаматы этой формы используются неэффективно. Кроме того, представляется вероятным, что 5-метилтетрагидрофолат моноглутамат не используется или не удерживается клетками с дефицитом витамина B12, что, следовательно, не дает проходить синтезу ДНК в клетках костного мозга и, в свою очередь, предотвращает маскировку анемии.
Существуют два экспериментальных доказательства, свидетельствующие о том, что 5-метилтетрагидрофолат не вызывает реакцию костного мозга при дефиците витамина B12. Во-первых, в трех отдельных исследованиях было показано, что костный мозг, взятый у людей с дефицитом витамина B12, не реагирует на 5-метилтетрагидрофолат, хотя реагирует на фолиевую кислоту в отношении биосинтеза ДНК в клетках [24–26]. В этих исследованиях рассматривалась реакция недавно полученных клеток костного мозга in vitro посредством измерения повышения de novo биосинтеза пиримидина в сравнении со случаями добавления двух разных форм витамина [27]. Кроме того, есть исследование in vivo одного участника с дефицитом витамина B12. У этого участника исследования было показано отсутствие гематологической реакции, измеряемой по количеству ретикулоцитов при приеме 5-метилтетрагидрофолата в дозе ~100 мкг в день в течение 10 дней. Не было установлено и реакции на внутривенное введение 100 мкг 5-метилтетрагидрофолата. Лечение внутривенным B12 вызвало стойкое повышение количества ретикулоцитов.
Снижение уровня гомоцистеина в плазме
Поскольку 5-метилтетрагидрофолат участвует в метаболизме гомоцистеина, представляется вероятным, что данная форма витамина будет, так же как фолиевая кислота, эффективно нормализовывать концентрации гомоцистеина в плазме, повышение которых, как показано многими клиническими исследованиями, является фактором риска развития сердечных заболеваний и инсульта [28].
Функция эндотелия
M.C. Verhaar и соавт. [29] выявили, что 5-метилтетрагидрофолат, в отличие от фолиевой кислоты, in vivo восстанавливает функцию эндотелиальных клеток у пациентов с семейной гиперхолестеринемией. Было высказано предположение, что это происходит в результате стимуляции регенерации эндогенного тетрагидробиоптерина, который, в свою очередь, может восстанавливать активность оксида азота.
Лечение психических заболеваний
В плацебоконтролируемом исследовании P.S. Godfrey и соавт. [30] было продемонстрировано значительное улучшение состояния 123 пациентов с острыми психическими расстройствами на фоне применения 5-метилтетрагидрофолата в дозировке 15 мг/сут в течение 6 месяцев в сравнении с плацебо.Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.