Микробиота кишечника как модулятор эффективности фармакотерапии при ожирении, бронхиальной астме и артериальной гипертензии
- Аннотация
- Статья
- Ссылки
- English
Основные положения. В современных исследованиях выявлена опосредованная системным воспалением, эндотелиальной дисфункцией и изменениями микробиоты кишечника тесная взаимосвязь между ожирением, БА и АГ. Характерный дисбиоз при ожирении проявляется нарушением соотношения Firmicutes/Bacteroidetes, снижением продукции короткоцепочечных жирных кислот (КЦЖК) и развитием метаболической эндотоксемии. При БА наблюдается выраженное снижение микробного разнообразия и дисфункция оси «кишечник – легкие», что усиливает воспаление дыхательных путей, опосредованное Th2-клетками. В случае АГ дисбиоз характеризуется уменьшением численности бутират-продуцирующих бактерий, активацией ренин-ангиотензиновой системы через микробные метаболиты и нарушением NO-опосредованной вазодилатации. Диетотерапия играет ключевую роль в коррекции этих нарушений. Средиземноморский тип питания способствует усилению эффективности базисной терапии астмы, диета Dietary Approaches to Stop Hypertension (DASH) улучшает контроль артериального давления, а пищевые волокна повышают чувствительность тканей к метформину и антигипертензивным препаратам.
Заключение. Применение пробиотических штаммов, пребиотических компонентов и постбиотиков, способствующих снижению системного воспаления, увеличивающих продукцию КЦЖК и улучшающих эндотелиальную функцию, считают перспективным направлением терапии ожирения, БА и АГ. Однако для внедрения персонализированных подходов в клиническую практику требуются дополнительные исследования, учитывающие индивидуальные особенности микробиома пациентов, влияние диеты на фармакокинетику препаратов и оптимальные комбинации нутритивной и медикаментозной терапии. Интеграция этих направлений позволит разработать эффективные алгоритмы ведения пациентов с сочетанной патологией ожирения, БА и АГ.
Основные положения. В современных исследованиях выявлена опосредованная системным воспалением, эндотелиальной дисфункцией и изменениями микробиоты кишечника тесная взаимосвязь между ожирением, БА и АГ. Характерный дисбиоз при ожирении проявляется нарушением соотношения Firmicutes/Bacteroidetes, снижением продукции короткоцепочечных жирных кислот (КЦЖК) и развитием метаболической эндотоксемии. При БА наблюдается выраженное снижение микробного разнообразия и дисфункция оси «кишечник – легкие», что усиливает воспаление дыхательных путей, опосредованное Th2-клетками. В случае АГ дисбиоз характеризуется уменьшением численности бутират-продуцирующих бактерий, активацией ренин-ангиотензиновой системы через микробные метаболиты и нарушением NO-опосредованной вазодилатации. Диетотерапия играет ключевую роль в коррекции этих нарушений. Средиземноморский тип питания способствует усилению эффективности базисной терапии астмы, диета Dietary Approaches to Stop Hypertension (DASH) улучшает контроль артериального давления, а пищевые волокна повышают чувствительность тканей к метформину и антигипертензивным препаратам.
Заключение. Применение пробиотических штаммов, пребиотических компонентов и постбиотиков, способствующих снижению системного воспаления, увеличивающих продукцию КЦЖК и улучшающих эндотелиальную функцию, считают перспективным направлением терапии ожирения, БА и АГ. Однако для внедрения персонализированных подходов в клиническую практику требуются дополнительные исследования, учитывающие индивидуальные особенности микробиома пациентов, влияние диеты на фармакокинетику препаратов и оптимальные комбинации нутритивной и медикаментозной терапии. Интеграция этих направлений позволит разработать эффективные алгоритмы ведения пациентов с сочетанной патологией ожирения, БА и АГ.



Введение
Микробиота кишечника представляет собой сложную экосистему микроорганизмов, играющих ключевую роль в поддержании гомеостаза организма. В последние десятилетия накоплены значительные данные о влиянии микробиоты на метаболические и иммунные процессы, что открывает новые перспективы в фармакотерапии таких заболеваний, как ожирение, бронхиальная астма (БА) и артериальная гипертензия (АГ). Развитие этих заболеваний может быть смоделировано в зависимости от состава и функциональной активности кишечных микроорганизмов. В данном обзоре рассмотрены механизмы взаимодействия микробиоты и лекарственной терапии ожирения, БА и АГ, а также перспективы использования пробиотиков, пребиотиков и постбиотиков в комплексном лечении этих заболеваний.
Цель статьи – проанализировать литературные данные о роли микробиоты в фармакотерапии ожирения, БА и АГ, с акцентом на механизмы взаимодействия диеты, кишечного микробиома и лекарственной терапии. Систематический анализ научных публикаций проведен в базах данных PubMed и eLIBRARY с использованием ключевых терминов: микробиота, ожирение, бронхиальная астма, артериальная гипертензия, фармакотерапия, диетотерапия. Особое внимание уделено исследованиям, посвященным влиянию различных диетических подходов на эффективность фармакотерапии.
Микробиота и ожирение: механизмы взаимосвязи
По данным научных исследований, отмечено, что у лиц с ожирением наблюдается дисбаланс в составе кишечной микробиоты (рис. 1). У таких людей наблюдается увеличение относительной численности Firmicutes и уменьшение Bacteroidetes по сравнению с людьми с нормальной массой тела [1]. В некоторых исследованиях также показано снижение количества продуцирующих короткоцепочечные жирные кислоты (КЦЖК) бактерий, таких как Akkermansia muciniphila, что коррелирует с инсулинорезистентностью и воспалением [2]. Микробиота кишечника способна усиливать энергетическую ценность рациона благодаря ферментации неперевариваемых полисахаридов с образованием КЦЖК, которые всасываются и используются в качестве источника энергии [3]. У лиц с ожирением наблюдается повышенная экспрессия бактериальных генов, связанных с расщеплением сложных углеводов, что способствует дополнительному получению калорий из пищи [4].
Нарушение микробного баланса кишечника может вызывать увеличение проницаемости кишечной стенки, что способствует проникновению бактериальных липополисахаридов (ЛПС) в кровь. ЛПС связываются с Toll-подобными рецепторами TLR4, активируя синтез провоспалительных цитокинов, таких как фактор некроза опухоли-α (ФНО-α) и интерлейкин 6 (ИЛ-6). Этот процесс лежит в основе формирования хронического воспаления, которое часто наблюдается при ожирении [5]. Кроме того, снижение уровня бутирата, обладающего противовоспалительными свойствами, усугубляет инсулинорезистентность [6].
Кишечная микробиота влияет на секрецию гормонов, регулирующих аппетит и энергетический обмен, таких как глюкагоноподобный пептид-1 (ГПП-1) и пептид YY (PYY). Эти гормоны замедляют моторику кишечника и снижают потребление пищи [7]. У лиц с ожирением часто наблюдается снижение их секреции, что может быть связано с дисбиозом [8]. Микробиота участвует в трансформации первичных желчных кислот во вторичные, которые активируют фарнезоидный X-рецептор (FXR) и мембранный рецептор желчных кислот, связанный с G-белком (TGR5), регулирующие гомеостаз глюкозы и липидов [9]. Нарушение этого процесса может способствовать развитию ожирения и стеатоза печени [10].
Учитывая ключевую роль микробиоты в патогенезе ожирения, стратегии ее модуляции представляют значительный интерес. К ним относятся:
- пробиотики с Lactobacillus и Bifidobacterium, способствующие восстановлению баланса микробиоты и снижению массы тела [11];
- пребиотики (инулин, фруктоолигосахариды), стимулирующие рост полезных бактерий и повышающие продукцию КЦЖК [12];
- трансплантация фекальной микробиоты (ТФМ), демонстрирующая потенциал в улучшении метаболических параметров у пациентов с ожирением [13];
- фармакологические препараты (метформин и аналоги ГПП-1), которые могут оказывать положительное влияние на состав микробиоты [14].
Таким образом, микробиота кишечника играет важную роль в регуляции энергетического обмена и развитии ожирения. Понимание механизмов ее участия в метаболических процессах открывает новые возможности для персонализированной терапии. Дальнейшие исследования позволят разработать эффективные стратегии коррекции дисбиоза и улучшения метаболического здоровья.
Микробиота и бронхиальная астма: механизмы взаимосвязи
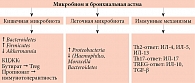
В последние десятилетия накоплены убедительные доказательства роли кишечной и легочной микробиоты в патогенезе астмы путем сложных механизмов иммунной регуляции (рис. 2). Концепция оси «кишечник – легкие» предполагает двунаправленное взаимодействие микробиома кишечника и респираторной системы, опосредованное иммунными, неврологическими и метаболическими путями.
В научных исследованиях показаны значительные отличия состава микробиоты кишечника и дыхательных путей у пациентов с астмой от микробиоты здоровых лиц. В кишечнике отмечается снижение разнообразия микробиоты, уменьшение количества Bacteroidetes и увеличение Firmicutes, особенно у детей с аллергической астмой [15]. В бронхиальном микробиоме наблюдается повышенное содержание Proteobacteria (Haemophilus, Moraxella) и сниженнное – Bacteroidetes, что коррелирует с тяжестью заболевания [16]. Кишечная микробиота играет ключевую роль в созревании иммунной системы, особенно в раннем возрасте. КЦЖК (ацетат, пропионат и бутират), продуцируемые такими бактериями, способствуют дифференцировке регуляторных Т-клеток, которые подавляют избыточный Th2-иммунный ответ, характерный для аллергической астмы [17]. Дефицит этих метаболитов ассоциирован с повышенным риском развития атопии и гиперреактивности дыхательных путей [18].
Изменения в микробиоме кишечника могут вызывать нарушение барьерной функции, способствуя попаданию бактериальных молекул в циркуляцию и активации системного воспалительного ответа [19]. ЛПС, входящие в состав клеточной стенки грамотрицательных микроорганизмов, индуцируют синтез провоспалительных цитокинов, способных усугублять воспалительные процессы в респираторном тракте [20]. Легочная микробиота, хотя и менее многочисленная по сравнению с кишечной, играет важную роль в поддержании локального иммунного гомеостаза. Нарушение ее состава (особенно увеличение Proteobacteria) ассоциировано с усилением воспаления и гиперреактивности бронхов [21]. Некоторые бактерии (например, Streptococcus pneumoniae) могут индуцировать Th17-ответ, связанный с более тяжелыми формами астмы [22]. Микробиота может модулировать эффективность противоастматических препаратов. Например, некоторые кишечные бактерии способны метаболизировать глюкокортикоиды, влияя на их биодоступность [23]. Кроме того, КЦЖК могут потенцировать противовоспалительное действие этих препаратов через эпигенетические механизмы [24].
К перспективным направлениям микробиом-ориентированной терапии астмы относят:
- пробиотики (штаммы Lactobacillus и Bifidobacterium демонстрируют потенциал в снижении частоты обострений и улучшении контроля астмы, особенно у детей [25]);
- пребиотики (олигосахариды грудного молока и фруктоолигосахариды способствуют росту полезных бактерий и повышению продукции КЦЖК [26]);
- диетотерапию (диета, богатая клетчаткой, увеличивает выработку противовоспалительных метаболитов микробиоты [27]);
- ТФМ (предварительные исследования показывают перспективность этого метода для коррекции дисбиоза при тяжелых формах астмы [28]);
- постбиотики (применение бактериальных метаболитов (например, бутирата) рассматривается как новый подход к терапии [29]).
Таким образом, микробиота кишечника и дыхательных путей играет важную роль в патогенезе БА, опосредованной через сложные иммунные и метаболические механизмы. Понимание этих взаимосвязей открывает новые перспективы для разработки персонализированных подходов к профилактике и лечению заболевания. Дальнейшие исследования в этой области могут привести к созданию инновационных стратегий, основанных на модуляции микробиома.
Микробиота и артериальная гипертензия: механизмы взаимосвязи
В научных исследованиях убедительно продемонстрирована ключевая роль кишечной микробиоты в патогенезе АГ (рис. 3). Согласно данным метаанализа T. Yang и соавт. [30], у пациентов с АГ наблюдается значительное снижение разнообразия микробиоты и уменьшение количества бутират-продуцирующих бактерий. Эти изменения сопровождаются повышением соотношения Firmicutes/Bacteroidetes, что рассматривается как маркер дисбиоза [30, 31]. Основной механизм влияния микробиоты на регуляцию артериального давления (АД) связан с продукцией КЦЖК. В исследовании J.L. Pluznick выявлено, что бутират и пропионат активируют рецепторы Olfr78 и GPR41 в юкстагломерулярном аппарате почек, модулируя секрецию ренина [32]. В работе F.Z. Marques и соавт. показано, что ацетат способствует предотвращению развития АГ у мышей благодаря улучшению эндотелиальной функции [33]. Исследователи установили, что потребление пищевых волокон вызывает благоприятные изменения кишечной микробиоты, что ассоциировано со снижением риска сердечно-сосудистых заболеваний. Ключевым медиатором этого защитного эффекта выступает ацетат – КЦЖК, продуцируемая микробиотой. Ацетат запускает последовательность биохимических реакций, приводящих к оптимизации работы сердечно-сосудистой системы на клеточном и тканевом уровнях [33]. Важным аспектом является влияние микробных метаболитов на ренин-ангиотензин-альдостероновую систему (РААС).
M.M. Santisteban и соавт. обнаружили, что дисбиоз увеличивает активность ангиотензинпревращающего фермента (АПФ) в кишечнике, способствуя вазоконстрикции [34]. G. Yang и соавт. продемонстрировали, что рекомбинантные штаммы Lactobacillus plantarum, экспрессирующие ингибирующий пептид АПФ, оказывают выраженный гипотензивный эффект, снижая систолическое АД на 25–30 мм рт. ст. [35]. N. Wilck и соавт. впервые доказали, что штамм Lactobacillus murinus играет ключевую роль в контроле гипертензии. Согласно данным этого исследования, Lactobacillus murinus способствует снижению АД на 16 ± 3 мм рт. ст. за счет подавления дифференцировки провоспалительных Th17-клеток и уменьшения продукции ИЛ-17 [36]. В исследовании M. Toral и соавт. выявлена важная роль оси «микробиота – симпатическая нервная система» в патогенезе АГ. Дисбиоз кишечника через TLR4-зависимую активацию усиливает симпатический тонус, что приводит к стойкому повышению АД [37]. Q. Yan и соавт. впервые системно охарактеризовали специфические изменения микробиоты при АГ, выявив дефицит бутират-продуцирующих бактерий и повышение содержания протеобактерий, что ассоциировано с усилением системного воспаления и эндотелиальной дисфункцией [38]. В работе B. Mell и соавт. впервые было установлено, что изменения состава кишечной микробиоты не просто сопровождают АГ, но и непосредственно вызывают ее развитие, что подтвердилось значительным повышением АД после ТФМ [39].
В настоящее время модуляция микробиоты пробиотиками является перспективным направлением. В метаанализе S. Khalesi и соавт. показано, что прием Lactobacillus plantarum способствует снижению систолического давления [40]. I. Robles-Vera и соавт. подчеркивают необходимость персонализированного подхода, с учетом исходного состава микробиоты [41]. Диета играет ключевую роль в формировании состава кишечной микробиоты и ее влиянии на здоровье человека [42].
Влияние диеты на эффективность фармакотерапии при ожирении, бронхиальной астме и артериальной гипертензии: механизмы взаимодействия и клиническое значение
По данным современных исследований убедительно показано, что характер питания пациента может существенно влиять на эффективность лекарственной терапии при ожирении, БА и АГ (таблица). Это взаимодействие осуществляется с помощью таких ключевых механизмов, как модуляция микробиоты кишечника, изменение фармакокинетики препаратов и влияние пищевых компонентов на системное воспаление. У пациентов с ожирением наблюдается изменение активности ферментов системы цитохрома P450 (CYP450), ответственных за метаболизм большинства лекарственных средств. В частности, диета с высоким содержанием жира снижает активность фермента CYP3A4, что может приводить к неожиданному повышению концентрации таких препаратов, как статины и блокаторы кальциевых каналов [43]. Напротив, диета, богатая растительными волокнами, усиливает экспрессию CYP3A4, ускоряя метаболизм глюкокортикоидов, что требует коррекции дозировки [44]. Особый интерес представляет влияние диеты на микробиоту кишечника, которая играет ключевую роль в метаболизме многих лекарственных препаратов.
Кишечные бактерии способны активировать пролекарства (например, сульфасалазин превращается в активную 5-аминосалициловую кислоту под действием бактериальных азоредуктаз) [45], а также инактивировать некоторые препараты (Eggerthella lenta метаболизирует дигоксин до неактивного дигидродигоксина) [46]. Примечательно, что эффективность метформина у пациентов с ожирением и сахарным диабетом 2 типа в значительной степени зависит от состава микробиоты – бактерии Akkermansia muciniphila усиливают его действие за счет увеличения продукции бутирата [47]. Как показывают исследования, оптимальный ответ на терапию метформином чаще наблюдается у пациентов, соблюдающих богатую клетчаткой средиземноморскую диету, чем у лиц с дефицитом пребиотиков в питании [48]. Этот принцип распространяется и на лечение БА, где пищевые привычки пациента выступают значимым модификатором эффективности ингаляционных глюкокортикоидных средств.
В исследованиях показано, что западная диета с высоким содержанием насыщенных жиров и простых углеводов ассоциирована со снижением чувствительности к глюкокортикоидам, что объясняется усилением системного воспаления и изменением состава микробиоты [49]. Напротив, средиземноморская диета, богатая содержащимися в рыбе, льняном семени омега-3 полиненасыщенными жирными кислотами (ПНЖК), антиоксидантами (фрукты, овощи) и оливковым маслом, потенцирует противовоспалительное действие глюкокортикоидов за счет снижения уровня провоспалительных цитокинов (ИЛ-6, ФНО-α) и увеличения количества регуляторных Т-клеток [50]. Интересно, что кофеин, содержащийся в кофе и чае, может усиливать бронходилатирующий эффект β2-агонистов за счет синергического действия на аденозиновые рецепторы, что следует учитывать при подборе терапии [51].
Практические рекомендации по оптимизации фармакотерапии у пациентов с ожирением включают в себя увеличение потребления пищевых волокон (30–40 г/сут) для усиления эффекта метформина, ограничение насыщенных жиров при приеме статинов и включение в рацион продуктов (жирная рыба), богатых омега-3 ПНЖК для потенцирования их противовоспалительного действия [52]. Пациентам с БА особенно важно соблюдать средиземноморскую диету с высоким содержанием антиоксидантов, ограничивать употребление фастфуда (ассоциированного с усилением Th2-ответа) и поддерживать адекватный уровень витамина D, который играет важную роль в модуляции иммунного ответа [53, 54]. У пациентов с ожирением и АГ факторы питания особенно значимы. Диета Dietary Approaches to Stop Hypertension (DASH), богатая фруктами, овощами, и с низким содержанием натрия, увеличивает численность бутират-продуцирующих бактерий (Roseburia, Faecalibacterium prausnitzii), что способствует повышению эффективности антигипертензивных препаратов и снижению систолического АД на 5–11 мм рт. ст. [30, 33, 39]. Продукты, богатые нитратами (свекла, листовая зелень), стимулируют рост денитрифицирующих бактерий (Thauera, Thiobacillus), которые преобразуют нитраты в оксид азота (NO), потенцируя действие гипотензивных средств и улучшая эндотелиальную функцию [7, 36]. Таким образом, персонализированный подход к питанию пациентов с ожирением, БА и АГ может стать важным инструментом повышения эффективности фармакотерапии.
Заключение
При анализе данных современной литературы убедительно показано, что персонализированный нутритивный подход представляет собой важнейший инструмент оптимизации фармакотерапии у пациентов с коморбидным течением ожирения, бронхиальной астмы и артериальной гипертензии. Результаты многочисленных исследований свидетельствуют о ключевой роли кишечной микробиоты как связующего звена между диетическими факторами и эффективностью медикаментозной терапии. Установлено, что средиземноморский тип питания, характеризующийся высоким содержанием полиненасыщенных жирных кислот, антиоксидантов и пищевых волокон, а также DASH-диета с акцентом на нитрат-содержащие продукты не только способствуют восстановлению микробиоценоза, но и существенно потенцируют действие базисных препаратов – от метформина и антигипертензивных средств при метаболических нарушениях до ингаляционных кортикостероидов при бронхиальной астме. Особое значение имеет модуляция микробиоты при артериальной гипертензии, поскольку пробиотики способны усиливать эффект гипотензивной терапии через подавление системного воспаления.
Особое внимание следует уделить созданию интегрированных терапевтических подходов, учитывающих метаболические, кардиоваскулярные и респираторные аспекты ведения пациентов. Реализация этих направлений позволит перейти от общих диетических рекомендаций к персонализированным схемам нутритивной поддержки, способным существенно повысить эффективность комплексного лечения и улучшить качество жизни пациентов с сочетанной патологией ожирения, бронхиальной астмы и артериальной гипертензии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Публикация подготовлена в рамках выполнения фундаментальной научно-исследовательской работы ФГБУН «ФИЦ питания, биотехнологии и безопасности пищи» № FGMF-2025-0003.
I.A. Lapik, K.M. Gapparova
Federal Research Centre for Nutrition, Biotechnology and Food Safety, Moscow
Contact person: Irina Alexandrovna Lapik, Lapik_@inbox.ru
Aim. Analyze the literature on the role of the microbiota in pharmacotherapy for obesity, bronchial asthma (BA), and arterial hypertension (AH), with a focus on the mechanisms of interaction between diet, the gut microbiome, and drug therapy.
Key points. Modern research reveals a close relationship between obesity, BA, and AH, mediated by systemic inflammation, endothelial dysfunction, and alterations in gut microbiota. The characteristic dysbiosis in obesity is marked by an imbalance in the Firmicutes/Bacteroidetes ratio, reduced production of short-chain fatty acids (SCFAs), and the development of metabolic endotoxemia. In BA, a significant decrease in microbial diversity and dysfunction of the "gut-lung axis" exacerbate Th2-mediated airway inflammation. In AH, dysbiosis is characterized by a reduction in butyrate-producing bacteria, activation of the renin-angiotensin system via microbial metabolites, and impaired NO-mediated vasodilation. Dietary therapy plays a key role in addressing these disturbances. The Mediterranean diet enhances the efficacy of asthma treatment, the DASH diet improves blood pressure control, and dietary fiber increases sensitivity to metformin and antihypertensive drugs.
Conclusion. Promising therapeutic approaches include the use of probiotic strains, prebiotic components, and postbiotics, which demonstrate the ability to reduce systemic inflammation, boost SCFA production, and improve endothelial function. However, implementing personalized approaches in clinical practice requires further research to account for individual microbiome variations, diet-drug pharmacokinetic interactions, and optimal combinations of nutritional and pharmacological therapies. Integrating these directions will enable the development of effective management algorithms for patients with comorbid obesity, BA, and AH.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.