Множественная миелома (ММ) – самая распространенная форма моноклональных гаммапатий, которая чаще всего поражает лиц пожилого возраста. Средний возраст больных в момент установления диагноза составляет 62 года, причем частота заболеваний увеличивается в старших возрастных группах [1]. На долю лиц моложе 40 лет приходится только 2% всех случаев, а 80-летние болеют в 10 раз чаще 50-летних. Среди населения в целом заболеваемость составляет 3 случая на 100 000, а среди 80-летних – 37 на 100 000. Отмечено незначительное преобладание мужчин (61%) среди больных ММ. По данным Европейской гематологической ассоциации, к настоящему времени ММ составляет 10% гемобластозов [3].
Заболеваемость множественной миеломой неуклонно растет: если в 1965 г. на долю ММ приходилось до 0,03% всех злокачественных опухолей, то в 2006 г. – уже 1–2%, в том числе 2% всех смертельных исходов при онкологических заболеваниях [2]. На территории РФ смертность от ММ составляет более 10 000 человек в год [4].
История изучения ММ неразрывно связана с именами Henry Bence Jones (публикация 1848 г.), Rustizky (введение термина «множественная миелома», 1873 г.), Otto Kahler (описание клинической картины заболевания, 1889 г.). История терапии ММ значительно короче и начинается в 1958 г., когда был открыт сарколизин, из которого впоследствии был получен мелфалан, и впервые стало возможно лечение миеломы [5].Заболевания с поражением плазматических клеток (ПК) чаще всего выявляют по увеличению содержания в сыворотке крови или моче иммуноглобулинов (гамма-глобулинов). В зависимости от состава иммуноглобулинов выделяют две основные группы патологии: реактивная поликлональная пролиферация плазматических клеток и моноклональные гаммапатии. Моноклональные гаммапатии, в свою очередь, включают моноклональную гаммапатию неопределенного генеза (МГНГ) и собственно опухоли ПК – плазмоцитому, миелому, плазмоклеточный лейкоз, амилоидоз, болезнь тяжелых цепей и болезнь Бен-Джонса (легких цепей) (табл. 1).
ММ представляет собой заболевание системы крови, биологической основой которого является накопление трансформированных ПК и продуцируемого ими патологического белка. К основным клиническим проявлениям ММ относят костные боли, усталость, обусловленную анемией, рецидивирующие инфекции и нарушение функции почек. Диагноз «опухоль ПК» может быть установлен, если содержание ПК в костном мозге превышает 10% и имеются доказательства аберрантности фенотипа и/или клональности трансформированных плазматических клеток.
Классическая диагностическая триада ММ включает:
- наличие моноклонального белка в сыворотке крови и/или моче;
- содержание ПК в костном мозге более 10%;
- наличие остеолитического поражения плоских костей.
Иммунодиагностика ММ, как и других онкогематологических заболеваний, включает выявление опухоль-ассоциированных молекул:
- на поверхностной мембране клетки;
- внутри клетки;
- в биологических жидкостях.
Диагностика ММ включает несколько направлений, которые были предложены к применению в виде практических рекомендаций Международной рабочей группой по множественной миеломе в 2003 г. [6] и дополнены в 2005 г. [3]: скрининг, подтверждение диагноза, определение объема опухоли, выявление функциональной недостаточности органов, вызванной миеломой, и специальные методы, применяемые в отдельных случаях.
Субстратом миеломы являются трансформированные ПК, подавляющие нормальный гемопоэз и продуцирующие патологический (моноклональный) белок. Нормальные ПК, представляющие собой зрелые В-лимфоциты, прошедшие этапы антиген-зависимой дифференцировки, переключения изотипов Н-цепей Ig и гипермутации V-региона, обеспечивают продукцию нормальных (неизотипических) ИГ различных классов. Дифференцировка ПК с формированием клона клеток, продуцирующих антитела, является принципиальной основой обеспечения гуморального иммунитета. В норме созревание ПК является результатом сложной, поэтапной координации таких процессов, как клеточная дифференцировка, клеточный цикл и апоптоз [7]. Начальным этапом дифференцировки ПК является активация покоящихся В-лимфоцитов в ответ на определенный антиген (обычно пептидной природы при Т-зависимой дифференцировке и углеводной в случае Т-независимой), что приводит к запуску процессов клеточного деления. В случае Т-независимого ответа конечные стадии дифференцировки обычно ограничиваются формированием IgM-продуцирующих ПК. При Т-зависимом ответе активированные В-лимфоциты, Т-лимфоциты и дендритные клетки формируют зародышевые центры.
В зародышевых центрах в В-клетках происходит реаранжировка генов тяжелых цепей, что приводит к переключению классов синтезируемых антител. В процессе антигенной стимуляции В-лимфоциты могут элиминироваться путем апоптоза, в случае низкой аффинности к антигену или аутореактивности могут дифференцироваться в клетки памяти, потенциально способные к реактивации и запуску клеточного цикла, или становиться терминально дифференцированными ПК, которые утрачивают способность к делению и реактивации [8]. Миеломные клетки появляются в результате моноклональной пролиферации трансформированных опухолевых ПК и, как следствие, способны к продукции только одного моноклонального белка.
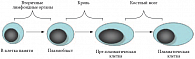
Иммунофенотипические изменения сопровождают каждую стадию дифференцировки активированных В-лимфоцитов в ПК. В ходе дифференцировки ПК из В-клеток памяти путем антигенной стимуляции покоящиеся В-клетки изменяют свой фенотип: от CD19++CD20++CD45+++CD38+/-CD138- (В-клетки памяти) до CD19+/-CD20+/-CD45+++CD38+CD138- (стадия пре-плазмобласта) и по направлению CD19-CD20-CD45++CD38+++CD138- (стадия плазмобласта) и CD19-CD20-CD45++CD38+++CD138+++ (стадия пре-плазматической клетки) с постепенным увеличением экспрессии поверхностных ИГ [9] (рис. 1).
Каждой из указанных на рис. 1 стадий соответствует уникальный фенотипический профиль. По мере созревания параллельно со сменой компартмента (вторичные лимфоидные органы, кровь, костный мозг) происходит изменение экспрессии различных поверхностных антигенов: CD19, CD20, CD38, CD45, CD138.
По мере созревания ПК происходит усиление экспрессии CD38 и CD138. Именно выявление яркой сочетанной экспрессии данных маркеров позволяет надежно верифицировать ПК конечных стадий дифференцировки. Молекула CD138 – синдекан-1 – является дифференцировочным маркером ПК. CD138 относится к семейству гепарансульфатов и участвует в обеспечении адгезии ПК к компонентам стромального микроокружения (оба типа взаимодействий – клетка-клетка и клетка-матрикс). Более того, CD138 выполняет роль корецептора к ряду ростовых факторов [13].
Таким образом, главными фенотипическими особенностями созревания ПК в норме являются:
- постепенная утрата экспрессии В-ассоциированных маркеров;
- снижение уровня экспрессии CD45;
- усиление экспрессии CD38 и дифференцировочного антигена CD138.
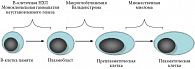
Нарушения в процессе созревания ПК и, прежде всего, на стадии дифференцировки В-клеток в зародышевом центре, где происходит соматическая реаранжировка, приводят к накоплению клональных трансформированных клеток. Среди основных пролиферативных заболеваний ПК следует выделить В-клеточную неходжкинскую лимфому с плазматической дифференцировкой, моноклональную гаммапатию неустановленного генеза, макроглобулинемию Вальденстрема и множественную миелому. Все указанные патологии в определенной степени ассоциированы с различными стадиями созревания ПК (рис. 2).
Распространенность моноклональных гаммапатий и множественной миеломы, в частности среди людей средней и старшей возрастных групп, и появление новых видов лекарственной терапии, механизм действия которых направлен на подавление активности протеасом, обусловливают необходимость совершенствования уровня диагностики и мониторинга ММ, в особенности верификации ремиссии заболевания [14, 15]. Определение концентрации основных классов ИГ-сыворотки является скрининговым исследованием, а иммунофиксация белков сыворотки и/или мочи – уточняющим методом верификации продукции моноклонального белка (ИГ и/или легкой цепи) (рис. 3).
На рисунке 3 в качестве примера приведены результаты иммунофиксации при повышенном уровне ИГ как минимум одного класса: на первой иммунофореграмме выявлена моноклональная продукция белка класса ИГ с тяжелой альфа-цепью и легкой лямбда-цепью (IgA/lambda). Значительный избыток антигена приводит не только к формированию отчетливой полосы на треках геля, соответствующих IgA и лямбда-цепи, но и к формированию феномена «кольца», то есть зоны просветления в центре полосы моноклонального белка. Во втором тесте выявлен моноклональный IgG/lambda, то есть верифицирована продукция патологического белка, несмотря на то что уровень всех ИГ основных классов находится в пределах биологических референтных интервалов. Третий тест демонстрирует положительный результат иммунофиксации в виде моноклонального ИГ с тяжелой гамма-цепью и легкой каппа-цепью (IgG/kappa) при сниженном уровне ИГ в сыворотке крови.
По рекомендациям Международной группы по мониторингу ММ иммунофиксация принята в качестве обязательного метода для верификации ремиссии и отсутствия минимальной остаточной болезни (МОБ) [15] (рис. 4).
На рисунке 4 можно видеть, что при первом обследовании (иммунофореграмма I) по результатам электрофореза фракция бета-глобулинов составляла 49% и был выявлен очень высокий уровень ИГ класса А (IgA > 11 г/л). При иммунофиксации сыворотки подтверждена моноклональная продукция IgA/lambda. После проведения химиотерапии при электрофорезе сыворотки фракция бета-глобулинов составила не более 20% всех белков сыворотки крови, концентрация основных классов ИГ сыворотки крови была значительно снижена, а IgA не был выявлен, что в целом могло быть расценено как клинико-лабораторная ремиссия. Однако при иммунофиксации сыворотки (иммунофореграмма II) выявлена отчетливая моноклональная продукция IgA, легкая цепь которого представлена исключительно лямбда-цепью, то есть получены данные о сохранной продукции моноклонального ИГ и, следовательно, об отсутствии ремиссии. Среди всего арсенала методов лабораторной диагностики только метод иммунофиксации, благодаря высокой чувствительности и специфичности используемых антисывороток, позволил выявить моноклональный белок, несмотря на очень низкий уровень IgA в сыворотке.
Иммунофенотипирование (ИФТ) трансформированных ПК при ММ и других видах моноклональных гаммапатий является современным направлением в диагностике парапротеинемий [3, 14, 16]. Основными показаниями для проведения иммунофенотипирования с целью выявления и оценки иммунофенотипического профиля ПК являются:
- дифференциальный диагноз ММ, моноклональных гаммапатий неясного генеза и реактивных состояний;
- выявление маркеров, значимых при определении прогноза течения ММ и ответа на химиотерапию;
- выявление МОБ у больных ММ после терапии.
Естественно, что для каждого направления ИФТ с использованием метода проточной цитометрии предполагается использование различных подходов для получения диагностически значимых результатов (табл. 2). При анализе образцов костного мозга пациентов с ММ на этапе верификации диагноза, то есть до начала терапии, трансформированные ПК в большинстве случаев могут быть идентифицированы на гистограмме морфологических характеристик клеток по показателям светорассеяния (прямого FSC и углового SSC), отличающим их от основных субпопуляций ядросодержащих клеток костного мозга (рис. 5). На рисунке 5 обращает на себя внимание присутствие необычной популяции клеток (область обозначена красным цветом), обладающих значительным размером (крайнее правое положение по оси FSC относительно основных популяций) и гранулярностью, соответствующей моноцитам. На гистограмме CD45/SSC (гистограмма Б) ПК обычно занимают крайнее левое положение, так как обладают крайне низким уровнем экспрессии CD45 или негативны по данному маркеру.
Уровень экспрессии CD45 на поверхности плазматических клеток соответствует гранулоцитам и может быть расценен как CD45dim (слабая экспрессия). Основным этапом ИФТ костного мозга больных ММ является анализ экспрессии CD38, CD138 и CD19. В первую очередь проводят оценку гистограммы CD138/SSC, так как именно CD138 (синдекан-1) является основным маркером ПК. Тем не менее только выявление одновременной экспрессии CD38 и CD138 позволяет уверенно отделить ПК от В-клеточных предшественников и от других лейкоцитов. Для последующего анализа создают логическое ограничение (гейт), объединяющее CD138+-клетки с определенными характеристиками светорассеяния. Позитивная экспрессия CD38служит подтверждением принадлежности исследуемой популяции к ПК. Выявление популяции клеток с измененными характеристиками светорассеяния и суммарным фенотипом CD45-CD38+CD138+ позволяет верифицировать присутствие трансформированных ПК в исследуемом образце.
Интерпретация данных экспрессии CD19 при верификации миеломных клеток нередко вызывает затруднения. Несмотря на то что отсутствие экспрессии CD19 принято считать стандартом для выявления трансформированных ПК, необходимо учитывать, что экспрессия CD19 при ММ может сохраняться примерно в 15% случаев. Более того, к настоящему времени экспрессия CD19 определена у значительной части больных ММ в Северо-Западном регионе РФ [15].
Заключительным этапом анализа данных ИФТ является количественное определение содержания трансформированных клеток среди мононуклеаров. Полученные данные могут быть в дальнейшем использованы для оценки эффективности проводимого лечения: при исследовании МОБ экспрессию указанных маркеров оценивают для событий, определенных по гейту мононуклеаров. При анализе трансформированных клеток следует учитывать возможность выявления неоднородного уровня экспрессии исследуемых маркеров. Интерпретация полученных данных в таких случаях представляет значительную трудность, однако при определении позитивности окрашивания следует опираться на результаты изотипического контроля. Моноклональные антитела к антигенам CD45, CD19, CD38 и CD138 практически всегда могут быть использованы для диагностики ММ до проведения терапии, однако их использование для диагностики МОБ не всегда возможно. Связано это, прежде всего, с тем, что в редких случаях трансформированные клетки при ММ экспрессируют CD45 на очень низком уровне, а нормальные ПК могут быть позитивны по CD19.
При значительном количестве опухолевых клеток в костном мозге использование представленной выше стратегии логических ограничений (гейтирования) позволяет верифицировать и оценить иммунофенотип трансформированных клеток, опираясь на возможность комплексной оценки параметров светорассеяния и экспрессии указанных маркеров. При диагностике МОБ после проведения соответствующего лечения учет трансформированных клеток и нормальных ПК проводят среди мононуклеаров, что затрудняет идентификацию малоклеточной популяции ПК. Для корректного выделения нормальных и трансформированных ПК необходимо анализировать не менее 500 000 событий и применять в составе сочетаний моноклональных антител дополнительно маркер CD56, причем лучше в комбинации с CD45 (например, CD45/CD138/CD56, CD38/CD56/CD138, CD45/CD56/CD19). С помощью такой панели антител можно не только выявить сами ПК, но и с использованием маркеров CD56 и CD117 разделить сохранные и трансформированные ПК.
Стандарт лабораторного обследования пациентов с подозрением на моноклональную гаммапатию основан на рекомендациях Международной рабочей группы по множественной миеломе [17]: определение концентрации иммуноглобулинов A, M, G; протеинограмма – белковые фракции, общий белок, количественное определение свободных легких цепей каппа и лямбда. Однако среди пациентов, у которых белковые фракции находятся в пределах биологических референтных интервалов, или в случае гипогаммаглобулинемии моноклональный белок может быть выявлен только с помощью иммунофиксации [18].
В работе R. Lakshminarayanan и соавт. пациенты с первично верифицированной ММ были разделены на три группы в зависимости от уровня гаммаглобулинов: больные со сниженным уровнем фракции гаммаглобулинов (гипогаммаглобулинемия), больные с сохранным уровнем белков фракции гаммаглобулинов и больные с повышенным уровнем белков фракции гаммаглобулинов (гипергаммаглобулинемия) [19]. У 10% больных ММ, обследованных авторами, была выявлена гипогаммаглобулинемия, столько же приходится на долю пациентов с нормальной протеинограммой белков. Нельзя не согласиться с мнением авторов, согласно которому пациенты с нормальной протеинограммой представляют очень сложную для диагностики и мониторинга группу: у пациентов с увеличенным уровнем β-1-глобулина, а особенно β-2-глобулина, может быть моноклональный белок, «маскирующийся» за полосами, соответствующими β-глобулинам.
При гипогаммаглобулинемии и при нормальных результатах протеинограммы у больных ММ рекомендовано проведение иммунофиксации [18]. H. Steingrimsdottir и соавт. сопоставили результаты классического электрофореза и иммунофиксации при диагностике 65 образцов сыворотки больных с ММ и 10 образцов сыворотки пациентов с диагнозом «макроглобулинемия Вальденстрема». Моноклональный белок был найден в 28% и 46% образцов при использовании классического электрофореза и иммунофиксации соответственно [20]. Моноклональный белок типа IgA был выявлен в 33,4% случаев, IgG – в 57% и IgM – в 8,5%, что сопоставимо с нашими данными [21].
Внедрение в рутинную практику новых высокотехнологичных методов лабораторных исследований во многом меняет наше отношение к основным положениям собственно диагностики ММ и МОБ. Именно поэтому нами рассмотрены возможности иммунофиксации и проточной цитометрии для диагностики и мониторинга ММ [22]. Известно, что критерием полной ремиссии при ММ является исчезновение парапротеина в сыворотке и моче и содержание ПК менее 5% в костном мозге. Однако чувствительность электрофореза и морфологического исследования костного мозга, в большинстве случаев достаточная для диагностики заболевания, оказывается слишком низкой для оценки эффективности химиотерапии и диагностики МОБ (табл. 3). Согласно данным J. Blade и соавт. [23] и J. J. Lahuerta и соавт. [24], проведен ретроспективный анализ данных пациентов, которые по результатам электрофореза были расценены как достигшие полной ремиссии, а по результатам иммунофиксации – как достигшие частичной ремиссии, эти пациенты обладали такими же характеристиками выживаемости, как и больные с частичной ремиссией.
На сегодняшний день показано, что отрицательные результаты иммунофиксации являются независимым фактором положительного прогноза бессобытийной выживаемости больных ММ. Таким образом, формируется новая трехступенчатая классификация ответа при ведении больных ММ: полный ответ, при котором результаты электрофореза и иммунофиксации отрицательные; любой вариант неполного ответа и отсутствие ответа [25]. Ремиссия ММ подтверждается с помощью классического электрофореза, определения концентрации ИГ и иммунофиксации. Образцам, в которых выявлен повышенный уровень ИГ, а поликлональность не показана при электрофорезе, рекомендовано проведение иммунофиксации для определения типа моноклонального компонента.
ИФТ костного мозга при диагностике ММ востребовано в рутинной онкогематологической практике и основано на различиях фенотипа нормальных и трансформированных ПК (табл. 4) [26].
Обобщая данную информацию, можно сказать, что основными иммунофенотипическими особенностями созревания ПК в норме являются [27]:
- постепенная утрата экспрессии В-ассоциированных маркеров;
- снижение экспрессии CD45;
- усиление экспрессии CD38 и CD138, то есть иммунофенотип ПК может быть описан как CD45dim+↓CD38bright+CD138+CD19-CD20-CD56-CD117- или CD45-CD38+CD138+.
Использование мультипараметрической проточной цитометрии позволяет выявить трансформированные клетки, определить их фенотип и относительное содержание среди ядросодержащих клеток костного мозга популяций клеток низкой и промежуточной гранулярности [28]. При ИФТ костного мозга пациентов ММ до начала терапии методом многоцветной проточной цитометрии особое внимание следует уделить следующим аспектам:
- необходимость учета не менее 50 000 событий (на самом деле желательно набирать столько событий, чтобы выявляемые ПК формировали отчетливый кластер (не менее 20 событий) с минимально возможным коэффициентом вариации);
- возможность гетерогенной экспрессии исследуемых маркеров;
- необходимость количественного учета относительного содержания трансформированных клеток среди мононуклеаров.
На сегодняшний день информативность отдельных маркеров может быть кратко обобщена следующим образом (табл. 5). По данным большинства авторов, наличие экспрессии CD45, CD56, CD117 на трансформированных ПК ассоциировано с благоприятным прогнозом, а полная потеря экспрессии CD45 и CD56 ассоциирована с быстрой прогрессией заболевания и плохим прогнозом.
Диагностика ММ не может быть осуществлена на основании только одного методического подхода, исследования только одного биологического материала [29]. Именно поэтому параллельно с иммунофенотипированием клеток костного мозга проводят исследование сыворотки крови (или мочи) методом иммунофиксации для выявления моноклонального характера продукции белка [30]. Таким образом, реализация возможностей иммунологической лаборатории позволяет получать данные, необходимые для верификации диагноза ММ и достижения клинико-иммунологической ремиссии, в соответствии с современными требованиями клиники.