Влияние коморбидности и периоперационных рисков на выбор этапности хирургического лечения пожилых кардиоонкологических пациентов
- Аннотация
- Статья
- Ссылки
- English

Введение
В течение последних десятилетий сердечно-сосудистые заболевания (ССЗ) и злокачественные новообразования остаются лидирующими причинами смерти в мире. По данным Всемирной организации здравоохранения (ВОЗ), ежегодно от ССЗ умирает свыше 17 млн человек [1]. По прогнозам, к 2030 г. этот показатель возрастет до 23 млн [2].
Колоректальный рак (КРР) относится к наиболее распространенным видам рака в мире: он занимает 3-е место в структуре общей онкологической заболеваемости и является второй причиной смерти от опухолевых заболеваний. ССЗ у онкологических больных – вторая по частоте причина смерти. Согласно статистике ВОЗ, к 2030 г., как и в случае с ССЗ, частота КРР возрастет на 60%. Это означает возникновение более чем 2,2 млн новых случаев рака и примерно 1,1 млн смертей ежегодно [2]. Чаще всего КРР диагностируется у лиц старше 60 лет. Именно в этом возрасте обнаруживается несколько сопутствующих хронических заболеваний, в частности со стороны сердечно-сосудистой (СС) системы, не только влияющих на тактику лечения, но и определяющих этапность, эффективность и долгосрочные результаты лечения по поводу КРР и СС патологии [3].
Цель публикации данного клинического случая – акцентировать внимание многопрофильных специалистов на скрининге, мониторинге и этапности выбора оптимальной тактики лечения пожилых кардиоонкологических пациентов с КРР и тяжелой коморбидной СС патологией.
Клинический случай
Пациент Р. 1950 г.р. до обращения в Российский научный центр хирургии (РНЦХ) им. академика Б.В. Петровского наблюдался у кардиолога по месту жительства с диагнозом: гипертрофическая кардиомиопатия с обструкцией выводящего тракта (ОВТ) левого желудочка (ЛЖ). Относительная недостаточность митрального клапана 3-й степени. Ишемическая болезнь сердца: стенокардия напряжения функционального класса (ФК) II. Хроническая сердечная недостаточность (ХСН) с сохраненной фракцией выброса (ФВ) ЛЖ.
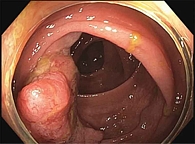
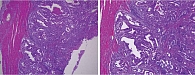
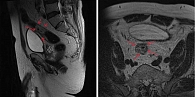
Постоянно принимал бисопролол 2,5 мг/сут, периндоприл 5 мг/сут, торасемид 5 мг/сут, аторвастатин 20 мг/сут. В марте 2022 г. в связи с клиникой декомпенсации ХСН госпитализирован в стационар по месту жительства, где впервые были выявлены железодефицитная анемия, скрытая кровь в кале. По данным колоноскопии: в прямой кишке на расстоянии 9–14 см от ануса блюдцеобразной формы полуциркулярно растущее эпителиальное образование размером 35 × 50 мм, имеющее вид язвенного дефекта с неравномерным дном, края бугристые, инфильтрационные, возвышающиеся над уровнем слизистой (рис. 1). В ходе морфологического исследования диагностирована аденокарцинома умеренной степени дифференцировки опухоли с изъязвлением и прорастанием в околокишечную клетчатку (рис. 2). При выполнении магнитно-резонансной томографии брюшной полости и органов малого таза данных об отдаленных метастазах не получено, выявлены образование в верхнеампулярном отделе прямой кишки, левосторонняя паховая грыжа, мелкая киста в S8 печени (рис. 3). Результаты компьютерной томографии (КТ) органов грудной клетки: умеренные пневмофиброзные изменения легочной ткани, атерокальциноз аорты и коронарных артерий, небольшая грыжа пищеводного отверстия диафрагмы.
Пациент был направлен в отделение колопроктологии с хирургией тазового дна РНЦХ им. академика Б.В. Петровского для решения вопроса о хирургическом лечении КРР. Данные выполненной в РНЦХ им. академика Б.В. Петровского эхокардиографии (ЭхоКГ) с провокационными пробами: исходный диагноз гипертрофической кардиомиопатии с ОВТ ЛЖ исключен; конечный диастолический объем ЛЖ – 103 мл, конечный систолический объем ЛЖ – 31 мл, ударный объем ЛЖ – 72 мл, ФВ ЛЖ – 70% (по Симпсону); систолическое давление в легочной артерии (СДЛА) – 53 мм рт. ст. Впервые выявлены сочетанный аортально-митрально-трикуспидальный порок сердца: аортальный стеноз (Sао – 1,5 см²), аортальная недостаточность 2-й степени, пролапс митрального клапана 3-й степени с атриомегалией, концентрической гипертрофией миокарда ЛЖ, преимущественно в области межжелудочковой перегородки без признаков ОВТ ЛЖ и внутрижелудочковой обструкции, трикуспидальная недостаточность 3-й степени. При выполнении стресс-ЭхоКГ пробы с физической нагрузкой данных о нарушении глобальной и локальной систолической функции ЛЖ, обструкции выходного тракта не получено. На пике нагрузки митральная, аортальная и трикуспидальная недостаточность – без существенной динамики по сравнению с вышеописанными исходными данными.
Таким образом, сформулирован клинический диагноз:
- основной диагноз: рак прямой кишки pТ3N0 сM0 стадии II;
- сопутствующие заболевания: атеросклероз аорты, брахиоцефальных артерий. Сочетанный аортально-митрально-трикуспидальный порок сердца. Пролапс створок митрального клапана с формированием недостаточности 3-й степени. Относительная трикуспидальная недостаточность 3-й степени. Легочная гипертензия 1-й степени. Комбинированный дегенеративный порок аортального клапана с преобладанием недостаточности 2–3-й степени, незначительный стеноз аортального клапана. ХСН с сохранной ФВ ЛЖ, II ФК по NYHA. Железодефицитная анемия.
Мультидисциплинарным кардиоонкологическим консилиумом центра, состоящим из кардиологов, сердечно-сосудистых и абдоминальных хирургов, онкологов, анестезиологов-реаниматологов, было принято решение на первом этапе выполнить резекцию КРР, на втором – провести хирургическое лечение порока сердца в условиях искусственного кровообращения (ИК).
25 мая 2022 г. в РНЦХ им. академика Б.В. Петровского выполнены робот-ассистированная передняя резекция прямой кишки и превентивная илеостомия. Послеоперационный период протекал на фоне явлений пареза верхних отделов желудочно-кишечного тракта, дисфункции илеостомы (купированы на фоне инфузионной терапии, декомпрессии желудка назогастральным зондом). Пациент выписан в удовлетворительном состоянии под наблюдение врачей по месту жительства с последующей консультацией врача-онколога для решения вопроса об объеме и сроках проведения химиотерапевтического лечения.
10 августа 2022 г. после первого сеанса химиотерапии у пациента развилась острая почечная недостаточность, по поводу чего получил сеансы гемодиализа с положительной динамикой. Впоследствии наблюдался у врачей по месту жительства, периодически отмечал приступы учащенного неритмичного сердцебиения, отеки нижних конечностей и одышку при физической нагрузке (быстрая ходьба до 300 метров). При обследовании по месту жительства, по данным холтеровского мониторирования электрокардиограммы (ХМ ЭКГ), зарегистрирован синусовый ритм с короткими эпизодами (до 10 минут) пароксизмов фибрилляции предсердий (ФП), в связи с чем по каналу телемедицины кардиологом РНЦХ им. академика Б.В. Петровского скорректирована доза бета-блокаторов с увеличением суточного приема бисопролола до 5 мг. Назначена антикоагулянтная терапия: апиксабан 5 мг два раза в день.
Из-за высокого риска развития СС осложнений по шкале RCRI, в частности тромбоэмболических, и прогрессирования нарушений ритма сердца в послеоперационном периоде на фоне электролитных нарушений, связанных с наличием колостомы, в ноябре 2022 г. кардиоонкологической командой было принято решение о ее досрочном закрытии в условиях РНЦХ им. академика Б.В. Петровского.
В июне 2023 г. в связи с прогрессированием клинических признаков ХСН на фоне сочетанного аортально-митрально-трикуспидального порока сердца и пароксизмальной тахисистолической формы ФП пациент был госпитализирован в отделение хирургии пороков сердца РНЦХ им. академика Б.В. Петровского для выполнения второго этапа лечения – кардиохирургического вмешательства в условиях ИК.
Результаты предоперационной ЭхоКГ (исследование проведено на фоне тахисистолической формы ФП с частотой сердечных сокращений (ЧСС) до 150 в минуту) по сравнению с данными от 2022 г. показали снижение ФВ ЛЖ до 48%, дилатацию правых камер сердца с формированием трикуспидальной недостаточности 2–3-й степени, повышение СДЛА до 45 мм рт. ст., эффект спонтанного эхо-контрастирования в левых камерах сердца.
Результаты селективной коронарографии: правый тип кровоснабжения сердца, передняя нисходящая артерия имеет неровности контуров в среднем сегменте, остальные коронарные артерии не изменены.
При выполнении дуплексного сканирования (ДС) брахиоцефальных артерий выявлены ультразвуковые (УЗ) признаки умеренно выраженных атеросклеротических изменений с максимальным стенозом правой внутренней сонной артерии (ВСА) до 40%, левой ВСА и правой подключичной артерии до 30%. ДС артерий нижних конечностей: УЗ-признаки умеренно выраженных атеросклеротических изменений со стенозами общей бедренной и глубокой бедренной артерий до 30%.
После проведенного дообследования был сформулирован клинический диагноз:
- основное заболевание: синдром соединительнотканной дисплазии. Сочетанный аортально-митрально-трикуспидальный порок сердца. Пролапс створок митрального клапана с формированием митральной недостаточности 3-й степени. Относительная трикуспидальная недостаточность 3-й степени. Легочная гипертензия 1-й степени. Комбинированный дегенеративный порок аортального клапана с преобладанием недостаточности 2-й степени, незначительный стеноз аортального клапана (Sао – 1,6 см²). Гипертоническая болезнь стадии III, контролируемая артериальная гипертензия, риск сердечно-сосудистых осложнений (ССО) – 4. Атеросклероз коронарных артерий, брахиоцефальных артерий, артерий нижних конечностей. Нарушение ритма сердца: пароксизмальная форма ФП. CHA2DS2-VASc – 4 балла. HAS-BLED – 2 балла. ХСН с промежуточной ФВ ЛЖ, ФК III по NYHA;
- сопутствующие заболевания: рак прямой кишки pТ3N0 сM0 стадии II. Состояние после робот-ассистированной передней резекции прямой кишки, превентивной илеостомии (май 2022 г.), закрытия колостомы (ноябрь 2022 г.). Хроническая болезнь почек стадии IIIА (скорость клубочковой фильтрации – 47,6 мл/мин/1,73м2).
В июле 2023 г. в условиях ИК выполнена операция протезирования митрального клапана с сохранением задней створки (механический протез SJM Masters 29), пластики трикуспидального клапана по Де-Вега, парааннулярной пластики левого предсердия, резекции ушка левого предсердия, криоаблация по методике Cox-Maze IV. Ближайшие сутки послеоперационного периода в отделении реанимации и интенсивной терапии (ОРИТ) протекали без осложнений. На вторые сутки после операции пациент был переведен в отделение, однако через несколько часов на фоне отсутствия сознания и дыхания (обнаружено дежурным медицинским персоналом, в палате начат непрямой массаж сердца) был экстренно переведен в ОРИТ. На ЭКГ-мониторе – желудочковая тахикардия с широкими комплексами и ЧСС до 160 в минуту. Выполнена электроимпульсная терапия с восстановлением синусового ритма, подключен к аппарату искусственной вентиляции легких, начаты внутривенная инфузия амиодарона и кардиотоническая поддержка с положительной динамикой. На седьмые сутки после операции переведен в палату. Послеоперационный госпитальный период протекал без осложнений. По результатам контрольной ЭхоКГ при выписке: гемодинамические параметры на протезе митрального клапана в пределах нормы (Vmax – 1,75 м/с, PGr – 12,2/5,2 мм рт. ст., Sмо – 3,0 см²), гемодинамические параметры на трикуспидальном клапане удовлетворительные (диаметр фиброзного кольца трехстворчатого клапана – 32 мм, Vmax – 0,4 м/с, PGr – 0,7/0,6 мм рт. ст.), трикуспидальная недостаточность 1-й степени. В послеоперационном периоде пациенту оптимизировали медикаментозную терапию с назначением бета-блокаторов, петлевых диуретиков, ингибиторов ангиотензинпревращающего фермента (АПФ), антиаритмических препаратов, блокаторов альдостерона. Выполнен персонализированный подбор антикоагулянтов под контролем международного нормализованного отношения. На десятые сутки после операции выписан из стационара в удовлетворительном состоянии без убедительных данных о наличии затяжных приступов стенокардии, гемодинамически значимых нарушениях ритма сердца и проводимости, нарастании клинических признаков недостаточности кровообращения под наблюдение врачей по месту жительства.
В дальнейшем пациент наблюдался у врачей по месту жительства и в РНЦХ им. академика Б.В. Петровского.
В октябре 2023 г. в плановом порядке обратился к кардиологу РНЦХ по поводу приступов неритмичного сердцебиения, одышки при физической нагрузке (быстрая ходьба до 500 метров). На приеме выполнена коррекция кардиальной терапии. Из-за недостижения целевого уровня ЧСС отменен бисопролол и назначен метопролол 100 мг/сут. Для контроля ритма продолжен прием амиодарона 100 мг пять дней в неделю, в связи с сохраняющейся тенденцией к суточной гипотензии снижена доза периндоприла до 2,5 мг/сут. По поводу клинической симптоматики ХСН на фоне ФВ ЛЖ 48% и повышенного уровня NT-proBNP до 903,8 пг/мл к терапии добавлен дапаглифлозин 10 мг. Через шесть месяцев на фоне вышеописанной оптимизации кардиальной терапии в анализах крови отмечалась положительная динамика в виде снижения уровня NT-proBNP до 688 пг/мл.
Результаты ЭхоКГ (май 2024 г.): увеличение ФВ ЛЖ – 70%, снижение СДЛА до 38 мм рт, ст., гемодинамические параметры и функции механического протеза SJM Masters – 29 в пределах нормы (PGr – 12,0/3,4 мм рт. ст., Sмо – 3,5 см²), сохраняется дилатация полостей обоих предсердий (индекс объема левого предсердия – 65,9 мл/м2, правого – 47,7 мл/м2), аортальная недостаточность 2-й степени, гемодинамические параметры на трикуспидальном клапане удовлетворительные – Vmax – 0,8 м/с, PGr – 3,2 мм рт. ст., PGr TR – 33 мм рт. ст., трикуспидальная недостаточность 1-й степени.
Данные ХМ ЭКГ (май 2024 г.): синусовый ритм с эпизодами миграции водителя ритма (синусовый узел – АВ-соединение) (рис. 4), зафиксированы 46 эпизодов СА-блокады с паузами до 2 секунд, наджелудочковая эктопическая активность, представленная 288 одиночными сокращениями. Диагностически значимая динамика сегмента ST не выявлена.
Обсуждение
Высокий уровень заболеваемости и распространенности злокачественных новообразований и ССЗ, а также их частая встречаемость у одного пациента, особенно пожилого возраста, объясняется наличием общих факторов риска (артериальная гипертензия, ожирение, сахарный диабет, дислипидемия, гиподинамия, злоупотребление алкоголем, табакокурение), генетических особенностей и схожестью биологических путей развития указанных нозологий [4, 5]
В исследовании R. Florido и соавт. среди пациентов, особенно пожилого возраста, перенесших рак, отмечался более высокий риск развития сердечной недостаточности и других ССЗ. Как показал анализ медицинских параметров 12 000 пациентов, онкологические пациенты представляют группу высокого риска развития ССЗ. Кроме того, у пациентов с КРР по сравнению с другими видами рака достоверно более высокий риск развития СС патологии [6].
В представленном клиническом случае пожилой пациент без предшествующего онкологического анамнеза поступил в стационар по месту жительства с клиническими признаками декомпенсации ХСН, где ему диагностировали гипертрофическую кардиомиопатию с ОВТ ЛЖ и рекомендовали кардиохирургическое лечение в условиях ИК. При прохождении предоперационного дообследования для выполнения планового хирургического лечения порока сердца впервые выявлена анемия с положительным анализом кала на скрытую кровь. На основании данных колоноскопии с последующим гистологическим исследованием выявленного новообразования диагностирована аденокарцинома прямой кишки.
Для уточнения диагноза со стороны СС системы в РНЦХ им. академика Б.В. Петровского была выполнена ЭхоКГ, в том числе с провокационными пробами, по данным которой исходный диагноз гипертрофической кардиомиопатии с ОВТ ЛЖ был исключен и впервые диагностирован сочетанный трехклапанный порок сердца с легочной гипертензией 1-й степени.
Полученные данные кардинально изменили исходно выбранную тактику лечения, что повлияло и на этапность выбора хирургического вмешательства у ослабленного полиморбидного кардиоонкологического пациента.
В настоящее время пороки клапанов сердца, в частности аортально-митрально-трикуспидального, являются одной из самых часто встречающихся сердечных патологий. Пороки у лиц, госпитализированных в стационар кардиологического и кардиохирургического профиля или наблюдаемых амбулаторно, отмечаются в 34,3% случаев [7].
Для пациентов с трехклапанными пороками характерно развитие суправентрикулярных аритмий, в частности ФП, на долю которой приходится 30–40% случаев [8].
Развитие ФП у таких больных обусловлено перерастяжением левого предсердия, поэтому своевременное устранение данного патогенетического фактора может привести к нормализации сердечного ритма [9].
ФП также является частым самостоятельным осложнением после хирургических вмешательств [10]. Считается, что в большинстве случаев развитие ФП потенцируется сочетанием множества механизмов и факторов. Именно интраоперационные триггеры, такие как управляемая гипотензия, анемия, травматизация и болевой синдром, могут непосредственно влиять на формирование патологического аритмогенного субстрата [11].
Согласно данным как национальных, так и международных исследований, именно ССО считаются ведущими в структуре периоперационной смертности при экстракардиальной хирургии [12]. Актуальными международными градациями увеличения периоперационного риска ССО является пересмотренный индекс сердечного риска (Revised Cardiac Risk Index, RCRI) [13].
У нашего пациента с трехклапанным пороком сердца, прооперированного по поводу КРР, в отдаленном периоде развилась пароксизмальная форма ФП. При расчете стратификации 30-дневного риска развития и прогрессирования ССО по шкале RCRI в послеоперационном периоде выявлен высокий риск – III, риск основных сердечных событий – 10%, индекс коморбидности Чарлсона – 9 баллов. В связи с этим в ноябре 2022 г. в РНЦХ им. академика Б.В. Петровского досрочно выполнено закрытие колостомы для снижения прогрессирования электролитных нарушений.
K. Singh и соавт. (2020) проанализировали 52 исследования с участием в общей сложности 11 459 306 пациентов и доказали, что использование статинов снижает риск развития КРР на 60% у пациентов с воспалительным заболеванием кишечника и на 20% у пациентов без этого заболевания [14].
R. Balkrishnan и соавт. использовали базу данных Medicare Surveillance, Epidemiology, and End-Results (SEER) для обзора результатов лечения 13 982 пациентов в возрасте 65 лет и старше с диагностированным КРР в период с 1 января 2007 г. по 31 декабря 2012 г. Показано, что гипотензивная терапия ингибиторами АПФ, бета-блокаторами и тиазидными диуретиками способствует повышению показателей выживаемости среди пациентов с КРР и снижает риск развития и прогрессирования ССЗ. Онкологические пациенты, принимающие данную кардиальную терапию, имеют более низкий риск смертности от рака [15].
В представленном клиническом случае пациент получал оптимизированную кардиальную терапию на всех этапах кардиоонкомониторирования, включая ингибиторы АПФ, бета-блокаторы и статины.
Важным современным принципом химиотерапии является применение максимально переносимых доз цитостатиков, характеризующихся широким спектром побочных явлений, определяемых как токсичность химиотерапии. Наиболее частыми осложнениями полихимиотерапии являются миелосупрессия, поражение кожи и ее придатков (алопеция, ониходистрофии), слизистых оболочек, гастроинтестинальная токсичность, кардио-, нейро-, нефро- и гепатотоксичность, коагулопатии, тератогенные и канцерогенные эффекты [16]. У нашего пациента во время первого курса химиотерапии развилась острая почечная недостаточность, потребовавшая проведения нескольких сеансов гемодиализа с положительным клиническим исходом и формированием хронической болезни почек стадии IIIА.
Несмотря на высокотехнологичные достижения в области хирургии и появление новых классов противоопухолевых препаратов, в частности молекулярно-таргетных, показатели пятилетней общей выживаемости пациентов с резектабельными стадиями рака толстой кишки остаются на уровне 60% [17]. Сердечно-сосудистая патология – вторая по значимости причина смерти больных раком на всех стадиях заболевания.
В силу неблагоприятных последствий онкохирургического лечения и полихимиотерапии, системного влияния рака на организм человека, частой СС коморбидности внимание специалистов должно быть сосредоточено на проблеме развития и прогрессирования уже имеющейся СС патологии.
Заключение
У кардиоонкологических пожилых пациентов мультиморбидность не только определяет течение и прогноз злокачественных опухолей и ССЗ, но и нередко влияет на выбор тактики ведения, последовательности хирургического лечения и оптимизацию медикаментозной терапии. В частности, сопутствующая хроническая сердечная недостаточность на фоне сочетанного порока сердца в значительной мере отягощает течение послеоперационного периода у пациентов с КРР. В ряде случаев имеющаяся патология сочетается с артериальной гипертензией, ФП, анемией, которые являются независимыми факторами риска развития жизнеугрожающих осложнений.
Представленный клинический случай демонстрирует вклад мультидисциплинарной кардиоонкологической команды в персонифицированную оценку полученных клинико-инструментальных и лабораторных данных на всех этапах стационарного хирургического лечения, амбулаторного мониторинга для стратификации риска возможных периоперационных осложнений у пожилых кардиоонкологических пациентов. Это позволяет замедлить прогрессирование коморбидных заболеваний и увеличить долгосрочный прогноз выживаемости.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование проведено при поддержке Минобрнауки России (FURG-2023-0002).
S.A. Tsatsurova, A.A. Sumbaev, A.L. Bedzhanyan, Ye.A. Tyurina, Ye.P. Evseev, Yu.V. Frolova
B.V. Petrovsky National Research Center of Surgery
Contact person: Sabrina A. Tsatsurova, tsatsurova99@list.ru
As the population ages, the incidence of cardiovascular disease, malignancies, and other chronic pathological nosologies increases dramatically. The increasing prevalence of common risk factors, pathogenetic developmental mechanisms and genetic features contribute to the development of cardiovascular pathology and colorectal cancer in one patient. The article presents a clinical case of successful staged surgical treatment of colorectal cancer and combined heart disease in a 74-year-old comorbid patient at a multidisciplinary surgical center. Clinical and diagnostic and laboratory features of cardio-oncological patient management have been described, which made it possible to minimize perioperative risks of complications at all stages of oncological and cardiological surgical interventions due to a personalized approach on the part of a multidisciplinary cardiology team.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.