Модификация рациона больных синдромом избыточного бактериального роста как фактор повышения эффективности лечения
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Использованы данные обследования больных с избыточным ростом метаногенной флоры в тонкой кишке (СИБР-CH4). Наличие СИБР-СH4 подтверждено при проведении дыхательного теста с лактулозой (GastroCH4eck, Bedfond, Великобритания). Все пациенты получали лечение препаратом, содержащим тилихинол 100 мг и тилброхинол 200 мг (Интетрикс), по две капсулы два раза в день после еды в течение десяти дней, далее препарат Saccharomyces boulardii (Энтерол 250 мг) по одной капсуле три раза в день в течение трех недель. Пациенты были рандомизированы на две группы. В первой группе (группа Д) в дополнение к терапии назначали индивидуализированный изокалорийный рацион, модифицированный по продуктовому составу. Пациенты второй группы (группа К) придерживались привычного рациона. Проведено межгрупповое сравнение частоты устранения СИБР и динамики симптомов в процессе лечения.
Результаты. В исследовании участвовало 112 пациентов. Конечному анализу были доступны данные 41 больного: 17 из них (шесть мужчин и 11 женщин, средний возраст (Mean ± SD) – 42,7 ± 13,1 года) группы Д и 24 (семь мужчин и 17 женщин, возраст – 45,6 ± 12,6 года) группы К. Устранение СИБР достигнуто у шести (35,2%) из 17 пациентов группы Д и лишь у пяти (20,8%) из 24 группы без модификации рациона (p = 0,30). В группе Д отмечалось достоверное увеличение частоты стула (M ± SD: 0,6 ± 0,3 в день исходно, 1,1 ± 0,6 после двух недель лечения; p = 0,001), индекса Бристольской шкалы кала (2,5 ± 1,2 исходно, 3,6 ± 1,2 через две недели лечения; p = 0,001) и уменьшение чувства неполного опорожнения кишечника при дефекации (с 2,2 ± 0,9 до 1,7 ± 0,9; р = 0,01). В группе К достоверная динамика по этим параметрам не достигнута.
Заключение. У больных СИБР метаногенной флоры использование специализированного рациона может способствовать снижению выраженности симптомов на фоне терапии тилихинолом/тилброхинолом, а также повышению эффективности лечения СИБР.
Материал и методы. Использованы данные обследования больных с избыточным ростом метаногенной флоры в тонкой кишке (СИБР-CH4). Наличие СИБР-СH4 подтверждено при проведении дыхательного теста с лактулозой (GastroCH4eck, Bedfond, Великобритания). Все пациенты получали лечение препаратом, содержащим тилихинол 100 мг и тилброхинол 200 мг (Интетрикс), по две капсулы два раза в день после еды в течение десяти дней, далее препарат Saccharomyces boulardii (Энтерол 250 мг) по одной капсуле три раза в день в течение трех недель. Пациенты были рандомизированы на две группы. В первой группе (группа Д) в дополнение к терапии назначали индивидуализированный изокалорийный рацион, модифицированный по продуктовому составу. Пациенты второй группы (группа К) придерживались привычного рациона. Проведено межгрупповое сравнение частоты устранения СИБР и динамики симптомов в процессе лечения.
Результаты. В исследовании участвовало 112 пациентов. Конечному анализу были доступны данные 41 больного: 17 из них (шесть мужчин и 11 женщин, средний возраст (Mean ± SD) – 42,7 ± 13,1 года) группы Д и 24 (семь мужчин и 17 женщин, возраст – 45,6 ± 12,6 года) группы К. Устранение СИБР достигнуто у шести (35,2%) из 17 пациентов группы Д и лишь у пяти (20,8%) из 24 группы без модификации рациона (p = 0,30). В группе Д отмечалось достоверное увеличение частоты стула (M ± SD: 0,6 ± 0,3 в день исходно, 1,1 ± 0,6 после двух недель лечения; p = 0,001), индекса Бристольской шкалы кала (2,5 ± 1,2 исходно, 3,6 ± 1,2 через две недели лечения; p = 0,001) и уменьшение чувства неполного опорожнения кишечника при дефекации (с 2,2 ± 0,9 до 1,7 ± 0,9; р = 0,01). В группе К достоверная динамика по этим параметрам не достигнута.
Заключение. У больных СИБР метаногенной флоры использование специализированного рациона может способствовать снижению выраженности симптомов на фоне терапии тилихинолом/тилброхинолом, а также повышению эффективности лечения СИБР.
Введение
Синдром избыточного бактериального роста (СИБР) в тонкой кишке представляет собой патологическое состояние, обусловленное увеличением плотности колонизации тонкой кишки микрофлорой (более 105 КОЕ/мл кишечного аспирата), что может сопровождаться существенным снижением качества жизни больных из-за соответствующих клинических проявлений [1]. К наиболее частым клиническим проявлениям СИБР относятся изменение частоты и консистенции стула, боль в животе тянущего характера, вызванная перерастяжением кишечной стенки, избыточное газообразование, а также состояния, обусловленные уменьшением поступления макро- и микронутриентов вследствие их ускоренного выведения и избыточной утилизации микрофлорой [1].
По данным литературы, распространенность СИБР значительно варьируется и может достигать 84% у больных гастроэнтерологического профиля [2]. Устранение СИБР способствует существенному уменьшению выраженности симптомов, характеризующих данное состояние, и сопровождается повышением качества жизни пациентов [3, 4].
Избыточную продукцию водорода, метана или обоих газов определяют с помощью дыхательного теста с лактулозой. На основании такого теста выделяют соответственно три варианта СИБР [5]. В настоящее время для устранения СИБР используют антибактериальные препараты различных фармакологических групп [4]. При этом эффективность терапии может существенно отличаться при разных вариантах СИБР, но в целом не превышает 80% [4].
Считается, что гиперпродукция метана связана с избыточной колонизацией тонкой кишки археями [5]. Со структурными особенностями данных микроорганизмов может быть связана меньшая эффективность антибактериальных препаратов в устранении СИБР с гиперпродукцией метана [6]. Повысить эффективность терапии позволяет диета. Действительно, формированию состава кишечной флоры может способствовать паттерн питания человека [7–9].
Результаты ранее опубликованных исследований подтверждают зависимость между структурой питания и вероятностью выявления СИБР [10]. К факторам, обусловливающим более высокие шансы наличия СИБР, относят низкое потребление пищевых волокон, высокую частоту потребления блюд из красного мяса и употребление субтропических фруктов (гранат, киви). Кроме того, анализ паттернов питания демонстрирует достоверные отличия при разных вариантах СИБР. Привычные рационы у больных СИБР с гиперпродукцией метана характеризуются достоверно бόльшим потреблением лука, огурцов, томатов, кабачков, сладкого перца, семечковых фруктов (яблоки, груши и т.д.) и достоверно меньшим потреблением красного мяса (говядина и свинина) по сравнению с теми, у кого выявлен СИБР с избыточным ростом водород-продуцирующей флоры, и теми, у кого признаки СИБР отсутствуют [10].
Указанные особенности позволяют предположить увеличение эффективности лечения на фоне диетотерапии. Между тем в доступной литературе нами обнаружены лишь единичные работы по этой теме. Кроме того, в таких работах не учитывалась изложенная выше информация о структуре питания у больных СИБР. В связи с этим представляется актуальным проведение исследований модификации рациона с целью повышения эффективности лечения больных СИБР.
Цель настоящего исследования – оценить эффективность и переносимость специализированного рациона в схеме терапии СИБР метан-продуцирующей флоры в тонкой кишке у пациентов с синдромом раздраженного кишечника с запором.
Материал и методы
Материалом исследования послужили результаты обследования больных синдромом раздраженного кишечника с запором (диагноз установлен исходя из Римских критериев – IV [11]), у которых, по данным дыхательного теста с лактулозой, выявлен СИБР метан-продуцирующей флоры в тонкой кишке (СИБР-СН4). Все пациенты до начала исследования дали письменное информированное согласие на участие в нем. Протокол исследования был предварительно одобрен Этическим комитетом ФГБУН «ФИЦ питания и биотехнологии». Набор пациентов в исследование проводился с 2017 по 2019 г.
Критериями включения в исследование стали:
- добровольное желание пациентов, отраженное в виде подписанной формы информационного листка;
- возраст от 18 до 75 лет;
- отсутствие критериев органических (неопластических, воспалительных) заболеваний кишечника.
Критерии невключения:
- нежелание пациента участвовать в исследовании;
- нежелание пациента следовать требованиям, необходимым для получения адекватных результатов обследования;
- прием любых антибактериальных или антисептических лекарственных средств за месяц до момента обращения пациента;
- наличие сопутствующих заболеваний и состояний, способных повлиять на формирование СИБР независимо от рациона или привести к неправильной интерпретации дыхательного теста с лактулозой (оперативные вмешательства на органах желудочно-кишечного тракта (ЖКТ) в анамнезе);
- воспалительные заболевания кишечника;
- хронический панкреатит с внешнесекреторной недостаточностью поджелудочной железы, пищевая аллергия и непереносимость (в том числе глютеновая энтеропатия), заболевания нервной системы, сопровождающиеся нарушением двигательной активности ЖКТ;
- заболевания легких (туберкулез, пневмония, хроническая обструктивная болезнь легких);
- прием лекарственных препаратов с возможным влиянием на моторику ЖКТ (при этом возможность включения пациентов после отмены таких препаратов рассматривалась после периода «отмывки», который соответствовал не менее чем одному периоду полувыведения препарата);
- общее состояние пациента, которое, по мнению исследователя, могло существенно повлиять на результаты исследования и интерпретацию данных;
- смешанный вариант СИБР (СИБР с избыточным ростом как водород-, так и метан-продуцирующей флоры в тонкой кишке).
Данные пациентов не включались в конечный анализ, если:
- пациенты отзывали согласие на участие в исследовании и обработку полученных данных;
- в силу ряда причин невозможно было провести один из предусмотренных протоколом методов исследования;
- полученные результаты не поддавались интерпретации;
- один или несколько параметров, предусмотренных протоколом исследования, отсутствовали;
- не представлялось возможным подтвердить отсутствие состояний и заболеваний, предусмотренных критериями невключения в исследование.
Всем участникам исследования для устранения СИБР-СН4 назначали комбинированный препарат, содержащий тилихинол 100 мг и тилброхинол 200 мг (Интетрикс), по две капсулы два раза в день после еды в течение десяти дней [1]. Далее последовательно назначали пробиотический препарат Saccharomyces boulardii 250 мг (Энтерол) по одной капсуле три раза в день в течение трех недель. Пациентам основной группы (группа Д) на фоне терапии вводили специализированный рацион на весь период наблюдения. Больным контрольной группы (группа К) рекомендовали придерживаться привычного рациона питания. Больные были распределены по группам методом последовательных номеров.
Динамику симптомов во время фармакотерапии оценивали по специально разработанной форме вопросника об имеющихся симптомах (абдоминальная боль, вздутие живота, чувство неполного опорожнения кишечника) и их выраженности (по пятибалльной шкале Лайкерта) с описанием параметров стула (частота и индекс по Бристольской шкале кала). Учитывались усредненные данные за семь дней: до начала фармакотерапии, на первой и второй неделе ее проведения.
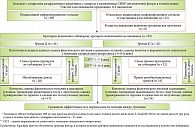
Эффективность терапии контролировали с помощью дыхательного теста с лактулозой через два месяца после завершения курса фармакотерапии. Схема набора пациентов в исследование и его дизайн представлены на рисунке.
Избыточный бактериальный рост метан-продуцирующей флоры в тонкой кишке определяли по стандартной методике [12] с использованием аппарата GastroCheck Gastrolyser (Великобритания) после предварительной калибровки. Обследование проводилось в утренние часы после 12-часового голодания. Накануне исследования исключался прием кисломолочных напитков, блюд из макарон, злаков, картофеля и кондитерских изделий. В ходе процедуры фиксировались значения концентрации водорода и метана в выдыхаемом воздухе исходно, а также каждые 20 минут в течение двухчасового периода после приема 15 мл лактулозы (Дюфалак), растворенной в 100 мл негазированной питьевой воды. Избыточный рост водород-продуцирующей флоры фиксировали при превышении уровня содержания водорода 20 ppm в выдыхаемом воздухе, избыточный рост метаногенной флоры – при превышении в выдыхаемом воздухе уровня метана 12 ppm [12].
Фактическое питание в домашних условиях оценивали методом 24-часового воспроизведения, причем адекватность указанных размеров порций контролировалась сертифицированным диетологом с использованием альбома фотографий пищевых продуктов разных порций. Нутриентный состав и калорийность рационов рассчитывали на основании справочника химического состава продуктов [13].
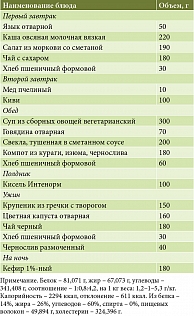
Модификация рациона. Специализированный рацион сформирован исходя из основного варианта стандартной диеты с модификацией состава белковых блюд (частота употребления блюд из рыбы и птицы сокращена до одного раза в неделю, увеличено число блюд из красного мяса и творога), овощей (замена томатов, огурцов, кабачков на корнеплоды, капусту и т.д.) и фруктов (семечковые до одного раза в неделю) для коррекции выявленных особенностей питания пациентов с СИБР-СН4. Для пациентов с избыточной активностью метаногенной флоры характерно высокое содержание белка в рационе, поэтому содержание белка в специализированном рационе ограничивалось 1,1 г/кг. Для облегчения усвоения белковые блюда использовались преимущественно в рубленом виде. Для каждого пациента подбирали изокалорийную диету и формировали семидневное меню в соответствии с возрастом, полом, массой тела и пищевыми привычками. Химический состав: белки – 67–82 г, в том числе животные 35–40 г, жиры общие – 61–77 г, в частности растительные 20–25 г, углеводы общие – 332–359 г. Такой рацион обеспечивал повышенное поступление пищевых волокон (40–49 г/сут), улучшал опорожнение кишечника и повышал эффективность антибактериальной терапии, в том числе за счет киселя, содержавшего инулин и куркумин (Интенорм). Режим питания предусматривал 5–6-кратный прием пищи. Было рекомендовано использовать блюда в отварном виде, готовить их на пару, запекать или тушить. Количество свободной жидкости – 1,5–2 л/сут. Пример однодневного меню представлен в табл. 1.
Приверженность лечению контролировали по телефону еженедельно методом формального опроса. Приверженность диетотерапии оценивали у всех пациентов на основании анализа фактического питания в день проведения контрольного дыхательного теста с лактулозой.
Для статистической компьютерной обработки данных использовали пакет программ SPSS 13.0 for Windows (США). С помощью данного пакета оценивали показатели выборки методами дескриптивной статистики. Для отображения центральной тенденции использован формат представления данных в виде средних значений и стандартного отклонения. При сравнении результатов между группами применяли метод Манна – Уитни и критерий хи-квадрат Пирсона. Результаты считались достоверными при p ≤ 0,05.
Результаты
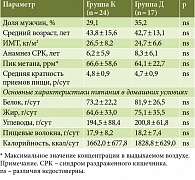
Участниками исследования стали 112 пациентов с СИБР метан-продуцирующей флоры (33 мужчины и 79 женщин, возраст – 44,3 ± 12,4 года). Информированное согласие подписали 89 пациентов. Шесть пациентов не соответствовали критериям включения (в ходе обследования выявлена органическая патология). 83 пациента были случайным образом разделены на две группы: 42 больных (девять мужчин, 33 женщины, возраст – 43,1 ± 12,1 года) составили группу К, 41 больной (12 мужчин, 29 женщин, возраст – 45,1 ± 13,3 года) – группу Д.
В процессе наблюдения из группы К выбыли 18 больных: 12 из них не соблюдали предписанную схему лечения, шесть – по завершении лечения в рамках исследования принимали антибактериальные препараты, что не позволило оценить данные по дыхательному тесту с лактулозой в конечной точке исследования. В группе Д из конечного анализа исключены данные 24 больных: у 20 пациентов при опросе выявлена неполная комплаентность к предписанному рациону, четыре пациента не выполнили рекомендации по фармакотерапии. Для конечного анализа оказались доступны данные 42 больных, успешно завершивших предписанную терапию без отклонений от протокола. У этих пациентов все результаты были получены в соответствии с протоколом исследования (рис. 1). Исходные характеристики групп представлены в табл. 2.
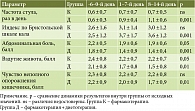
За весь период наблюдения у пациентов, получавших специализированный рацион, не отмечалось каких-либо симптомов плохой переносимости диеты или явлений «приедаемости». Достоверный положительный эффект специализированного рациона на частоту и консистенцию стула, а также на выраженность основных жалоб (вздутие живота, чувство неполного опорожнения кишечника, абдоминальную боль) наблюдался со второй недели (табл. 3). В основной группе эффективность терапии составила 35,2% (шесть из 17), в контрольной – 20,8% (пять из 24) (p = 0,3).
Обсуждение
В силу высокой распространенности СИБР, ухудшения качества жизни больных и риска развития ряда осложнений (ухудшение обеспеченности макро- и микронутриентами, которые используются микрофлорой для обеспечения роста и жизнедеятельности, развитие эндотоксемии, возможность транслокации бактерий во внутреннюю среду организма при нарушении сопротивляемости) лечение, направленное на устранение СИБР и ликвидацию избыточной бактериальной колонизации слизистой оболочки тонкой кишки, представляет важную проблему современной медицины. В то же время стандартных схем лечения СИБР-СН4 не существует. Широко используемая в странах Западной Европы и США схема на основе комбинации рифаксимина и неомицина эффективна лишь в половине случаев [5]. Эффективность схем с тилихинолом и тилброхинолом, продемонстрированная ранее, не достигла целевых значений выше 80% [1].
В настоящей работе нами впервые показана возможность влияния модификации пищевого рациона на эффективность лечения больных СИБР-СН4 (данные одноцентрового пилотного рандомизированного открытого исследования с участием относительно небольшого количества пациентов).
Предварительно проведенный анализ литературных источников не выявил аналогичных работ, в которых учитывались бы данные о структуре питания у больных с разными вариантами СИБР. В единичных работах с использованием элементной диеты авторы отмечают ее плохую переносимость и высокую стоимость, существенно ограничивающие клиническое использование такого подхода [5]. В нашем исследовании рацион подбирался с учетом ранее установленных особенностей структуры питания больных СИБР-СН4. Однако диета, состоявшая из обычных блюд, учитывала индивидуальные потребности организма в энергии и основных макронутриентах. Несмотря на отсутствие достоверных отличий в эффективности терапии между группами сравнения, нам удалось установить тенденцию к увеличению относительного числа больных, достигших элиминации СИБР-CH4 в группе специализированного рациона с учетом особенностей паттернов питания у больных СИБР метан-продуцирующей флоры в тонкой кишке. Кроме того, в группе, получавшей специализированный рацион, доля пациентов, прекративших прием лекарственной терапии, была меньше (9,8% по сравнению с 28,6% в группе контроля; p < 0,05). Вероятно, это обусловлено более выраженной динамикой симптомов в основной группе. Неполная приверженность предписанному рациону (у 20 из 41 больного) к окончанию исследования не случайна. Скорее всего положительная динамика симптомов в первые две недели лечения способствовала отказу пациентов от соблюдения рекомендаций по питанию. Как следствие, информация в отношении таких больных не учитывалась при анализе эффективности лечения. Как было неоднократно продемонстрировано в ранее опубликованных работах, комплаентность больных снижается пропорционально длительности периода воздержания от привычного образа жизни или приема лекарственных препаратов [14, 15]. Использование доступного и удобного рациона – важная составляющая в достижении высокой приверженности лечению. В нашем исследовании использовались стандартные блюда, обеспечившие целевые значения по продуктовому составу диеты. Не исключено, что это способствовало снижению доли пациентов, выбывших из исследования из-за несоблюдения диеты.
Тенденция к повышению эффективности комплексного лечения за счет диетологических подходов, выявленная на основании результатов исследования, может быть обусловлена рядом факторов. Прежде всего это конкуренция в микробном сообществе за нутриенты, которая является ключевым фактором, связанным с изменением соотношения видов в нем [8]. Каждый вид микроорганизмов характеризуется определенным набором ферментных систем, позволяющим ферментировать конкретные пищевые субстраты с большей эффективностью. Изменение структуры потребления веществ может способствовать формированию нового биоценоза. В то же время выявленный тренд может быть обусловлен нутриентным составом рациона. В одном из исследований количество пищевых волокон значительно превышало норму физиологической потребности – 20 г/сут [16]. В ранее проведенных исследованиях при увеличении содержания пищевых волокон в рационе пропорционально увеличивалась толщина пристеночной слизи в кишечнике [17]. Это может способствовать усилению сопротивляемости эпителия тонкой кишки колонизации и снижению риска формирования СИБР [18]. Кроме того, пищевые волокна ферментируются с образованием летучих жирных кислот, что приводит к снижению внутрипросветного рН кишки и лимитирует рост бактероидов [19]. Введение большого количества хорошо переносимых пищевых волокон (в нашем исследовании до 49 г/сут) могло ограничивать доступность пищевого субстрата для метаногенов, поскольку в новых условиях им было сложнее конкурировать с микроорганизмами, у которых скорость обменных процессов выше [6].
Для обеспечения необходимого объема пищевых волокон использовался специализированный пищевой продукт с известным количеством волокон, что существенно упрощало модификацию рациона. В ранее проведенных исследованиях отмечалась хорошая эффективность и переносимость продукта [20]. В настоящей работе специализированный рацион также характеризовался хорошей переносимостью: связанных с его использованием нежелательных явлений не зарегистрировано. Кроме того, к 14-му дню лечения наблюдались достоверные отличия по частоте стула за сутки (с 0,6 ± 0,3 до 1,1 ± 0,6; р = 0,001), количеству баллов по Бристольской шкале кала (с 2,5 ± 1,2 до 3,6 ± 1,2; р = 0,001), ощущению неполного опорожнения кишечника (с 2,2 ± 0,9 до 1,7 ± 0,9; р = 0,01) по сравнению с исходными данными. Вместе с тем достоверных отличий по этим признакам в группе пациентов, получавших только фармакотерапию, не выявлено. Это может объясняться осмотическим эффектом инулина, который влияет на динамику всасывания жидкости толстой кишкой [21], и противовоспалительными клеточными эффектами куркумина, которые реализуются посредством ингибирования каскадов липооксигеназы/циклооксигеназы, ксантиндегидрогеназы/оксидазы, усилением активности супероксиддисмутазы и глутатионпероксидазы, действием на протеины клеточного цикла (циклин D1 и р21), цитокины (фактор некроза опухоли альфа, интерлейкины 1 и 6, хемокины) и рецепторы (рецептор эндотелиального фактора роста и НЕR2) [22].
Одно из ограничений данного исследования – небольшое количество пациентов в группах. Для более высокой статистической мощности и доказательного уровня полученных результатов необходимы более масштабные исследования с набором участников в нескольких центрах. К сожалению, несмотря на достаточное количество исходно включенных в исследование участников, конечному анализу оказались доступны данные только половины из них. Следует отметить, что количество пациентов, выбывших из исследования из-за особенностей диетотерапии, незначительно.
Еще одно возможное ограничение – методика, использованная для выявления избыточного бактериального роста. Несмотря на то что дыхательный тест с лактулозой считается стандартным методом диагностики СИБР [1], он является косвенным и зависит от функциональной активности бактерий, кишечной стенки и легочной ткани. Не случайно результаты теста обусловлены рядом факторов, например предшествующим приемом антибактериальных препаратов, изменением кишечной проницаемости, адекватностью диффузии газов в альвеолах и др. [23]. Учитывая, что дыхательный тест проводился в динамике одним и тем же пациентам, влияние указанных факторов, вероятно, было не таким значимым в отношении полученных результатов. Но следует принимать во внимание потенциальное влияние таких факторов при интерпретации полученных данных.
Заключение
У больных СИБР метаногенной флоры использование специализированного рациона может способствовать уменьшению выраженности симптомов на фоне терапии тилихинолом и тилброхинолом, а также повышению эффективности лечения СИБР.
Требуются дополнительные исследования для подтверждения полученных данных.
V.I. Pilipenko, PhD, V.A. Isakov, MD, PhD, Prof., S.V. Morozov, PhD
Federal Research Centre of Nutrition, Biotechnology and Food Safety
Contact person: Vladimir I. Pilipenko, pilipenkowork@rambler.ru
The Purpose – to evaluate the role of diet modification in small intestine overgrowth syndrome of methanogenic flora (SIBO-CH4) patients on the treatment efficacy and tolerability.
Material and methods. Single-center prospective trial was performed. The results of SIBO of methanogenic flora patients’ examinations served as a source data. Treatment with Tilichinol 100 mg/tilbroquinol 200 mg (Intetrix), 2 capsules BID, after meal, 10 days, followed by a preparation of S. boulardii (Enterol 250 mg) 1 caps TID, 3 weeks was used to eliminate SIBO. Additionally, patients randomly selected to a group D were advised to receive a specialized diet based on the individual metabolic rate and the data of typical nutritional patterns of these patients from baseline to the study completion. Those randomized in a group K continued their usual diet and served as a control group. Lactulose breath test was performed after completion of pharmacological treatment to assess the efficacy. Tolerability of the treatment was assessed with the use of the formal questionnaire based on a 5-points Likert scale, including stool frequency, Bristol stool index, feeling of bloating, abdominal pain and a sense of incomplete bowel emptying. Patients were asked to fill in the questionnaire on the everyday basis during pharmacotherapy. Means of 7 day values of each parameter were used to analyze changes.
Results. One hundred and twelve patients were enrolled. The data of 41 of them were available for the final analysis: 24 of them in the group K (17 women, age (mean ± SD) 45.6 ± 12.6 y.o.), 17 in the group D (11 women, mean age 42.7 ± 13.1 y.o.). Elimination of SIBО was achieved in 6 (35.2%) of 17 patients who received a specialized diet, and in 5 (20.8%) out of 24 in controls, p = 0.30. Significant increase in the stool frequency (mean ± SD: 0.6 ± 0.3 a day on the baseline vs 1.1 ± 0.6 at wk 2; p = 0.001), Bristol stool scale index (2.5 ± 1.2 vs 3.6 ± 1.2, p = 0.001) and a number of patients achieved resolution of incomplete bowel emptying feeling (2.2 ± 0.9 to 1.7 ± 0.9; p = 0.01), was achieved only in group D, while in group K no significant change of these parameters was established.
Conclusion. The use of specialized diet reduces symptoms severity and may increase efficacy of treatment in patients with small intestine bacterial overgrowth of methanogenic flora.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.