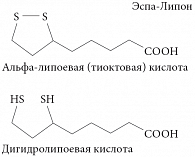
Актуальность проблемы мужского бесплодия
По данным статистических исследований в США, в настоящее время 10–15% супружеских пар страдают бесплодием. Не последнюю роль в этом играет поздний возраст планирования первой беременности и обусловленное этим снижение фертильности женщины. Однако в XXI веке все больше внимания уделяется мужскому бесплодию, которое даже при выявлении, как правило, не лечат. Пара отправляется в клинику, специализирующуюся на экстракорпоральном оплодотворении (ЭКО), где чаще всего ей предлагается самый простой вариант лечения мужского бесплодия – использование спермы донора, в результате чего увеличивается процент мужчин, воспитывающих генетически чужих детей.
Несмотря на большие успехи вспомогательных репродуктивных технологий (ВРТ), результативность ЭКО, оцениваемая по количеству живорожденных детей, за последние 10 лет практически не изменилась и составляет не более 30%, что стали связывать с отсутствием лечения мужского бесплодия и подготовки мужчин к ВРТ. Учитывая спад рождаемости и прогрессирование мужского бесплодия, крайне важно пересмотреть подходы не только к диагностике, но и лечению мужского бесплодия, в том числе его тяжелых форм, неадекватная терапия которых нередко заканчивается несколькими неудачными попытками ЭКО и применением в конечном итоге спермы донора.
Мужское бесплодие: классификация, причины, подходы к лечению
Выделяют три типа мужского бесплодия: обструктивное, подлежащее хирургическому лечению (38%), эякуляторное (2%) и необструктивное, связанное с нарушением сперматогенеза (60%). К основным причинам, приводящим к необструктивному бесплодию, относятся гипогонадотропный гипогонадизм, генетические аномалии, варикоцеле, крипторхизм, травмы, опухоли, перекрут яичка, перенесенный орхит, воздействие лекарственных препаратов и гонадотоксинов. Гипогонадотропный гипогонадизм встречается в рамках синдрома Каллмана, гемохроматоза, синдрома Барде – Бидля, синдрома Прадера – Вилли, семейной церебральной атаксии, гиперпролактинемии, при опухолях гипофиза и гипоталамуса, туберкулезе, грибковых инфекциях, при применении опиатов и психотропных средств, при ожирении, хронических соматических заболеваниях, после хирургических вмешательств на головном мозге или лучевой терапии [1].
Различают несколько типов изменений в спермограмме: снижение общего количества сперматозоидов – олигозооспермия, нарушение их подвижности – астенозооспермия, изменение морфологии сперматозоидов – тератозооспермия. Однако чаще всего в клинической практике встречается коморбидная патология – олигоастенотератозооспермия (ОАТ), которая признана самой частой причиной мужского бесплодия [2].
Выявление и устранение причин мужского бесплодия может дать возможность многим парам восстановить фертильность и не прибегать к ВРТ. Несмотря на все возможности диагностики, в 25% случаев мы не можем выявить причину изменений в спермограмме; такие случаи относят к идиопатическому бесплодию и назначают неспецифическое лечение. Спектр схем эмпирической терапии достаточно широк, но ни одна из них не показала эффективности в рандомизированных исследованиях. К наиболее распространенным вариантам эмпирической терапии относят назначение антиэстрогенов, витаминов-антиоксидантов, ингибиторов ароматазы, L-карнитина, цинка. Любая терапия должна продолжаться не менее 3–6 месяцев, так как полный цикл сперматогенеза занимает 72 дня [3]. Поскольку лечение длительно, а эффективность его недостаточно высока, многие пары предпочитают воспользоваться ЭКО. Для бесплодных пар с неудовлетворительными показателями спермограммы супруга или имевшим неудачные попытки ЭКО сегодня предлагается интрацитоплазматическая инъекция сперматозоидов (ИКСИ).
Морфологические характеристики сперматозоидов считаются основным фактором, позволяющим предсказать исход внутриматочной инсеминации или ЭКО. Однако доля сперматозоидов с нормальной морфологией в нативной сперме или даже после отделения фракции с наибольшей подвижностью не влияет на исход ИКСИ [4].
Высказано предположение, что использование сперматозоида с «невидимыми повреждениями» может привести к неудаче попытки ИКСИ, нарушению эмбрионального развития, низкой вероятности наступления беременности. Таким повреждением считается нарушение целостности ДНК сперматозоида – фрагментация [5]. Влияние нарушения целостности ДНК сперматозоидов на исходы ИКСИ изучалось с использованием различных методик. При этом были получены противоречивые результаты. Одни авторы выявили четкую отрицательную взаимосвязь между долей сперматозоидов с фрагментированным ДНК и их оплодотворяющей способностью в цикле ИКСИ. Другие исследователи не обнаружили такую зависимость, но отметили низкую вероятность наступления беременности после переноса эмбрионов [6, 7]. Такие двойственные результаты можно объяснить тем, что фрагментация ДНК во всех этих исследованиях изучалась в общем пуле сперматозоидов (как морфологически нормальных, так и измененных). Для ИКСИ всегда отбирается только морфологически нормальный сперматозоид. Оказалось, что даже в таких хорошо подвижных и морфологически нормальных при обычной микроскопии сперматозоидах может быть фрагментированная ДНК. Этот факт крайне важен, поскольку даже у субфертильных пациентов с пограничными и нормальными показателями спермограммы фрагментация ДНК определялась в 25% случаев [8]. При этом ни у кого из фертильных мужчин группы контроля в морфологически нормальных сперматозоидах фрагментация ДНК не выявлена.
Длительное время подготовке мужчин к процедуре ЭКО и ИКСИ не уделялось достаточно внимания, и, возможно, улучшение качества сперматозоидов позволит не только повысить результативность ВРТ, но и в ряде случаев получить естественную беременность, что мы нередко наблюдаем в результате подготовки мужчины к ВРТ.
Цикл развития зародышевых клеток сперматогенного эпителия
В последнее десятилетие сделаны ключевые открытия в понимании сложного процесса регуляции развития сперматогенных клеток. Раскрытие основных механизмов действия гормонов на зародышевые клетки сперматогенного эпителия дает ключ к лечению мужского бесплодия. Большая часть данных получена при изучении приматов, и, хотя их нельзя полностью экстраполировать на человека, однозначно существует межвидовая общность в регуляции основных биологических процессов [9]. Так, в середине 1970-х гг. в исследованиях на приматах была определена важнейшая роль тестостерона для сперматогенеза. В последнее десятилетие определена не менее важная роль фолликулостимулирующего гормона (ФСГ), хотя ранее однозначного мнения о его необходимости в постнатальном периоде не было.
Для лучшего понимания предложенных нами терапевтических подходов необходимо рассмотреть схему развития зародышевых клеток сперматогенного эпителия, находящуюся под контролем ФСГ и тестостерона.
Зародышевые клетки проходят последовательно митотическое и мейотическое деление, в процессе которых происходит дупликация, репарация и сегрегация ДНК в 4-фазном клеточном цикле. Во время клеточного цикла сперматогонии растут в фазе G1, синтезируют ДНК в фазе S, подготавливаются к митозу в фазе G2 и проходят митоз и мейоз в М-фазе (состоит из 4 подфаз: профаза, метафаза, анафаза и телофаза). В своем развитии сперматоциты проходят 2 мейотических деления. В профазе 1, метафазе 1 и телофазе 1 первого мейотического деления сперматоциты последовательно превращаются в лептотеновые, зиготеновые и пахитеновые сперматоциты, а затем в диплотеновые клетки. Во время 2-го мейотического деления синтез ДНК не происходит, и в результате деления диплотеновых клеток образуется 4 гаплоидных зародышевых клетки, что знаменует окончание М-фазы [10]. В конце клеточного цикла у клетки есть два дальнейших пути развития: она может вступить в новый клеточный цикл или перейти в фазу покоя (G0). Например, клетки Сертоли в препубертате остаются в фазе G0. Клетка может находиться в фазе покоя неопределенно долгое время, прежде чем возобновит пролиферацию.
Клеточный цикл может прерваться как на ключевых этапах развития (G1 и G2), так и в любую фазу клеточного цикла. Для прохождения нормального клеточного цикла необходимо присутствие определенных внешних ростовых факторов, в отсутствие которых клетка переходит в фазу G0. При создании благоприятных условий клетка может возобновить клеточный цикл [11]. Недостаток или длительное отсутствие этих факторов препятствует переходу клетки в следующую фазу и запускает механизмы апоптоза, приводящие к ее гибели [12].
Гормональная регуляция сперматогенеза
Процесс сперматогенеза запускается и регулируется гормонами гипоталамо-гипофизарно-гонадной оси. Гонадотропин-рилизинг-гормон (ГНРГ) выделяется в пульсирующем ритме и воздействует на гипофиз, стимулируя секрецию лютеинизирующего гормона (ЛГ) и ФСГ. Фолликулостимулирующий гормон воздействует на клетки Сертоли, лютеинизирующий – на клетки Лейдига. На зародышевых клетках рецепторы к тестостерону не обнаруживаются, и андрогены, секретируемые клетками Лейдига, действуют через рецепторы на клетках Сертоли. Тестостерон, образующийся в клетках Лейдига, ингибин клеток Сертоли и эстрогены, получившиеся в результате ароматизации тестостерона, действуют на гипоталамус, регулируют секрецию гонадотропинов по механизму отрицательной обратной связи. У человека развитие сперматогоний, мейоз и процесс отделения сперматид от клеток Сертоли (спермиация) контролируются ФСГ и тестостероном [13].
Для сперматогенеза необходимы функциональные и соединительнотканные взаимосвязи между клетками Сертоли и клетками зародышевого эпителия. Сами зародышевые клетки не имеют рецепторов к гормонам, и эти субстанции оказывают свое биологическое действие на сперматогенез, связываясь с рецепторами, расположенными внутри или на поверхности клеток Сертоли. Для процесса спермиации необходимо наличие определенной популяции клеток Сертоли, которая формируется к пубертатному возрасту (11–13 лет) [14]. Численность популяции клеток Сертоли определяется в раннем постнатальном периоде и является важнейшей составляющей сперматогенеза во взрослом состоянии.
При старте сперматогенеза клетки Сертоли проходят стадию пролиферации, и многочисленными исследованиями in vivo и in vitro показано, что ФСГ является основным регулятором этого процесса. Известно, что популяция клеток Сертоли у взрослого мужчины неизменна и не зависит от колебаний уровня гормонов после пубертата. Тем не менее при изучении мужчин с гипогонадотропным гипогонадизмом выяснилось, что клетки Сертоли сохраняют пролиферативную активность и могут приобретать черты, свойственные незрелым клеткам Сертоли [15].
Численность зародышевых клеток определяется балансом между их апоптозом и делением. В препубертате проходит ранняя волна апоптоза сперматогоний (обусловливающая гибель 70% сперматогоний), которая необходима для формирования правильного соотношения между клетками Сертоли и зародышевыми клетками [16]. Ранее предполагалось, что количество зародышевых клеток находится под контролем клеток Сертоли, однако при пересадке зародышевых клеток крысы в яичко бесплодного самца мыши оказалось, что зародышевые клетки сами, в отсутствие клеток Сертоли, осуществляют выбор времени и этапность протекания сперматогенеза [16].
Тестостерон вырабатывается в клетках Лейдига под действием ЛГ и оказывает биологическое действие на сперматогенез через андрогеновые рецепторы, расположенные на клетках Сертоли [17]. ФСГ оказывает свое действие через G-ассоциированные рецепторы к ФСГ, находящиеся на мембране клеток Сертоли. Взаимодействие ФСГ с рецептором клетки Сертоли активирует по меньшей мере 5 сигнальных путей, таких как циклический аденозинмонофосфат и протеинкиназа, МАР-киназа, кальций, фосфатидилинозитол-3-киназа и фосфорилаза А2 [18].
Под влиянием ФСГ в клетках Сертоли повышается активность ароматазы, способствующей конверсии андрогенов в эстрогены, а также вырабатываются ингибин и активин. Ингибин является важной составляющей обратной связи в регуляции секреции ФСГ. При изолированном поражении клеток Сертоли, возникающем после радио- или химиотерапии, дефицит ингибина сопровождается значительным повышением ФСГ, в то время как уровень ЛГ остается в пределах нормальных значений. ФСГ регулирует также количество андрогеновых рецепторов и андроген-связывающего глобулина, что крайне важно для регуляции сперматогенеза [19]. ФСГ необходим для поддержания высокой локальной концентрации андрогенов в семенных канальцах [20]. Блокада рецепторов к ФСГ у взрослых макак-резус приводит к бесплодию. Бионейтрализация циркулирующего человеческого ФСГ снижала качество и количество сперматозоидов [21].
В течение всего периода сперматогенеза гаметы получают питание от клеток Сертоли, которые располагаются в пространстве от базальной мембраны до просвета семенного канальца. Клетки Сертоли секретируют необходимые электролиты и жидкость под действием ФСГ и тестостерона.
Во взрослом состоянии ФСГ необходим для прогрессии прелептотеновых сперматоцитов и частично – пахитеновых. Острый дефицит ФСГ приводит к снижению количества прелептотеновых сперматоцитов даже в присутствии нормального уровня андрогенов. ФСГ принимает участие в спермиогенезе, вероятно, регулируя степень адгезии между клетками Сертоли и сперматидами [22]. Показано, что после нейтрализации ФСГ прекращается выделение спермы, что свидетельствует о роли ФСГ в спермиогенезе [23]. Тестостерон частично обеспечивает созревание сперматоцитов, тем не менее он играет важнейшую роль в превращении округлых сперматид в удлиняющиеся. При культивации семенных канальцев человека в средах, лишенных ФСГ, отмечено существенное усиление фрагментации ДНК в первичных сперматоцитах и удлиняющихся/удлиненных сперматидах, что связывают с активацией апоптоза [24]. Острый дефицит ФСГ на животных моделях запускает процесс апоптоза сперматогоний [25].
Сегодня доказано, что ФСГ и тестостерон действуют как антиапоптотические факторы, регулируя каскад реакций, приводящий к активации генов апоптоза, в значительно меньшей степени эти гормоны регулируют пролиферацию. ФСГ способствует устранению апоптотических изменений в структуре сперматозоидов, вызванных микробной инфекцией, и повышает оплодотворяющий потенциал сперматозоидов [26].
Гормональная терапия мужского бесплодия
Нарушение тонкого гормонального баланса является одной из причин мужского бесплодия, поэтому именно стимулирующая гормональная терапия может рассматриваться как патогенетический подход к лечению. Она может применяться in vivo для достижения естественного оплодотворения или повышения результативности процедуры ЭКО, а также in vitro для повышения оплодотворяющей способности сперматозоидов.
ЛГ и ФСГ относятся к гипофизарным гонадотропинам, третьим гонадотропином является хорионический гонадотропин (ХГЧ), секретируемый плацентой. ХГЧ близок по структуре к ЛГ и взаимодействует с тем же рецептором на клетках Лейдига. Поскольку гонадотропины играют ключевую роль в инициации сперматогенеза, их пытаются применять для лечения различных форм мужского бесплодия.
ХГЧ получают из мочи беременных женщин и используют для восполнения дефицита ЛГ и повышения содержания внутритестикулярного тестостерона. Менопаузальный гонадотропин получают из мочи женщин в постменопаузе, он обладает одновременно ЛГ- и ФСГ-активностью. Существуют также очищенный мочевой и рекомбинантный ФСГ [27].
До недавнего времени полагали, что повышения интратестикулярной концентрации тестостерона при помощи препаратов хорионического гонадотропина достаточно для того, чтобы качественно восстановить сперматогенез у взрослых. Оказалось, что такой подход не всегда дает ожидаемый результат. При длительном дефиците как ФСГ, так и тестостерона введение только ФСГ не восстанавливает полный цикл сперматогенеза, хотя и несколько повышает количество сперматогоний и влияет на все зародышевые клетки до стадии пахитеновых сперматоцитов. Тем не менее даже при наличии незначительного (ниже нормы) уровня тестостерона происходит восстановление сперматогоний, то есть для осуществления ФСГ своей функции необходимо присутствие хотя бы небольшого количества тестостерона.
Давно известна эффективность терапии препаратами ФСГ при гипогонадотропном гипогонадизме и изолированном дефиците ФСГ. При этих состояниях терапия ФСГ или ФСГ совместно с ЛГ позволяет получить нормальную спермограмму даже при исходной азооспермии [28]. Лечение пациентов с олигоастенотератозооспермией препаратами ЛГ и ФСГ повышает вероятность наступления беременности в цикле ЭКО и ИКСИ на 47,2%, при этом параметры спермограммы на фоне терапии практически не меняются [29].
В нашей практике мы используем следующие схемы применения стимулирующей терапии при лечении гипогонадотропного гипогонадизма, а также подготовки мужчин к ВРТ: препараты ХГЧ (Хорагон) в дозе 1500 ЕД 2–3 раза в неделю или в дозе 5000 ЕД 1 раз в неделю в течение 2–3 месяцев с последующим присоединением препаратов ФСГ (Менопур) – 75–150 ЕД 3 раза в неделю. Продолжительность лечения составляет от 3 до 12–18 месяцев. У большинства пациентов такая терапия позволяет достичь наступления спонтанной беременности или повышает результативность ВРТ.