Нарушения сна при сердечной недостаточности, ассоциированной с синдромом обструктивного апноэ сна: прогностическая роль полисомнографии
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить прогностическую значимость основных полисомнографических параметров у пациентов с СНсФВ и СОАС.
Материал и методы. В исследование были включены 207 пациентов – мужчины с СОАС (с индексом апноэ/гипопноэ (ИАГ) > 15 в час). Все имели абдоминальное ожирение и страдали артериальной гипертензией. Всем пациентам исходно были выполнены полисомнография, эхокардиография, оценка уровня NT-концевого фрагмента мозгового натрийуретического пептида, а также тест шестиминутной ходьбы. Через 12 месяцев ретроспективно оценивали характер клинического течения заболевания. Критериями неблагоприятного течения служили эпизоды повторной госпитализации в стационар по поводу сердечно-сосудистых заболеваний, ухудшение сердечной недостаточности с переходом в более высокий функциональный класс по NYHA, развитие инфаркта миокарда или инсульта, а также наступление летального исхода.
Результаты. Наиболее значимые ассоциации с наступлением неблагоприятных клинических исходов были выявлены для ИАГ (37 эпизодов в час [32; 42,5] по сравнению с 26,5 эпизодами в час [21,75; 29,75]; p < 0,001) и индекса микропробуждений, связанных с дыхательными усилиями (RERA) (36 эпизодов в час [28,5; 38,5] по сравнению с 22 эпизодами в час [17; 27]; p < 0,001).
Выводы. Исследуемые полисомнографические параметры (ИАГ и RERA) являются независимыми предикторами неблагоприятных клинических исходов при СНсФВ на фоне СОАС и могут быть использованы для разработки дифференцированного подхода к лечению пациентов.
Цель – оценить прогностическую значимость основных полисомнографических параметров у пациентов с СНсФВ и СОАС.
Материал и методы. В исследование были включены 207 пациентов – мужчины с СОАС (с индексом апноэ/гипопноэ (ИАГ) > 15 в час). Все имели абдоминальное ожирение и страдали артериальной гипертензией. Всем пациентам исходно были выполнены полисомнография, эхокардиография, оценка уровня NT-концевого фрагмента мозгового натрийуретического пептида, а также тест шестиминутной ходьбы. Через 12 месяцев ретроспективно оценивали характер клинического течения заболевания. Критериями неблагоприятного течения служили эпизоды повторной госпитализации в стационар по поводу сердечно-сосудистых заболеваний, ухудшение сердечной недостаточности с переходом в более высокий функциональный класс по NYHA, развитие инфаркта миокарда или инсульта, а также наступление летального исхода.
Результаты. Наиболее значимые ассоциации с наступлением неблагоприятных клинических исходов были выявлены для ИАГ (37 эпизодов в час [32; 42,5] по сравнению с 26,5 эпизодами в час [21,75; 29,75]; p < 0,001) и индекса микропробуждений, связанных с дыхательными усилиями (RERA) (36 эпизодов в час [28,5; 38,5] по сравнению с 22 эпизодами в час [17; 27]; p < 0,001).
Выводы. Исследуемые полисомнографические параметры (ИАГ и RERA) являются независимыми предикторами неблагоприятных клинических исходов при СНсФВ на фоне СОАС и могут быть использованы для разработки дифференцированного подхода к лечению пациентов.

Введение
Сердечная недостаточность представляет собой важнейший этап в развитии большинства наиболее значимых сердечно-сосудистых заболеваний. И если систолическая дисфункция левого желудочка (сердечная недостаточность с низкой фракцией выброса левого желудочка – СНнФВ) является закономерным финалом развития наиболее распространенных сердечно-сосудистых заболеваний, то сердечная недостаточность с сохраненной фракцией выброса левого желудочка (СНсФВ) в большей степени отражает начальный этап патологического ремоделирования сердца. На этапе формирования СНсФВ потенциально появляется возможность оценки дополнительных сердечно-сосудистых рисков, ассоциированных с влиянием различных некардиальных патогенных факторов, и коморбидных заболеваний, среди которых в последние годы все больший интерес для исследователей и практических врачей представляет нарушение сна, особенно дыхательные расстройства во сне. Нарушение структуры сна у пациентов с хронической сердечной недостаточностью, регистрируемое по характерным полисомнографическим паттернам, а также соответствующие ему клинические проявления в последние годы стали предметом активного изучения. Однако прогностическое значение оцениваемых в соответствии со стандартным протоколом показателей полисомнографического исследования у пациентов с сердечной недостаточностью остается неопределенным. По мнению большинства экспертов, к наиболее распространенным нарушениям сна в данной когорте пациентов относятся типичные для хронической инсомнии расстройства – нарушения инициации сна, регистрируемые почти у 50% пациентов [1], и нарушения поддержания сна, которые, по данным крупных наблюдательных исследований, встречаются не менее чем у 20% женщин и 23% мужчин [2]. Сокращение продолжительности и фрагментация сна в дальнейшем принимают затяжной характер и прогрессируют, способствуя постепенному развитию хронической инсомнии, важную роль в патогенезе которой играет гиперсимпатикотония. В свою очередь гиперактивация симпатической нервной системы неизбежно приводит к ухудшению течения сердечной недостаточности. Развитие хронической инсомнии, по данным проведенных ранее исследований, характеризуется ухудшением функционального класса сердечной недостаточности в соответствии с NYHA [3], а свойственные инсомнии полисомнографические признаки фрагментации сна проявляют себя в качестве независимых предикторов неблагоприятных исходов у пациентов с хронической сердечной недостаточностью (ХСН) [4]. Кроме того, ухудшению клинического прогноза ХСН могут способствовать сопровождающие инсомнию тревожно-депрессивные расстройства [5] и постепенно формирующийся когнитивный дефицит, который усугубляется на фоне дыхательных расстройств во сне [6, 7].
Согласно опубликованным ранее данным [1], нарушения нормальной структуры сна у пациентов с сердечной недостаточностью проявляются при анализе полисомнограммы преимущественно увеличением времени латентности ко сну, времени бодрствования после наступления сна (wake after sleep onset, WASO), снижением эффективности сна (sleep efficiency, SE), а также сокращением представленности глубоких стадий медленноволнового сна и фазы сна с быстрым движением глаз (rapid eye movement sleep, REM-сна).
Результаты крупного многоцентрового обсервационного исследования Sleep Heart Health Study (SHHS) с участием 543 пациентов с ХСН и средним периодом наблюдения 10,4 ± 3,3 года продемонстрировали значимое увеличение показателя WASO и снижение эффективности сна по сравнению с группой контроля [4].
Развитию инсомнии, по мнению экспертов, способствуют и характерные для сердечной недостаточности симптомы: диспноэ, ортопноэ, болевой синдром в грудной клетке, а также ночная полиурия, провоцируемая диуретической терапией [8].
Существенный вклад в нарушения структуры сна и развитие инсомнии при сердечной недостаточности вносят дыхательные расстройства во сне [9]. Долгое время в качестве нарушений дыхания во сне, ассоциированных с ХСН, рассматривались преимущественно расстройства дыхания по типу Чейна – Стокса – центральное апноэ во сне, характерное преимущественно для фенотипа СНнФВ [9]. При фенотипе СНсФВ, напротив, преобладающим вариантом дыхательных расстройств во сне становится обструктивное апноэ сна. Распространенность данного варианта дыхательных нарушений, по разным данным, составляет 50–75% в популяции пациентов с СНсФВ [10], что сопровождается дополнительным негативным влиянием на клинический прогноз в данной когорте пациентов. С учетом наличия при ХСН целого ряда различных патогенных факторов, негативно влияющих на сон, роль обструктивных дыхательных нарушений при инсомнии в этой когорте пациентов требует более детальной оценки. Определенную помощь в этом может оказать исследование прогностической значимости у пациентов с СНсФВ полисомнографических паттернов, характерных для СОАС.
Материал и методы
Исследование одобрено локальным этическим комитетом и выполнено на базе кардиологического центра частного учреждения здравоохранения «Клиническая больница РЖД-Медицина» г. Новосибирска с 2017 по 2022 г. Всего за указанный период в исследовании приняли участие 207 мужчин – работников локомотивных бригад в возрасте 35–65 лет, соответствовавших критериям включения в исследование.
Критерии включения:
- фракция выброса левого желудочка ≥ 50% по данным эхокардиографии (ЭхоКГ);
- ЭхоКГ-признаки диастолической дисфункции миокарда левого желудочка;
- абдоминальное ожирение (окружность талии ≥ 92 см, индекс массы тела ≥ 30 кг/м2);
- мужской пол.
Критерии исключения:
- заболевания любой этиологии с высокой легочной гипертензией (систолическое давление в правом желудочке ≥ 45 мм рт. ст.);
- тяжелое течение бронхиальной астмы, хронической обструктивной болезни легких;
- сахарный диабет;
- поражение клапанного аппарата сердца;
- гипертрофическая и дилатационная кардиомиопатия;
- ишемическая болезнь сердца;
- постоянная форма фибрилляции предсердий;
- выраженная почечная недостаточность (скорость клубочковой фильтрации по формуле CKD-EPI < 30 мл/мин/1,73 м2) и печеночная недостаточность;
- центральное апноэ сна (индекс апноэ/гипопноэ (ИАГ) центрального > 5 в час);
- онкологические и острые воспалительные заболевания;
- отказ от участия в исследовании.
Всем работникам в рамках ежегодной медицинской комиссии с целью исключения ишемической болезни сердца проводились нагрузочные тесты – велоэргометрия либо тредмил-тест. При наличии положительного или сомнительного результата выполнялась коронароангиография. Всем пациентам выполняли полисомнографическое исследование в условиях стационара в оборудованном помещении по стандартному протоколу в соответствии с требованиями Американской академии медицины сна (AASM) [11]. Использовали диагностическую систему Somnolab2PSG (Weinemann, Германия). В ходе исследования осуществлялась синхронная регистрация электроэнцефалограммы (ЭЭГ), электроокулограммы, тонуса подбородочных мышц, дыхательного потока, экскурсии грудной клетки и брюшной стенки, актиграфии и положения тела, храпа, сатурации, электрокардиография (ЭКГ), регистрация двигательной активности нижних конечностей. Регистрация дополнялась синхронной видеофиксацией. При записи ЭЭГ использовали три канала записи с лобного, затылочного и центрального отведений. Для оценки дыхательного потока применяли назальные канюли. Исследование сатурации осуществлялось методом неинвазивной динамической пульсоксиметрии. Регистрация ЭКГ проводилась в одноканальном формате. При формировании отчета автоматический анализ стадий сна подвергался визуальной проверке и коррекции опытным специалистом. Для построения гипнограммы использовали протокол R&K [12]. В отчете указывали следующие параметры: общее время сна (минуты), латентность ко сну (SL), эффективность сна – отношение времени сна к времени пребывания в кровати (SE, %), время бодрствования после наступления сна (WASO), представленность REM-сна в общем времени сна (REM-сoн, %), представленность глубоких стадий медленноволнового сна в общем времени сна (S3S4, %), индекс обструктивного апноэ/гипопноэ (ИАГобс); индекс центрального апноэ/гипопноэ (ИАГцентр), среднюю ночную сатурацию (SPO2ср), индекс десатурации (ИД ≥ 4%), индекс микропробуждений, связанных с дыхательными усилиями (respiratory effort-related arousal, RERA). Обструктивные дыхательные нарушения во сне оценивали в соответствии с клиническими рекомендациями Российского общества сомнологов (2018) [13]. Степень дневной сонливости определяли с помощью Эпвортской шкалы. Для оценки функционального статуса всем пациентам проводили тест с шестиминутной ходьбой (ТШХ) по стандартному протоколу. После включения в исследование его участникам выполняли стандартный ЭхоКГ-протокол с использованием ЭхоКГ-аппарата Vivid S70 (GEHealthCare, США). Исследование уровня NT-фрагмента мозгового натрийуретического пептида (NTproBNP) проводилось на иммунохимическом анализаторе ARCHITECT i1000SR (Abbot, США).
Следующий этап – 12-месячное амбулаторное наблюдение с ретроспективной оценкой клинических исходов и повторным проведением ЭхоКГ и ТШХ. Клинические исходы и характер течения ХСН оценивали по композитной конечной точке, включавшей неблагоприятные клинические события: нефатальный инфаркт, инсульт, сердечно-сосудистую смерть, повторные госпитализации по причине сердечно-сосудистых заболеваний, а также ухудшение функционального статуса (увеличение дистанции при проведении ТШХ с переходом в более тяжелый класс по NYHA).
Статистическую обработку результатов исследования проводили с помощью программ STATISTICA 10.0 и MedCalc 11.5.0.0, а также в программной среде RStudio software, Inc., Boston, MA, версия 1.2.1335. Характер распределения признаков оценивали по критериям Колмогорова – Смирнова с поправкой Лиллиефорса, Шапиро – Уилка и визуально с помощью построения гистограмм. Для проверки статистических гипотез при анализе количественных показателей использовали критерий Манна – Уитни при сравнении двух независимых групп. Для анализа качественных признаков применяли критерий χ2 Пирсона. Поиск взаимосвязей между переменными осуществляли на основании корреляционного анализа с расчетом коэффициентов корреляции Спирмена. Для выявления предикторов развития неблагоприятных конечных точек использовали метод логистической регрессии. Критический уровень значимости p-value для всех используемых процедур статистического анализа считали равным 0,05.
Результаты
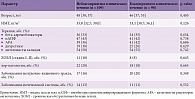
При ретроспективном анализе полученных данных через 12 месяцев наблюдения у 109 из 207 участников исследования характер клинического течения сердечной недостаточности в соответствии с выбранными на этапе планирования исследования критериями был классифицирован как неблагоприятный. Остальные 88 пациентов составили группу с благоприятным клиническим течением. При этом пациенты групп с разным характером клинического течения исходно значимо не отличались по основным клиническим, антропометрическим показателям, наличию сопутствующей патологии, а также характеру медикаментозной терапии (таблица). За 12 месяцев наблюдения летальных исходов не зафиксировано. Зарегистрирован один случай острого инфаркта миокарда и один случай острого нарушения мозгового кровообращения по ишемическому типу.
По результатам регрессионного анализа была установлена достоверная роль ИАГобс и RERA в качестве предикторов неблагоприятного характера клинического течения, а представленность глубоких стадий и REM-сна (%) ассоциировалась с благоприятным клиническим течением (рисунок). Уровни SPO2ср, WASO, ИД, эффективность сна и степень дневной сонливости по Эпвортской шкале не продемонстрировали значимых ассоциаций с характером клинического течения.
В качестве предиктора ухудшения функционального статуса пациентов, оцениваемого по ТШХ, значимо проявил себя лишь показатель RERA, внесший наибольший вклад в достижение различий в парах сравнения «увеличение дистанции – уменьшение дистанции» (95%-ный доверительный интервал (ДИ) 4–20; p = 0,003 и 95% ДИ 1–19; p = 0,003 соответственно) и «без динамики – увеличение дистанции» (95% ДИ -19–-2; p = 0,005) при проведении процедуры апостериорных попарных сравнений. Остальные полисомнографические параметры не имели значимых ассоциаций с клиническими исходами.
Обсуждение
Попытки оценить прогностическую роль конкретных полисомнографических параметров в наступлении неблагоприятных клинических исходов при сердечной недостаточности уже предпринимались ранее в ряде исследований. Однако в них принимали участие в основном пациенты с СНнФВ. В работе Е.А. Медведевой и соавт. [14] оценивали прогностическую роль основных полисомнографических параметров у 123 пациентов с СНнФВ после эпизода декомпенсации, период наблюдения составил восемь лет. При этом прогностическое значение продемонстрировали всего два из исследуемых полисомнографических параметров – WASO и представленность стадии II медленноволнового сна.
Прогностическая роль показателя WASO подтверждена и в других исследованиях. В работе B. Yan и соавт. с участием 3810 пациентов с СНнФВ выявлено достоверное увеличение сердечно-сосудистой смертности при WASO > 78 минут (отношение шансов 2,240; 95% ДИ 1,377–3,642; р = 0,001) [15]. Увеличение значений WASO при СНнФВ может определяться нарастанием ортопноэ в горизонтальном положении ночью с вторичными пробуждениями и не иметь непосредственной связи с эпизодами обструкции дыхательных путей. Данный механизм менее значим у пациентов с СНсФВ, у которых эпизоды ночного ортопноэ встречаются значительно реже.
При анализе полученных нами данных были установлены закономерные изменения структуры сна у пациентов с СНсФВ, принципиально сходные с ранее выявленными другими авторами, отражающие его фрагментацию и дефицит «глубоких» стадий. Указанные ассоциации проявились в не достигшей критериев статистической достоверности тенденции к увеличению времени WASO и снижению эффективности сна (SE), а также достоверному уменьшению представленности доли REM и медленноволнового сна в группе пациентов с неблагоприятным клиническим течением сердечной недостаточности.
Традиционно общепринятым критерием, определяющим тяжесть обструктивных нарушений дыхания во сне, а также основным инструментом классификации тяжести СОАС считается показатель ИАГ. Однако его прогностическое значение окончательно не определено. В нашем исследовании ИАГ продемонстрировал высокую прогностическую значимость в отношении развития комбинированной конечной точки – неблагоприятного характера клинического течения сердечной недостаточности, ассоциированной с СОАС, а также риска повторных госпитализаций. При этом данный параметр не имел значимых ассоциаций с динамикой по ТШХ, характеризующей функциональный статус и являющейся важной характеристикой качества жизни пациента. В последнее время эксперты подвергают серьезным сомнениям чувствительность ИАГ в отношении тяжести обструктивных расстройств дыхания во сне [16]. В качестве недостатков данного маркера они указывают его недостаточную корреляцию с основными клиническими проявлениями СОАС – храпом, субъективной неудовлетворенностью сном, дневной сонливостью, а также не очень высокую валидность и диагностическую специфичность, что наглядно выражается в достаточно большом разбросе количественных значений при классификации тяжести СОАС [17]. В качестве альтернативных диагностических критериев авторы публикаций предлагают другие функциональные полисомнографические параметры, в частности значение SPO2ср, ИД, общее время ночной десатурации с SPO2 < 90%, RERA [18].
В более ранних исследованиях продемонстрирована прогностическая значимость этих параметров при сердечной недостаточности. Так, B. Gellen и соавт. показали значимое ухудшение клинического прогноза у пациентов с СНнФВ и СОАС при значении SPO2ср < 88% [19]. В нашей работе показатель SPO2ср при демонстрации отчетливой тенденции к снижению в группах с достижением комбинированной конечной точки и ее отдельных компонентов не имел прогностического значения ни по одному из исследуемых клинических исходов. Это может указывать на меньшие по сравнению с другими исследуемыми параметрами (ИД и ИАГ) его чувствительность и специфичность при данной коморбидности. Одной из вероятных причин снижения прогностической роли SPO2ср могло быть и то, что пациенты страдали ожирением с неизбежным развитием дыхательной недостаточности по типу гиповентиляции, оказывающей независимое негативное влияние на уровень SPO2ср.
Особого внимания заслуживает также параметр RERA, продемонстрировавший в нашем исследовании ряд важных ассоциаций. Обнаружены устойчивые ассоциации значений этого показателя как с достижением выбранной в исследовании комбинированной конечной точки, так и отдельных ее компонентов – риска повторных госпитализаций и динамики дистанции по ТШХ. Выявленные нами ассоциации, указывающие на прогностическую значимость данного параметра у пациентов с сердечной недостаточностью и СОАС, вероятно, не случайны. Этот показатель по сути отражает две важные патогенетические составляющие при данной коморбидности: с одной стороны, он тесно связан с обструктивными нарушениями дыхания, поскольку инициируется эпизодами апноэ, с другой – является одним из основных индикаторов фрагментации сна и нарушений нормальной структуры сна в целом у пациентов. С учетом этого параметр RERA в перспективе может не только рассматриваться как один из важных прогностических маркеров ХСН, ассоциированной с СОАС, но и использоваться для разработки патогенетически обоснованных персонифицированных лечебных стратегий для данной когорты пациентов.
Еще одним активно изучаемым в последнее время клиническим маркером СОАС является дневная сонливость, оцениваемая по валидизированной Эпвортской шкале. Представления авторов публикаций о распространенности дневной сонливости, а также ее патогенетической роли и прогностическом значении у пациентов с сердечной недостаточностью и СОАС весьма неоднозначны. Ряд авторов в ходе исследований пришли к выводу, что в целом дневная сонливость характерна для пациентов с сочетанием СОАС и сердечной недостаточностью в меньшей степени, чем для пациентов с СОАС и нормальной сердечной функцией [20]. В других исследованиях пациенты с СОАС и сердечной недостаточностью при оценке по этой шкале имели количество баллов, в среднем сопоставимое с уровнем здоровых лиц [21]. Наиболее вероятной причиной этого авторы назвали гиперактивацию симпатической нервной системы у пациентов с сердечной недостаточностью, что, видимо, также способствует увеличению латентности ко сну у данной категории больных.
В отдельных работах указывается на несовершенство использования собственно Эпвортской шкалы при оценке дневной сонливости у данной категории пациентов. Так, при использовании объективной инструментальной оценки дневной сонливости с помощью множественного теста латенции сна (МТЛС) в работах R. Chervin и соавт. (1999) и A. Abrishamietal (2010) полученные результаты значимо отличались от результатов тестирования по Эпвортской шкале [22, 23]. Тем не менее применение данного опросника в настоящее время является наиболее доступным валидизированным методом оценки дневной сонливости. Уровень дневной сонливости, оцениваемый по Эпвортской шкале, в нашей работе в целом соответствовал аналогичному показателю, полученному в более ранних исследованиях, и не продемонстрировал статистически значимых корреляций с наступлением ни одного из изучаемых клинических исходов при общей тенденции к увеличению среднего балла при неблагоприятном клиническом течении. Таким образом, согласно результатам нашего исследования, степень дневной сонливости по Эпвортской шкале не является значимым прогностическим маркером. Но, вероятно, оценка прогностической роли дневной сонливости могла быть иной при использовании объективных инструментальных диагностических методов, например МТЛС. Проведенное нами исследование имеет также определенные ограничения, обусловленные выбранным интервалом наблюдения и специфическим характером выборки участников, а полученные результаты требуют уточнения в более масштабных и продолжительных исследованиях.
Заключение
Развитие и прогрессирование сердечной недостаточности на фоне синдрома обструктивного апноэ во сне сопровождаются выраженными нарушениями нормальной структуры сна. Наряду с признаками дыхательных расстройств и ночной гипоксемии расстройства сна при исследуемой коморбидности характеризуются выраженной фрагментацией сна и снижением его эффективности. Данные нарушения ассоциируются с неблагоприятным клиническим течением сердечной недостаточности в этой когорте пациентов, а характеризующие их полисомнографические характеристики – ИАГ и RERA служат независимыми предикторами неблагоприятных клинических исходов и в перспективе могут быть использованы для более точной стратификации сердечно-сосудистых рисков и разработки дифференцированного подхода к лечению.
A.V. Yakovlev, PhD, N.F. Yakovleva, PhD
Novosibirsk State Medical University
Contact person: Aleksey V. Yakovlev, alex-yak-card@mail.ru
Introduction. Heart failure with preserved ejection fraction (HFpEF) associated with obstructive sleep apnea syndrome (OSA) accompanied by severe disturbances in the normal structure of sleep. Along with signs of respiratory disorders and nocturnal hypoxemia, these disorders are characterized by expressed fragmentation of sleep and a decrease in its efficiency. The prognostic role of polysomnographic parameters reflecting these disorders has not been sufficiently studied.
Purpose: to evaluate the prognostic significance of the main polysomnographic parameters in patients with HFpEF and OSA.
Material and methods. The study included 207 patients – men with OSA (with apnea/hypopnea index (AHI) >15 per hour) all of whom had abdominal obesity and suffered from arterial hypertension. All patients initially underwent polysomnography, echocardiography, and assessment of serum brain natriuretic peptide precursor levels, also the six-minute walk test was performed. After 12 months of prospective observation, all patients underwent repeated the six-minute walk test and the variant of the clinical course of the disease was assessed.
Results. The study revealed significant correlations with the onset of adverse clinical outcomes in a number of polysomnographic indicators – AHI (37 epis. per hour [32; 42.5] versus 26.5 epis. per hour [21.75; 29.75]; p < 0.001), respiratory effort – related arousal (RERA) (36 epis. per hour [28.5; 38.5] versus 22 epis. per hour [17; 27]; p < 0.001).
Conclusions. The studied polysomnographic parameters (AHI, RERA) are independent predictors of adverse clinical outcomes in HFpEF and OSA and can in the future be used for the development of a differentiated approach to the treatment of patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.