Некоторые аспекты дифференциальной диагностики и лечения болевого синдрома при хроническом панкреатите
- Аннотация
- Статья
- Ссылки
- English
Одним из основных поводов обращения пациента к гастроэнтерологу является абдоминальный болевой синдром. При этом абдоминальная боль отличается большим разнообразием клинических проявлений и требует тщательного анализа для выбора адекватной лечебной тактики.
По определению Международной ассоциации по изучению боли (IASP), уточненному и принятому Советом IASP в 2020 г., боль – это «неприятное сенсорное и эмоциональное переживание, связанное с действительным и возможным повреждением тканей или схожее с таковым переживанием» [1, 2]. Таким образом, боль имеет полезные свойства, сигнализируя о повреждении, но и может быть патологическим фактором, являясь самостоятельной хронической формой болезни [3].
По данным некоторых авторов, распространенность абдоминальной боли составляет от 10 до 46% общей популяции. Выявляется гендерная зависимость: частота ее встречаемости выше у женщин по сравнению с мужчинами, независимо от возраста [4].
Выделяют острые и хронические боли. Острые – боли, которые возникли в течение нескольких минут, часов, не более суток. Хронические – боли, беспокоящие на протяжении трех и более месяцев [5].
Острые боли, в зависимости от вызвавшей их причины, носят различный характер. Боли могут прогрессивно нарастать, что характерно, к примеру, для разрыва аневризмы аорты. Могут носить схваткообразный характер: периодически усиливаться и ослабевать на протяжении небольшого промежутка времени. Такое происходит при развитии билиарной, кишечной или почечной колики. Боли могут приобретать прогрессирующий или постоянный характер, например, в случаях развития острого холецистита или аппендицита. При обострении язвенной болезни и хронического панкреатита боли могут иметь приступообразное течение – медленно нарастать и затем постепенно стихать [6]. При острой боли в животе назначение спазмолитических препаратов и анальгетиков противопоказано до определения ее причины. В этом случае необходимо срочное обследование.
До 90% заболеваний сопровождаются болевыми синдромами, а пациенты с хроническими болями обращаются за медицинской помощью в пять раз чаще остальных людей в популяции [7]. При этом было замечено, что некоторые виды боли оказывают большее влияние на качество жизни. К примеру, в проспективном исследовании D.K. Mullady и соавт. показано, что менее интенсивная непрерывная боль была связана с более низким качеством жизни, повышенной инвалидизацией и более частым обращением за медицинской помощью, чем периодическая [8].
В основе диагностики хронической боли лежит ее разграничение на органическую и функциональную. Для проведения дифференциальной диагностики в первую очередь определяют наличие симптомов тревоги, таких как лихорадка, немотивированное снижение массы тела, примесь крови в стуле и/или другие признаки кровотечения. Также уточняют связь боли с временем суток, приемом пищи, дефекацией и положением тела. Ночные боли, нарушающие сон, не характерны для функциональных заболеваний. Связь боли с приемом пищи может говорить как о наличии хронического панкреатита, эрозивно-язвенных повреждений слизистой желудка и двенадцатиперстной кишки, так и о функциональных нарушениях со стороны желудочно-кишечного тракта. В этом случае при опросе больного важно определить временной промежуток, выделить «голодные» и постпрандиальные боли, а также связь боли с характером съеденной пищи. Боли, связанные с дефекацией, как правило, характеризуют патологию со стороны толстой кишки, например, наличие дивертикулярной болезни или новообразования.
Для дифференциальной диагностики абдоминального болевого синдрома проводится оценка лабораторных показателей. Анемия, лейкоцитоз, повышение скорости оседания эритроцитов, уровня С-реактивного белка, билирубина, гематурия и наличие скрытой крови в кале также свидетельствуют в пользу серьезного заболевания, что обусловливает необходимость проведения тщательного обследования.
Изменения, выявленные в результате инструментальных исследований, также относят к симптомам тревоги [9]. Это эрозивно-язвенные повреждения, различные новообразования, желчнокаменная болезнь (ЖКБ), острый и/или хронический панкреатит, мочекаменная болезнь, метастатические поражения печени и др.
Функциональная боль по своей природе висцеральная, она сопровождается спазмом и нарушением двигательной функции желудочно-кишечного тракта неясного генеза. Ее основу составляет феномен висцеральной гиперчувствительности, что проявляется в снижении порога болевой чувствительности, нарушении механизмов регуляции центральной ноцицепции и эндогенных антиноцицептивных систем [6].
Одним из заболеваний, характеризующихся сложным многокомпонентным болевым синдромом, является хронический панкреатит (ХП). Большинство больных ХП испытывают боли в животе. Боль может принимать разные формы, наиболее частое проявление – хроническая и непрерывная абдоминальная боль с обострениями или без них. Сила боли, ее характер, продолжительность и ответ на терапию различаются. Боль может со временем изменяться у отдельных пациентов, а у некоторых – исчезать. Боль может развиваться на ранних стадиях хронического панкреатита, до развития легко заметных структурных аномалий поджелудочной железы (ПЖ). В этой ситуации бывает сложно определить, действительно ли боль вызвана хроническим панкреатитом [10]. Считается, что ранняя диагностика и лечение могут помочь остановить прогрессирование заболевания и предотвратить осложнения, однако диагностика ранних стадий ХП остается сложной задачей [11]. Для постановки диагноза ХП необходима комплексная оценка, которая заключается в анализе этиологических факторов, клинических симптомов, истории заболевания, данных методов визуализации, в том числе компьютерной томографии, а также анализе питания [12]. Золотым стандартом диагностики ХП является гистологическое исследование, но оно выполняется редко из-за инвазивной природы процедуры, риска осложнений и возможной неинформативности [11].
Типичными причинами боли при ХП считают воспаление поджелудочной железы, повышение внутрипанкреатического давления и панкреатические/внепанкреатические осложнения [13]. Клинически больные ХП обычно описывают свою боль как тупое, резкое или тянущее ощущение в верхней части живота, которое может отдавать в спину и часто появляется или усиливается после приема пищи [14]. Было выделено два типа боли: А-тип – отдельные эпизоды боли, перемежающиеся с безболезненными интервалами, и В-тип – персистирующая боль в течение продолжительных периодов времени.
Как было сказано выше, одной из основных причин боли принято считать воспаление ПЖ. Экспериментально было показано, что воспалительная боль при ХП в целом аналогична другим хроническим воспалительным состояниям. При воспалении происходит экспрессия многочисленных альгогенных факторов, которые обнаруживались и в экспериментальных моделях, и в образцах поджелудочной железы человека. Было показано, что некоторые, но не все эти факторы и молекулы коррелируют с тяжестью боли, хотя причинно-следственная связь не была доказана [14]. Кроме того, приступы боли А-типа не всегда соответствовали «вспышке» воспаления. А в большом проспективном когортном исследовании не было обнаружено корреляции между временным паттерном и наличием или отсутствием радиологических свидетельств воспаления или обструктивной патологии [8]. Таким образом, было доказано, что ХП может приводить к гиперчувствительности болевых реакций на стимуляцию поджелудочной железы, что связано с выраженной сенсибилизацией первичных ноцицептивных нейронов со специфическими электрофизиологическими и молекулярными изменениями. Многочисленные исследования продемонстрировали функциональные изменения при ХП, указывающие на дезадаптивный болевой ответ [14].
Помимо воспаления боль, ощущаемая при ХП, может быть вызвана обструкцией протока поджелудочной железы из-за стриктур и камнеобразования. Желтуха или холангит могут развиться из-за непроходимости желчных путей вследствие воспаления ПЖ вокруг желчного протока, а образование псевдокист ПЖ может вызвать локализованную боль и обструкцию выходного отверстия желудка [11].
Нельзя не упомянуть еще об одном типе абдоминальной боли. Это так называемая билиарная боль. Она связана с патологией желчных путей и может быть обусловлена как органическим заболеванием, так и функциональным. Билиарная боль может возникать при воспалительных и опухолевых заболеваниях желчного пузыря, желчных протоков, при ЖКБ. В этих случаях боль имеет органическое происхождение. Функциональная билиарная боль может возникать при дисфункции сфинктера Одди. Билиарные боли могут быть острыми, по типу желчной колики, что более характерно для ЖКБ, а могут носить длительный ноющий характер, периодически усиливаясь и ослабевая. Такие боли могут быть обусловлены воспалением, опухолью и функциональными нарушениями со стороны желчного пузыря или сфинктера Одди.
При отсутствии явных признаков патологии прибегают к дополнительным исследованиям, таким как эндоскопическая ультрасонография, которая позволяет лучше трансабдоминальной определить микролитиаз размером менее 3 мм; определение холестеринового микролитиаза непосредственно в дуоденальном аспирате; билиарная манометрия, холедохосцинтиграфия и определение коэффициента опорожнения желчного пузыря, что позволяет определить наличие функциональных нарушений [15].
Некоторыми учеными не признается тот факт, что патология желчных путей, в частности ЖКБ, может способствовать формированию хронического панкреатита [16], тем не менее острый панкреатит рассматривается как одно из основных осложнений ЖКБ [17]. Ведущим фактором в патогенезе билиарного панкреатита является повышение давления в желчных протоках вследствие возникновения механического препятствия (конкремент, билиарный сладж, стриктура, опухоль и др.) либо вследствие дисфункции сфинктера Одди. Развитие на этом фоне патологического билиопанкреатического рефлюкса и нарушение оттока панкреатического секрета могут привести к острому билиарному панкреатиту [18]. Следует отметить, что билиарный сладж, предмет некоторых споров и разногласий, возникающий в результате полного парентерального питания, быстрой потери веса, беременности, трансплантации, приема определенных лекарств и других острых и хронических заболеваний, может протекать бессимптомно, элиминироваться самостоятельно, но также может вызывать желчную колику, острый холецистит и острый панкреатит [19].
Купированию боли при ХП посвящено большое количество исследований, консенсусов и публикаций. Большинство ученых сходятся во мнении, что подход к лечению должен быть комплексным и включать не только традиционные методы, но и специфические воздействия, изменяющие восприятие боли центральной нервной системой.
Тем не менее первым шагом в лечении боли является поиск возможных осложнений хронического панкреатита. К ним относят псевдокисты, непроходимость окружающих полых внутренних органов (желчного протока или двенадцатиперстной кишки) и рак. Эти осложнения требуют специального лечения, хотя и не всегда вызывают боль [10]. Как правило, это лечение с применением эндоскопических, малоинвазивных и хирургических методик, в зависимости от ситуации. Показания к хирургическому лечению были уточнены Российским консенсусом по диагностике и лечению хронического панкреатита [20]. Преимущества и недостатки эндоскопических и хирургических способов лечения были проанализированы рабочей группой и в дальнейшем опубликованы в 2017 г. в научно обоснованном и доказательном клиническом протоколе по диагностике и лечению хронического панкреатита Объединенной Европейской гастроэнтерологической ассоциации (HaPanEU) [16].
Вторым аспектом в купировании боли при ХП является устранение этиологического фактора. Все исследователи единодушны во мнении, что больным ХП в дополнение к адекватному лечению следует настоятельно рекомендовать воздержание от алкоголя и курения [14, 20], поскольку они являются факторами высокого риска развития острого и обострения хронического панкреатита. При развитии билиарнозависимого панкреатита проводится лечение билиарного сладжа, желчнокаменной болезни, в том числе хирургическое, устранение дисфункции сфинктера Одди [18, 21]. То же можно сказать о других этиологических формах панкреатитов: при гипертриглицеридемическом панкреатите применяют фибраты и статины, при аутоиммунном – глюкокортикостероиды, цитостатики и антицитокиновые препараты [22, 23].
Когда присутствует изменение центрального восприятия боли, обычное лечение боли, направленное на ноцицептивный очаг, например опиоидная анальгезия или хирургическое/эндоскопическое вмешательство, часто оказывается безрезультатным, даже если оно технически успешно выполнено. Если восприятие боли в центральной нервной системе изменяется, следует назначить специальное лечение, направленное на эти изменения (например, габапентиноиды, кетамин или трициклические антидепрессанты) [13].
Для купирования болевого синдрома применяют несколько групп препаратов. Среди них – прямые ингибиторы секреции ПЖ, ингибиторы протонной помпы (ИПП), анальгезирующие препараты, нестероидные противовоспалительные препараты (НПВП), спазмолитики, ферменты. Проблема медикаментозной терапии для купирования болевого синдрома по-прежнему является предметом дискуссий ввиду большого разнообразия вызывающих его причин.
Подавляющее большинство ученых сходятся во мнении, что адекватное купирование боли имеет большое значение при лечении больных ХП [16, 20]. При этом рекомендуется соблюдение трехступенчатой системы купирования боли по ВОЗ [24]. Сначала назначают парацетамол и препараты из группы НПВП, включая метамизол, затем – центральные анальгетики, при их неэффективности – легкие опиоиды. Далее следуют мощные наркотические анальгетики. На каждом из этапов допускается добавление адъювантных средств (габапентиноиды, антиоксиданты, ферменты и др.), позволяющих усилить действие и/или уменьшить дозу ненаркотических и наркотических анальгетиков [20].
Российский консенсус рекомендует применять ИПП для купирования болевого синдрома при ХП, при этом следует обратить внимание, что в международных рекомендациях нет указаний на их самостоятельную обезболивающую роль. Однако некоторые экспериментальные работы показали, что ИПП вызывали значительное снижение секреции ПЖ [25]. Проспективное рандомизированное исследование у 137 пациентов с хроническим панкреатитом, подтвержденным данными компьютерной томографии, продемонстрировало, что болевой синдром купировался значительно быстрее у пациентов, получавших наряду со стандартной терапией высокие дозы омепразола, по сравнению с пациентами, которые получали только традиционную терапию [26]. Кроме того, целесообразно применение ИПП совместно с НПВП, а также для профилактики образования эрозивно-язвенных повреждений гастродуоденальной зоны как осложнений острого и хронического панкреатита.
Нередко для купирования боли назначаются препараты панкреатина, однако ни один из консенсусов не рекомендует использовать ферменты в этом качестве [16, 20, 27, 28], если только болевой синдром не вызван экзокринной недостаточностью ПЖ и неполноценной ферментозаместительной терапией.
В международных рекомендациях нет указаний на эффект спазмолитиков в качестве препаратов, купирующих болевой синдром при ХП. Однако Российский консенсус рекомендует их применение [20], особенно для пациентов, имеющих билиарный сладж или микролитиаз. Российские ученые считают, что спазмолитические препараты могут применяться для купирования боли любого генеза: и органической, и функциональной. Причем спазмолитики не затрудняют распознавание острой хирургической патологии, поскольку не вмешиваются напрямую в механизмы болевой чувствительности [9, 29].
В настоящее время широкое распространение в лечении синдрома абдоминальной боли, в том числе у больных ХП, и в особенности билиарнозависимых панкреатитов, получила группа миотропных спазмолитиков. Это лекарственные средства, селективно расслабляющие гладкую мускулатуру органов желудочно-кишечного тракта [30]. Миотропные спазмолитики, такие как мебеверин (российский препарат Спарекс®), также применяются в лечении синдрома раздраженного кишечника (СРК) и других функциональных заболеваний желудочно-кишечного тракта. Мебеверин оказывает нормализующее влияние на мускулатуру кишечника, устраняет функциональный дуоденостаз, гиперперистальтику и не вызывает нежелательной гипотонии [30]. Наиболее ценным является возможность его применения в случаях одновременного сочетания нескольких патологий, особенно СРК и дисфункции сфинктера Одди [31]. Достоинством мебеверина является селективность в отношении сфинктера Одди, превышающая в 20–40 раз эффект неселективных спазмолитиков [30]. Препарат мебеверина Спарекс® с уникальной технологией матричного высвобождения лекарственного вещества, изготовленного из европейской субстанции, характеризуется пролонгированным действием. Матричное высвобождение обеспечивает необходимую концентрацию активного вещества в кишечнике в течение 12 часов.
Клинический пример многокомпонентной боли у больного хроническим панкреатитом
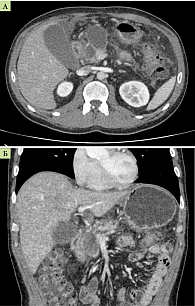
Больной С., 43 года. Из анамнеза известно, что в 2019 г. впервые на фоне погрешности в диете и приема алкоголя отметил появление интенсивных болей в верхних отделах живота, кашицеобразный стул. Больной был госпитализирован в стационар, где установлен диагноз «острый панкреатит». После лечения был выписан с улучшением. Спустя год на фоне погрешности в диете и употребления алкоголя вновь развился острый деструктивный панкреатит. При обследовании в стационаре выявлен парапанкреатический инфильтрат с жидкостными скоплениями в сальниковой сумке, забрюшинном пространстве с признаками формирования псевдокист в головке поджелудочной железы. В дальнейшем, несмотря на соблюдение диетических рекомендаций и отказ от вредных привычек, болевой синдром возобновлялся. Отметил снижение веса на 20 кг за пять месяцев. В апреле 2021 г. больной был обследован в Московском клиническом научно-практическом центре им. А.С. Логинова. По данным компьютерной и магнитно-резонансной томографии выявлены признаки хронического панкреатита, осложненного формированием множественных интра-, пери- и экстрапанкреатических постнекротических кист ПЖ; панкреатическая гипертензия (рис. 1); асцит; тромбоз воротной вены. По данным ультразвукового исследования (УЗИ) выявлен билиарный сладж. На фоне дезинтоксикационной, спазмолитической, терапии прямыми ингибиторами секреции ПЖ и препаратами урсодезоксихолевой кислоты (УДХК) самочувствие больного улучшилось, болевой и диспепсический синдромы купированы, больной выписан с улучшением. Однако через две недели после выписки на фоне стресса пациент вновь отметил появление интенсивного болевого синдрома и был госпитализирован повторно. В анализе крови – гиперамилаземия 307,5 (28,0–100,0) Ед/л, гиперлипаземия 256,3 (0,0–60,0) Ед/л, в анализе мочи – гиперамилазурия 1065,0 (0,0–490,0) Ед/мл. Также отмечался лейкоцитоз 10,34 (4,00–9,00) × 109/л и повышение уровня С-реактивного белка 7,19 (0,00–5,00) мг/л. Снижение уровня панкреатической эластазы – менее 50 мкг/г. При объективном осмотре обращала на себя внимание болезненность при пальпации во всех отделах живота, симптомов раздражения брюшины не выявлено. Индекс массы тела – 20,48 кг/м2.
По данным УЗИ отмечены признаки увеличения и диффузных изменений печени, реканализованного тромбоза воротной вены, диффузных изменений поджелудочной железы, панкреатической гипертензии, кистозных образований поджелудочной железы (постнекротических кист), отечно-инфильтративных изменений парапанкреатической клетчатки, хронического холецистита, билиарного сладжа, холецистолитиаза (сгустки сладжа), дуоденальной дистрофии, небольшого количества свободной жидкости в брюшной полости.
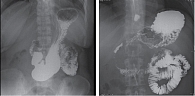
Несмотря на соблюдение диеты, отказ от приема алкоголя и выполнение рекомендаций врача, больного продолжали беспокоить интенсивные боли в эпигастральной области. Болевой синдром мог быть обусловлен наличием крупных постнекротических кист, однако, с учетом относительно недавнего панкреонекроза и тонких стенок кист, хирургическое лечение не было показано. Кроме того, отмечена зависимость между стрессом и усилением болевого синдрома. Помимо осложненного течения хронического панкреатита было заподозрено наличие функциональных изменений, которые могли усиливать болевой синдром. В связи с этим больному было выполнено рентгенологическое исследование, по результатам которого выявлена картина нефиксированной аксиальной кардиальной грыжи пищеводного отверстия диафрагмы, недостаточность кардии, гастроэзофагеальный рефлюкс; отдавливание желудка, вероятно, кистозными структурами поджелудочной железы, без нарушения транзита; дискинезия двенадцатиперстной кишки по гипертоническому типу со спастическим компонентом, дуоденодуоденальным, дуоденобульбарным и дуоденогастральным рефлюксом, дискинезия подвздошной кишки по гипертоническому типу со спастическим компонентом (рис. 2).
Больному была проведена терапия ингибиторами протонной помпы, НПВП, спазмолитиками, препаратами урсодезоксихолевой кислоты, панкреатином в капсулах с мини-частицами. На фоне лечения болевой синдром был купирован. В клиническом и биохимическом анализах крови – положительная динамика в виде снижения панкреатических ферментов, лейкоцитов и С-реактивного белка.
Больной был выписан с рекомендациями продолжить прием ферментов, мебеверина (Спарекс®) по 200 мг два раза в сутки и урсодезоксихолевой кислоты (Эксхол®) по 750 мг на ночь в сочетании с анксиолитиком. В данном случае комбинация мебеверина с УДХК была оправдана в связи с наличием билиарного сладжа и функциональных нарушений органов пищеварения. Эксхол® способствует уменьшению литогенности желчи и растворению сладжа, а Спарекс® как миотропный спазмолитик регулирует расслабление сфинктера Одди и гладкой мускулатуры двенадцатиперстной и подвздошной кишки. Положительный эффект сочетания урсодезоксихолевой кислоты и мебеверина в лечении дисфункции сфинктера Одди и билиарного сладжа был описан А.А. Ильченко и соавт. еще в 2011 г. [32]. В дальнейшем пациент принимал эти препараты на протяжении трех месяцев. На фоне лечения самочувствие было хорошее, боли не беспокоили. По результатам контрольных клинического и биохимического анализов крови, все показатели находились в пределах референсных значений. По результатам контрольного УЗИ органов брюшной полости, отмечалось уменьшение объема билиарного сладжа в два раза. Запланировано дальнейшее наблюдение за больным и повторное обследование, включающее мультиспиральную компьютерную томографию, магнитно-резонансную томографию/холангиопанкреатографию, определение маркеров экзокринной и эндокринной функций ПЖ.
Особенность данного случая – два этиологических фактора, способствующих развитию хронического панкреатита: алкоголь и билиарный сладж. Нельзя исключить вероятность образования сладжа на фоне резкого снижения массы тела. Сладж в дальнейшем мог быть причиной обострения хронического панкреатита и персистирования болевого синдрома. Кроме того, нельзя не отметить многокомпонентный болевой синдром, причиной которого были не только воспалительные изменения ПЖ и осложнения в виде постнекротических кист, но и функциональные нарушения пищеварительного тракта.
Заключение
Абдоминальная боль может сигнализировать о самых разнообразных органических и функциональных заболеваниях. Для успешного лечения боли необходимо тщательное обследование, которое обеспечит понимание ее происхождения. Хронический панкреатит – заболевание, характеризующееся многокомпонентным болевым синдромом, для купирования которого требуются знания и опыт многих специалистов в области гастроэнтерологии, хирургии, инструментальной диагностики, а также неврологии и психологии.
Авторы благодарят М.В. Павлова и Б.С. Никитина за предоставленные фотоматериалы.
E.A. Dubtsova, PhD, L.V. Vinokurova, PhD
A.S. Loginov Moscow Clinical Scientific Center
Contact person: Elena A. Dubtsova, e.dubtsova@mknc.ru
Abdominal pain syndrome is widespread in the population. Pain can be both organic and functional in nature. Pain cider in chronic pancreatitis is characterized by a variety of manifestations, it depends not only on the severity of inflammation, the presence and absence of complications, but as well on individual susceptibility. Due to the fact that abdominal pain in chronic pancreatitis is multicomponent, its treatment requires the careful and deliberate approach using a variety of techniques.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.