Трудный случай дифференциальной диагностики рака поджелудочной железы
- Аннотация
- Статья
- Ссылки
- English
Введение
Дифференциальная диагностика рака поджелудочной железы (РПЖ) с другими заболеваниями этого органа остается одной из самых сложных задач современной панкреатологии. Трудность объясняется возможностью манифестации новообразования эпизодом острого панкреатита (ОП), схожими признаками по данным методов визуализации с очаговой формой аутоиммунного панкреатита (АИП) и наличием хронического панкреатита (ХП) как фактора риска.
РПЖ представляет собой неблагоприятное злокачественное новообразование с неудовлетворительным прогнозом: пятилетняя выживаемость пациентов с этим диагнозом составляет около 5% [1, 2]. Радикальное хирургическое вмешательство остается предпочтительным методом лечения, обеспечивающим лучшие результаты, однако оно применимо исключительно на ранних стадиях заболевания. С учетом того, что на этих стадиях диагноз устанавливается у 10–15% больных, большинству пациентов этот способ лечения недоступен [3]. РПЖ может манифестировать ОП: в этих случаях новообразование сдавливает главный панкреатический проток и, вызвав обструкцию, проявляет себя до момента установления факта наличия самого новообразования [4].
Известно также о множестве факторов, влияющих на развитие РПЖ на фоне ХП. Существующие данные позволяют предположить определенную причинно-следственную связь. Главной гипотезой остается концепция о том, что долго присутствующее воспаление поджелудочной железы (ПЖ) ведет к появлению онкогенных мутаций. Такие мутации могут способствовать канцерогенезу у пациентов, уже имеющих генетическую предрасположенность или подверженных факторам риска (например, потребление никотина) [5]. Дополнительно к вероятности прогрессии ХП в РПЖ существует риск неверной диагностики РПЖ при уже существующих изменениях в данном органе [6].
С учетом многообразия симптомов, которыми проявляется РПЖ на начальных стадиях заболевания, злокачественное поражение ПЖ должно оставаться в дифференциально-диагностическом ряду до постановки основного диагноза.
Клинический случай
В ноябре 2021 г. в отделение заболеваний поджелудочной железы и желчевыводящих путей МКНЦ был госпитализирован мужчина 50 лет. При поступлении он предъявлял жалобы на ежедневную опоясывающую тупую боль в верхних отделах живота, в основном в ночное время, купирующуюся приемом мебеверина.
Пациент длительное время страдал артрозом голеностопных суставов, по поводу чего принимал препараты хондроитинсульфата и глюкозамина. После очередного курса лечения в октябре 2021 г. пациент отметил появление болей в верхних отделах живота с иррадиацией в спину. Мужчина обратился к терапевту по месту жительства. Была проведена эзофагогастродуоденоскопия (ЭГДС), по данным которой выявлен поверхностный диффузный гастрит, недостаточность кардии и положительный результат быстрого уреазного теста на H. pylori. При ультразвуковом исследовании (УЗИ) органов брюшной полости (ОБП) определялись УЗ-признаки взвеси в просвете желчного пузыря, диффузные изменения поджелудочной железы (реактивные изменения), пневматоз. Гастроэнтерологом были назначены 14-дневная эрадикационная тройная терапия, дополненная препаратами висмута, а также мебеверин, препарат урсодезоксихолевой кислоты (УДХК) 750 мг/сут и панкреатин в суточной дозе 75 000 Ед. Контроль эрадикации не проводился. На фоне лечения был отмечен незначительный положительный эффект, но в связи с тем, что боли по ночам сохранялись, пациент был госпитализирован после консультации в клинико-диагностическое отделение МКНЦ им. А.С. Логинова.
При поступлении в клиническом анализе крови (КАК) клинически значимых отклонений выявлено не было, а в биохимическом анализе крови (БАК) обращало на себя внимание незначительное повышение уровня амилазы крови до 109 Ед/л (норма –до 100 Ед/л) и гамма-глутамилтранспептидазы (ГГТП) до 76,7 Ед/л (норма – до 55 Ед/л). Пациент курил на протяжении 15 лет по 20 сигарет в день и в течение 20 лет употреблял алкоголь в объеме до 500 мл крепких алкогольных напитков два-три раза в месяц, на момент госпитализации последние семь лет алкоголь не употреблял. По данным объективного осмотра была отмечена только болезненность в эпигастральной и околопупочной областях при глубокой пальпации.
При ЭГДС выявлены недостаточность кардии, очаговый гастрит, быстрый уреазный тест – отрицательный. При УЗИ ОБП: УЗ-признаки увеличения и диффузных изменений печени, диффузных изменений поджелудочной железы (панкреатит, обострение?), отечных изменений парапанкреатической клетчатки, невыраженной вирсунгоэктазии, билиарного сладжа, нельзя исключить частично реканализованный тромбоз селезеночной вены, небольшое количество свободной жидкости в брюшной полости и малом тазу. При мультиспиральной компьютерной томографии (МСКТ) брюшной полости (БП) с контрастным усилением (КУ) выявлены картина инфильтрации в корне брыжейки с распространением на сосуды целиако-мезентериального бассейна, паренхиму ПЖ и стенку двенадцатиперстной кишки (ДПК) с наличием регионарной лимфаденопатии, тромбоз селезеночной вены, жидкость в полости малого таза. Выявленные изменения следовало дифференцировать между воспалительными изменениями тела ПЖ (панкреатит) и наличием злокачественного новообразования.
Получены результаты анализа крови на онкомаркеры: CA 125 – 41,5 (0,0–35,0) Ед/мл, CA 19-9 – 833,4 (0,0–30,0) Ед/мл.
Следующим этапом в рамках дифференциально-диагностического поиска было решено провести эндоскопическую ультрасонографию (ЭУС). При исследовании были выявлены сонографические признаки, наиболее соответствующие ХП, и лимфатический узел 12 × 8 мм по ходу гепатодуоденальной связки.
Выявленные при обследовании изменения не позволяли ни подтвердить, ни опровергнуть диагноз РПЖ и завершить дифференциальную диагностику. С учетом имеющегося у специалистов отделения опыта ведения таких больных было решено динамически наблюдать пациента, рекомендовать прием сопроводительной терапии и обследоваться повторно через шесть недель или ранее в случае ухудшения самочувствия. Пациенту был рекомендован прием нестероидных противовоспалительных средств (НПВС), препаратов УДХК и полиферментных препаратов в суточной дозе 95 000 Ед липазы (25 000 Ед три раза в сутки с основными приемами пищи и 10 000 Ед два раза в перекусы).
Через три недели пациент вновь обратился в МКНЦ им. А.С. Логинова и был госпитализирован повторно. Боль в верхних отделах живота приняла ежедневный характер, возникала преимущественно в ночное время и не купировалась приемом НПВС и анальгетиков, снизился аппетит, пациент похудел на 4 кг и стал отмечать тошноту по утрам. В контрольных лабораторных исследованиях: КАК – без клинически значимых отклонений, в БАК амилаза крови 111 Ед/л, ГГТП 99 Ед/л, щелочная фосфатаза – 134 Ед/л; онкомаркеры: раковый эмбриональный антиген – в пределах референсных значений, CA 19-9 – 1259 Ед/мл (был 833,4 Ед/мл). Полученный на амбулаторном этапе уровень IgG4 1,28 г/л (норма – 0,1–1,35 г/л) позволял исключить IgG4-ассоциированное заболевание. Существенно возросший уровень СА 19-9 без выраженного холестаза свидетельствовал в пользу злокачественного новообразования.
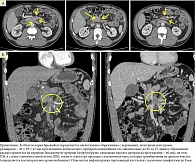
На этом моменте с целью определения дальнейшей тактики было принято решение провести МСКТ БП с КУ повторно (рис. 1).
При повторной МСКТ БП характеристики парапанкреатической инфильтрации с большей степенью вероятности свидетельствовали в пользу злокачественной природы изменений. Согласно клиническим рекомендациям Европейского общества клинической онкологии и NCCN, Министерства здравоохранения РФ и Российского общества клинической онкологии по диагностике и лечению РПЖ, первичным этапом в таких случаях является получение материала образования для морфологического исследования [7–10].
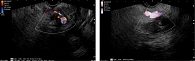
Исследование позволило сориентировать специалистов диагностической эндоскопии на попытку прицельного забора материала (рис. 2).
При повторной ЭУС в головке поджелудочной железы определялась зона пониженной эхогенности с неровными нечеткими контурами размером около 2,5 см, которая муфтообразно охватывала просвет верхней брыжеечной артерии. Была произведена тонкоигольная пункция иглой 25G с получением материала для цитологического исследования. Для купирования абдоминального болевого синдрома больному был выполнен нейролизис: с использованием иглы 22G произведена блокада ганглиев чревного сплетения из двух точек введением 10 мл раствора 95%-ного этилового спирта. При цитологическом исследовании пунктата, полученного при ЭУС, в препаратах на фоне эритроцитов фрагменты стромы, клеток протокового эпителия выявлена часть с дегенеративными изменениями – цитологическая картина, соответствующая доброкачественным изменениям (Panc 2 по Папаниколау) [11]. Таким образом, морфологического подтверждения РПЖ получено не было.
Для контроля развития осложнений после пункции образований ПЖ пациентам выполняется УЗИ брюшной полости. У больного при контрольном исследовании в малом тазу наросло количество свободной жидкости (объемом до 450 мл). В связи с тем, что цитологическое исследование асцитической жидкости могло бы подтвердить или исключить метастатический характер выпота, было принято решение выполнить диагностический лапароцентез. При цитологическом исследовании элементов злокачественного новообразования в предоставленной жидкости также получено не было. Однако трудно купируемый абдоминальный болевой синдром, крайне высокий уровень СА 19-9 и визуальные характеристики парапанкреатической инфильтрации корня брыжейки делали весьма вероятным злокачественный генез данных изменений. В связи с этим, согласно вышеуказанным клиническим рекомендациям, с учетом невозможности получения материала опухоли при УЗИ и эндоУЗИ онкологическим консилиумом было рекомендовано выполнить диагностическую лапароскопию с перитонеальными смывами и забором материала опухоли для верификации новообразования и последующей консультации онколога с результатами дообследования [7–10].
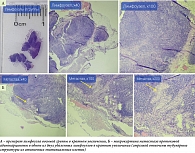
Интраоперационно при ревизии во всех отделах брюшной полости выявлен молочно-белый выпот, не опалесцирующий, непрозрачный, без запаха. При помощи аспиратора эвакуировано 400 мл выпота и направлено на цитологическое исследование. Выявлена выраженная лимфаденопатия. Корень брыжейки, ДПК инфильтрированы. При помощи ультразвукового скальпеля тотально удален лимфоузел восьмой группы. Далее иссечен фрагмент брюшины размером 0,8 × 0,8 см с корня брыжейки. Цитологическое исследование выявило в выпоте картину воспаления. В иссеченном фрагменте брюшины также достоверных гистологических признаков роста злокачественной опухоли не обнаружено, а в одном из двух иссеченных лимфоузлов восьмой группы выявлен метастаз аденокарциномы протокового типа (рис. 3).
Пациенту был установлен диагноз «аденокарцинома крючковидного отростка поджелудочной железы T4N0M0 с вовлечением верхней брыжеечной артерии и верхней брыжеечной вены. Тромбоз селезеночной вены. Желчнокаменная болезнь: билиарный сладж». Через две недели уровень СА 19-9 был выше 2000 Ед/мл (ранее – 1259 Ед/мл). Пациенту с учетом морфологического подтипа опухоли, распространенности опухолевого процесса, сохранного соматического статуса были рекомендованы курсы противоопухолевой лекарственной терапии по схеме FOLFIRINОX.
Обсуждение
Нашей первичной диагностической концепцией с учетом подтвержденных факторов риска был ХП. Однако по мере накопления данных обследования были выявлены признаки, вызывающие сомнения у команды врачей в отношении последнего и наводящие на поиск злокачественного поражения ПЖ.
Необходимо отметить, что сложные случаи диагностики заболевания ПЖ не редкость. Особенную опасность в такой группе представляют ложноотрицательные случаи РПЖ. В ретроспективном исследовании, опубликованном в 2014 г., было показано, что РПЖ остается недиагностированным у 5% больных ХП ввиду сложности дифференциации при инструментальной диагностике [12]. Интересно, что с течением времени вероятность постановки диагноза РПЖ снижается по мере отдаления во времени от точки постановки диагноза ХП (оценка эффекта составила 16,16 (95%-ный доверительный интервал (ДИ): 12,59–20,73), 7,90 (95% ДИ: 4,26–14,66) и 3,53 (95% ДИ: 1,69–7,38) на точках два года, пять и девять лет соответственно). При этом, хотя вероятность диагноза РПЖ в когорте больных ХП со временем снижалась, через пять лет после установки диагноза ХП риск РПЖ был все еще в восемь раз выше, чем у здоровых пациентов [13].
Аналогично РПЖ может манифестировать АИП: безболевая желтуха, повышенный уровень опухолевых маркеров, впервые возникший сахарный диабет [14]. В 4–7% случаев РПЖ встречается повышение уровня IgG4, характерное для АИП первого типа [15].
Семиотика очаговой формы АИП по данным МСКТ БП с КУ также может быть схожа с РПЖ. По данным МСКТ БП подтвердить или опровергнуть возможно только диффузную форму АИП: контуры ПЖ сглажены, орган диффузно увеличен, паренхима контрастируется отсроченно и имеет гиподенсный ободок [15]. В представленном случае очаговое поражение ПЖ было описано только при второй ЭУС; признаки, характерные для обеих форм АИП по МСКТ БП, отсутствовали.
Среди диагностических методик, использованных при диагностике в данном случае, особо стоит отметить ЭУС. Ее преимущество заключается в возможности забора биоматериала. И хотя за проведенной пункционной биопсией в представленном случае подтверждения РПЖ не последовало, по данным литературы, диагностическая ценность ЭУС с проведением тонкоигольной аспирационной биопсии и безопасность исследования довольно высоки (чувствительность 85–92%, специфичность 94–100%, доля осложнений 0,85%) [16–20].
Повышение уровня онкомаркера СА 19-9, отмеченное у нашего пациента, может встречаться как при РПЖ, так и при ХП, при этом у последних причиной становится присутствующее паренхимальное воспаление или (в большей степени) холестаз [21]. Поэтому международными рекомендациями по наблюдению и скринингу РПЖ у больных ХП не рекомендуется использовать только СА 19-9 в качестве диагностического теста на РПЖ [6]. Чувствительность и специфичность СА 19-9 варьируют в пределах 70–92% и 68–92% соответственно, однако чувствительность тесно связана с размером образования, поэтому при образованиях малых размеров диагностическая ценность низкая, и руководствоваться уровнем этого параметра нужно с осторожностью [22, 23]. Отсутствие холестаза у нашего пациента и быстрое нарастание уровня СА 19-9 не позволяло остановить диагностический поиск.
Среди клинических симптомов, отсутствующих у нашего пациента, настороженность у врача, проводящего дифференциальный диагноз, должна также вызывать впервые выявленная гипергликемия. В ретроспективных исследованиях среди пациентов старше 50 лет в пределах трех лет от постановки диагноза «сахарный диабет» РПЖ был диагностирован у 0,5–1% группы, то есть в 6–8 раз чаще, чем в здоровой популяции [24, 25].
В представленном случае завершить диагностический процесс позволило лишь морфологическое подтверждение РПЖ. Команда врачей следовала международным и отечественным рекомендациям по диагностике РПЖ, переходя от минимально к максимально инвазивным способам получения материала из опухоли.
Дифференциальный диагноз РПЖ с другими заболеваниями ПЖ остается серьезной задачей. Сложность заключается в схожести клинической картины разных заболеваний данного органа и отсутствии, за исключением цитологического или морфологического подтверждения, патогномоничных симптомов или исследований. Ввиду трудности проблемы РПЖ должен оставаться в дифференциально-диагностическом ряду до установления клинического диагноза.
M.A. Kiryukova, E.A. Dubtsova, PhD, L.V. Vinokurova, PhD, I.V. Savina, M.V. Malykh, K.K. Noskova, PhD, E.V. Parfenchikova, PhD, R.V. Vorobyov, M.E. Baichorov, PhD, D.S. Bordin, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Tver State Medical University
Contact person: Maria A. Kiryukova, m.kirukova@mknc.ru
Differential diagnosis of pancreatic cancer (PC) and other pancreatic diseases is a difficult task for physicians in various specialties. This is due to the common risk factors, alike clinical manifestations, similar laboratory markers and radiology semiotics. The paper presents a clinical case with complex differential diagnosis of PC.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.