Роль ретинол-связывающего белка в дифференциальной диагностике рака поджелудочной железы
- Аннотация
- Статья
- Ссылки
- English
Цель – изучить изменения уровня РСБ-4 у пациентов с ХП и РПЖ на фоне СД.
Материал и методы. Нами было обследовано 66 больных, 36 мужчин и 30 женщин в возрасте от 27 до 81 года, из них 27 (40,9%) больных РПЖ и 39 (59,1%) больных ХП. СД выявлен у 30 (45,4%) пациентов. Диагноз РПЖ подтвержден морфологически, диагнозы ХП и СД установлены на основании лабораторно-инструментальных данных. Всем пациентам проведено биохимическое исследование крови с оценкой уровня РСБ-4. Результаты проанализированы с помощью дисперсионного анализа ANOVA, теста Краскелла – Уоллиса и медианного теста, рассчитаны коэффициенты корреляции Пирсона (r).
Результаты. Средние значения концентрации РСБ-4 были выше у пациентов с РПЖ и СД. Выявлена статистически значимая корреляция между уровнем РСБ-4 и возрастом пациентов с СД (r = 0,38, р = 0,04). При этом у пациентов без СД концентрация РСБ-4 не коррелировала с возрастом (r = -0,06, р = 0,7). Значение медианы концентрации РСБ-4 в группе пациентов с РПЖ было статистически значимо ниже, чем у больных ХП. В обеих группах пациенты не имели СД. Рассчитано пороговое значение концентрации РСБ-4 для РПЖ – 22 нг/мл. В группе пациентов без СД обнаружена отрицательная статистически значимая корреляция между значением РСБ-4 и наличием у них РПЖ (r = -0,4, р = 0,016).
Заключение. Уменьшение концентрации РСБ-4 в сыворотке крови ниже уровня общегрупповой медианы (22 нг/мл) может иметь значение для проведения дифференциальной диагностики между РПЖ и ХП у пациентов, не страдающих СД. Наличие у пациентов СД ограничивает применение РСБ-4 для дифференциальной диагностики заболеваний ПЖ, что не позволяет использовать его как универсальный маркер РПЖ или ХП.
Цель – изучить изменения уровня РСБ-4 у пациентов с ХП и РПЖ на фоне СД.
Материал и методы. Нами было обследовано 66 больных, 36 мужчин и 30 женщин в возрасте от 27 до 81 года, из них 27 (40,9%) больных РПЖ и 39 (59,1%) больных ХП. СД выявлен у 30 (45,4%) пациентов. Диагноз РПЖ подтвержден морфологически, диагнозы ХП и СД установлены на основании лабораторно-инструментальных данных. Всем пациентам проведено биохимическое исследование крови с оценкой уровня РСБ-4. Результаты проанализированы с помощью дисперсионного анализа ANOVA, теста Краскелла – Уоллиса и медианного теста, рассчитаны коэффициенты корреляции Пирсона (r).
Результаты. Средние значения концентрации РСБ-4 были выше у пациентов с РПЖ и СД. Выявлена статистически значимая корреляция между уровнем РСБ-4 и возрастом пациентов с СД (r = 0,38, р = 0,04). При этом у пациентов без СД концентрация РСБ-4 не коррелировала с возрастом (r = -0,06, р = 0,7). Значение медианы концентрации РСБ-4 в группе пациентов с РПЖ было статистически значимо ниже, чем у больных ХП. В обеих группах пациенты не имели СД. Рассчитано пороговое значение концентрации РСБ-4 для РПЖ – 22 нг/мл. В группе пациентов без СД обнаружена отрицательная статистически значимая корреляция между значением РСБ-4 и наличием у них РПЖ (r = -0,4, р = 0,016).
Заключение. Уменьшение концентрации РСБ-4 в сыворотке крови ниже уровня общегрупповой медианы (22 нг/мл) может иметь значение для проведения дифференциальной диагностики между РПЖ и ХП у пациентов, не страдающих СД. Наличие у пациентов СД ограничивает применение РСБ-4 для дифференциальной диагностики заболеваний ПЖ, что не позволяет использовать его как универсальный маркер РПЖ или ХП.
Рак поджелудочной железы (РПЖ) занимает одно из лидирующих мест в структуре смертности от рака и, по прогнозам, к 2030 г. станет третьей ведущей причиной смерти от рака из-за отсроченной диагностики и медленного прогресса в развитии лечения [1]. Печальный прогноз при этом заболевании обусловлен анатомическими особенностями поджелудочной железы (ПЖ) – местоположение в забрюшинном пространстве затрудняет процесс диагностики, а также поздним развитием симптомов заболевания: РПЖ вызывает симптомы только тогда, когда опухоль в своем развитии достигла продвинутой стадии и больше не является локально резектабельной [2]. Хронический панкреатит (ХП) как причина развития РПЖ признается многими исследователями. Считается, что риск возникновения РПЖ у больных ХП выше, чем в популяции, в 20 раз, а при наследственном ХП – в 50–60 раз [3, 4]. В связи с этим поиск новых маркеров РПЖ, равно как и дифференциальная диагностика ХП и РПЖ, остается актуальным.
Как известно, при любом поражении ПЖ может развиваться ее экзо- и эндокринная недостаточность [5]. Следствием эндокринной недостаточности ПЖ является сахарный диабет (СД) 3С типа [6]. Экзокринная недостаточность ПЖ развивается при дефиците панкреатической липазы и проявляется симптомами мальдигестии жира и кишечными расстройствами [7, 8], а также рядом клинических маркеров мальнутриции [9]. При экзокринной недостаточности ПЖ наблюдаются изменения нутритивного статуса, лабораторными маркерами которых является снижение концентрации различных веществ, в том числе гемоглобина, альбумина, преальбумина, ретинол-связывающего белка (РСБ), трансферрина, микроэлементов и жирорастворимых витаминов, а также абсолютного числа лимфоцитов [10–12]. Особое внимание отечественные и зарубежные исследователи в последнее время уделяют одному из маркеров нутритивного статуса – РСБ и возможностям его использования в диагностике заболеваний ПЖ, прежде всего РПЖ.
РСБ представляет собой семейство белков, из которого наибольший интерес представляют внутриклеточные РСБ-1 и РСБ-2, интерстициальный РСБ-3 и плазменный РСБ-4 [13, 14]. РСБ-4 синтезируется в гепатоцитах, в меньшей степени в адипоцитах. В плазме крови секретируемый гепатоцитами РСБ-4, будучи связанным с молекулой ретинола, соединяется с крупным гомотетрамером транстиретином (преальбумином) и в таком состоянии транспортируется в ткани. Данный процесс необходим для снижения почечного клиренса РСБ-4 [14, 15].
Помимо непосредственно транспортировки ретинола к тканям функции РСБ-4 в организме человека многообразны, что отражено в ряде работ. Большинство точек приложения РСБ-4 связаны с процессами воспаления и углеводного обмена. Активно изучается роль РСБ-4 в развитии атеросклероза, артериальной гипертензии и ишемической болезни сердца как следствия сердечно-сосудистых заболеваний [16, 17]. Действие РСБ-4 реализуется через участие в воспалительном процессе в сосудах и усилении пролиферации гладкомышечных клеток, а следовательно, в развитии атеросклеротической бляшки и повышении риска ее разрыва [16, 18]. Однако в крупных популяционных исследованиях окончательного вывода о существовании взаимосвязи между сердечно-сосудистыми заболеваниями и уровнем РСБ-4 не сделано [19, 20]. В гастроэнтерологической практике измерение уровня РСБ-4 нашло отражение в оценке нутритивного статуса у пациентов с экзокринной недостаточностью ПЖ [21].
Влияние РСБ-4 на воспаление обсуждается в научной литературе, при этом также получены взаимно противоположные результаты. Показано стимулирующее влияние РСБ-4 на высвобождение интерлейкина (ИЛ) 6 макрофагами и эндотелиоцитами [22, 23]. Однако прямая зависимость между уровнями РСБ-4 и ИЛ-6 выявлена только некоторыми авторами [24]. В то же время в других работах показана обратная связь между уровнями РСБ-4 и ИЛ-6 [25]. Описана положительная корреляционная связь между концентрацией CD68 и ИЛ-8 и уровнем экспрессии РСБ-4 в жировой ткани [23, 26]. Кроме того, Р.М. Moraes-Vieira и J. Norseen и соавт. показали стимулирующее влияние РСБ-4 на продукцию фактора некроза опухоли альфа в Т-клетках и макрофагах [23, 27].
Особенности выделения РСБ-4 почками послужили основанием для исследования возможностей клиренса в качестве чувствительного маркера поражения проксимальных почечных канальцев, в частности при болезни Фанкони, когда начинают секретироваться с мочой более крупные (72 кДа) комплексы «РСБ-4 – транстиретин» [28]. Новые способы измерения уровня свободного РСБ-4 в моче позволяют применять РСБ-4 в качестве раннего маркера нефропатии у пациентов с СД [29].
При синдроме поликистозных яичников обнаружено повышение уровня РСБ-4 у женщин в возрасте 30 лет и младше. Изменение уровня РСБ-4 у женщин старше 30 лет не зафиксировано. S. Lingaiah и соавт. связывают этот феномен с нарушением обмена триглицеридов, увеличением размеров и функциональной активности адипоцитов, а также с повышением концентрации андрогенов, характерным для синдрома поликистозных яичников [30].
Крайне важно влияние РСБ-4 на формирование инсулинорезистентности, которое реализуется за счет стимуляции глюконеогенеза в печени и ингибирования сигнальных путей инсулина в мышцах [31–33].
По данным литературы, РСБ-4 является одним из медиаторов развития инсулинорезистентности у пациентов с ожирением [34].
Т.Е. Graham и соавт. установили, что уровень РСБ-4 коррелирует с повышением индекса массы тела, уровня триглицеридов плазмы крови и систолического артериального давления и снижением концентрации липопротеинов высокой плотности [32, 33].
У пациентов, не имеющих избыточной массы тела, ожирения или СД, обнаружена отрицательная корреляционная связь между уровнем РСБ-4 и чувствительностью к инсулину. При этом в данной группе не выявлено зависимости между уровнем РСБ-4 и индексом массы тела [35].
В ряде исследований изменения уровня РСБ-4 связывают с развитием различных видов рака, в том числе РПЖ [36, 37]. Связь между изменением уровня РСБ-4 и развитием РПЖ или ХП может быть опосредована через звездчатые клетки стромы поджелудочной железы (ЗКПЖ), которые играют важную роль в патогенезе ХП и РПЖ, при активации регулируя опухолевый рост, метастазирование и влияя на устойчивость опухоли к химиотерапии [38, 39]. ЗКПЖ интенсивно накапливают витамин А благодаря активности внутриклеточной фракции РСБ [40]. Активированные ЗКПЖ экспрессируют рецепторы ретиноевой кислоты, которые взаимодействуют с трансретиноевой кислотой – метаболитом витамина А. Активация рецептора витамина А снижает сократительную способность ЗКПЖ и противодействуeт их активации, следовательно, снижается риск развития РПЖ и ХП [39].
Актуальность выявления маркеров для ранней диагностики РПЖ обусловлена высокими показателями смертности и низкой выживаемостью больных [41, 42]. По данным O. Ishikawa и соавт., пятилетняя выживаемость пациентов с опухолями диаметром до 10 мм приближается к 75%, а с опухолями размером от 10–20 мм снижается до 25–30% [43, 44]. Таким образом, добиться значимого продления жизни больных РПЖ можно при диагностике заболевания на первой стадии.
Хроническое воспаление, в частности ХП, может оказывать стимулирующее влияние на развитие РПЖ [45]. Вероятнее всего, это происходит вследствие нарушения внутриклеточных процессов и ремоделирования межклеточного матрикса [45, 46]. По данным крупного многоцентрового исследования, охватившего 22 центра в Японии, кумулятивный риск развития РПЖ у пациентов с ХП через десять лет после установления диагноза составляет 2,6%, а через 25 лет после выявления ХП – 12,2% [38, 47]. Эти данные согласуются с результатами S. Ling и соавт.: при наличии в анамнезе ХП риск развития РПЖ в течение 20 лет возрастает в пять раз [48].
Одним из симптомов РПЖ является СД или нарушение толерантности к глюкозе. В ряде исследований показана связь между СД 2-го типа и повышенным риском развития РПЖ. К возможным механизмам относятся резистентность к инсулину и гиперинсулинемия, которые увеличивают пролиферацию островковых клеток и тем самым способствуют развитию РПЖ, особенно у пациентов старше 50 лет [49, 50].
Целью данной работы было изучение изменений уровня РСБ-4 у пациентов с ХП и РПЖ на фоне СД.
Материал и методы
Нами было обследовано 66 больных, 36 мужчин и 30 женщин в возрасте от 27 до 81 года, из них 27 (40,9%) больных РПЖ и 39 (59,1%) больных ХП. СД выявлен у 30 (45,4%) пациентов. При этом 14 (21,2%) из них страдали РПЖ (средний возраст – 66 ± 7,2 года) и 16 (24,2%) – ХП (средний возраст – 48,2 ± 12,5 года). 36 (54,6%) больных не имели СД, из них 13 (19,7%) больных РПЖ (средний возраст – 63,8 ± 10,7 года) и 23 (34,9%) больных ХП (средний возраст – 51,6 ± 10,1 года).
Диагноз РПЖ подтвержден морфологическими данными, диагноз ХП установлен на основании результатов лабораторно-инструментальных методов исследования.
Всем пациентам проведено биохимическое исследование крови с оценкой уровня РСБ-4. РСБ-4 определяли путем количественного анализа ELISA в сыворотке крови, взятой натощак, с помощью набора Immundiagnostik AG (Германия) в соответствии с инструкцией производителя.
В рамках статистической обработки полученных данных проведен парный корреляционный анализ с вычислением коэффициента корреляции Пирсона (r). Достоверность и значимость межгрупповых различий по уровню концентрации РСБ-4 оценивались с помощью дисперсионного анализа (ANOVA). Доверительный интервал (ДИ) составил 95%, различия считались статистически значимыми при p ≤ 0,05. В ходе статистического анализа формировались отдельные группы по конкретным признакам, которые сравнивались попарно. Истинность нулевой гипотезы проверялась с помощью теста Краскелла – Уоллиса и медианного теста.
Весь комплекс статистической обработки и визуализации результатов осуществлен при использовании лицензионного программного обеспечения IBM SPSS.
Результаты
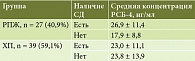
Результаты изучения концентрации РСБ-4 в исследованных группах представлены в таблице. Как видим, средняя концентрация выше у пациентов с СД в группе РПЖ. У пациентов с ХП наблюдалась обратная картина: у пациентов с СД средняя концентрация РСБ-4 ниже, чем у пациентов без СД.
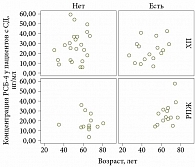
Выявлена статистически значимая корреляция между уровнем РСБ-4 и возрастом пациентов с СД (r = 0,38, p = 0,04). При этом у пациентов без СД концентрация РСБ-4 не коррелировала с возрастом (r = -0,06, р = 0,7). Описанные изменения уровней концентрации РСБ-4 в зависимости от возраста и наличия РПЖ и СД представлены в виде совмещенных графиков распределения (рис. 1). Показана зависимость распределения значений концентрации РСБ-4 от возраста только у пациентов с СД. При этом наблюдался независимый характер распределения значений концентрации РСБ-4 относительно возраста у пациентов с РПЖ и без СД. Корреляция между уровнем РСБ-4 и возрастом больных ХП независимо от наличия СД не установлена.
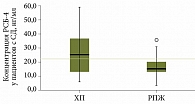
Статистически значимые отличия получены при сравнении медиан концентрации РСБ-4 у пациентов с РПЖ (медиана – 15,2 нг/мл) и пациентов с ХП (медиана – 25,3 нг/мл). Пациенты обеих групп не имели СД (р = 0,037). На основании полученных данных нами рассчитано пороговое значение концентрации РСБ-4 – 22 нг/мл (рис. 2).
У пациентов без СД обнаружена отрицательная статистически значимая корреляция между уровнем РСБ-4 и наличием РПЖ (r = -0,4, p = 0,016). Установлена слабая положительная корреляционная связь между концентрацией РСБ-4 и наличием кальцифицирующего панкреатита у пациентов без СД (r = 0,36, p = 0,03).
Обсуждение
Рак поджелудочной железы является агрессивным злокачественным новообразованием с плохим прогнозом, в связи с чем поиск биохимических маркеров для ранней диагностики этого заболевания крайне актуален. Высокая распространенность и значимость ХП в генезе РПЖ обусловливают необходимость поиска способов дифференциальной диагностики РПЖ на фоне ХП [38].
Ретинол и его метаболиты играют важную роль в патогенезе РПЖ и ХП благодаря активному участию в обменных процессах в ЗКПЖ. Уровень РСБ-4 в сыворотке крови отражает активность внутриклеточной фракции РСБ, что позволяет использовать его для оценки активности метаболических процессов, в которых участвует витамин А [35].
Мы измеряли уровни РСБ-4 у больных ХП и РПЖ на фоне СД. По нашим данным, средние значения концентрации РСБ-4 были выше у пациентов с СД и РПЖ. В группе ХП среднее значение концентрации РСБ-4 у пациентов СД было ниже, чем у пациентов без СД. Однако при таком подходе к оценке были выявлены только тенденции значимости межгрупповых отличий.
Выявленное нами снижение уровня РСБ-4 у пациентов с РПЖ без СД принципиально согласуется с результатами, полученными B. Wlodarczyk и соавт., а также C. Fabris и соавт. [37, 51]. Эти данные находят подтверждение в работе M. Ehmann и соавт., в которой повышения уровня белков молекулярной массой больше 20 кДа у пациентов с РПЖ не обнаружено, а молекулярная масса РСБ-4 составила 21 кДа [52].
Противоположные результаты получены H.O. El-Mesallamy и соавт. Изучив образцы крови пациентов с РПЖ, исследователи выявили статистически значимое (p < 0,001) повышение уровня РСБ-4 [36]. Авторы объясняют этот феномен участием РСБ-4 в процессе формирования инсулинорезистентности при панкреатогенном СД, ассоциированном с РПЖ, или со стимуляцией выработки РСБ-4 самой опухолью. После удаления опухоли уровень РСБ-4 снижался [36].
B. Wlodarczyk и соавт. не выявили статистически значимых отличий в уровне РСБ-4 между группами пациентов с РПЖ и ХП (p = 0,88), а также статистически значимых различий в зависимости от наличия СД [37]. Напротив, в нашем исследовании результаты статистически значимы именно в группе пациентов без СД.
Отсутствие различий между уровнем РСБ-4 у пациентов с РПЖ и ХП, описанное в работе B. Wlodarczyk и соавт., можно объяснить одинаковым характером распространения подкожной и висцеральной жировой ткани в обеих группах, поскольку, по данным N. Kloting и соавт., именно висцеральная жировая ткань продуцирует РСБ-4 наряду с печенью [53].
Кроме того, различия могут быть обусловлены возрастными особенностями: уровень РСБ-4, по данным ряда авторов, зависит от возраста пациента [35]. В нашем исследовании статистически значимых связей между полом и уровнем РСБ-4 не получено, но выявлена положительная корреляция между уровнем РСБ-4 и возрастом пациентов с СД. Опираясь на полученные нами данные, можно предположить, что корреляционные взаимоотношения между концентрацией РСБ-4 и возрастом пациентов с РПЖ связаны не столько с метаболическими изменениями в разных возрастных группах, сколько с особенностями распространенности РПЖ в разных возрастных группах. В нашем исследовании средний возраст пациентов в группе РПЖ был выше (64,9 ± 9,0 года), чем в группе ХП (50,3 ± 11,1 года), что коррелирует со статистическими данными в России и мире [54, 55].
Механизм развития панкреатогенного СД при ХП и РПЖ различен: если в первом случае это осложнение заболевания вследствие разрушения ткани ПЖ, в том числе островков (развитие воспаления, фиброза, кальциноза) [56], то при РПЖ симптом заболевания может быть связан не только с повреждением ПЖ, но и с метаболизмом опухоли и ее влиянием на секрецию панкреатических гормонов, в том числе инсулина [49, 57].
Согласно нашим данным, статистически значимые результаты получены в группах пациентов без СД. Это может быть обусловлено тем, что в нашем исследовании в большинстве случаев СД имел панкреатогенную природу. То есть СД развивался при значительном поражении паренхимы ПЖ на поздних стадиях заболевания. Кроме того, колебания концентрации РСБ-4 у пациентов с СД напрямую связаны с развитием инсулинорезистентности [31], что нивелирует изменения концентрации РСБ-4 у пациентов без СД. Таким образом, можно рассмотреть возможность применения РСБ-4 как одного из маркеров раннего РПЖ.
J.B. Greer и соавт. получили данные о снижении уровня РСБ-4 у пациентов с ХП. Это может объясняться тем, что в исследовании не были выделены пациенты с кальцифицирующим ХП и большая часть обследованных больных не имели кальцификации ПЖ [58]. Выявленная нами тенденция к повышению концентрации РСБ-4 у пациентов с кальцифицирующим ХП и без СД может быть связана с активной ролью ЗКПЖ в генезе фиброзных изменений ПЖ. Важную роль в их активации играет витамин А, что, вероятно, обусловливает повышение активности не только внутриклеточной, но и сывороточной фракции РСБ [40].
Заключение
Значение медианы концентрации РСБ-4 у пациентов с РПЖ статистически значимо ниже, чем у больных ХП без СД. Значение концентрации РСБ-4 у пациентов с РПЖ и СД имеет статистическую связь с возрастом, что затрудняет интерпретацию уровня РСБ-4 как диагностического маркера.
Таким образом, наличие у пациентов СД ограничивает применение РСБ-4 для дифференциальной диагностики заболеваний ПЖ, что не позволяет использовать его как универсальный маркер РПЖ или ХП.
У пациентов, не страдающих СД, уменьшение концентрации РСБ-4 в сыворотке крови ниже значения общегрупповой медианы (22 нг/мл) может иметь значение для проведения дифференциальной диагностики между РПЖ и ХП.
Полученные нами результаты показывают перспективность дальнейшего изучения РСБ-4 в качестве компонента комплексной диагностики раннего РПЖ.
L.V. Vinokurova, PhD, K.A. Lesko, PhD, D.S. Bordin, PhD, Prof., Ye.А. Dubtsova, PhD, Ye.Yu. Tyulyaeva, G.G. Varvanina, PhD
A.S. Loginov Moscow Clinical Scientific Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Tver State Medical University, Tver
Contact person: Dmitry S. Bordin, d.bordin@mknc.ru
Background. Correct differential diagnosis of pancreatic cancer (PC) is extremely important due to high death rate of PC. Retinol-binding protein 4 (RBP-4) is known as a substance implicated in pathophysiology of inflammation, carcinogenesis and insulin resistance. Moreover, RBP-4 is regarded as a diagnostic tumor marker of PC. Unfortunately, there is not enough information concerns RBP-4 rate fluctuations in patients with PC and chronic pancreatitis (CP), especially concerning potential diabetes mellitus (DM) effects on RBP-4 metabolism.
Purpose. To study RBP-4 level fluctuations in patients with PC and CP in diabetes mellitus background.
Material and methods. We obtained data from 66 patients – 36 males and 30 females (age range 27–81 years). There were 27 (40.9%) PC cases and 39 (59.1%) CP cases, also, DM was in 30 (45.4%) patients. PC cases were verified by pathology. CP and DM cases were diagnosed upon radiology and laboratory findings. Serum RBP-4 levels were analyzed in all patients.
Results. Mean serum RBP-4 levels were higher in patients with PC and DM. There was statistically significant positive correlation between serum RBP-4 level and age of patients with DM (r = 0.38, р = 0.04). Oppositely, serum RBP-4 level did not correlate with age in patients without DM (r = -0.06, р = 0.7). Serum RBP-4 levels in patients without DM were statistically significant lower in patients with PC, than in patients with CP (р = 0.037). We calculated cut-off point of serum RBP-4 level – 22 ng/ml. There was statistically significant negative correlation between serum RBP-4 level and PC prevalence in patients without DM (r = -0.4, р = 0.016).
Conclusion. Serum RBP-4 level decrease lower than 22 ng/ml can be helpful in PC differential diagnosis with CP in patients without DM. DM limits possibilities of serum RBP-4 level assessment for PC differential diagnosis, thus RBP-4 cannot be universal diagnostic marker either PC or CP.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.