Неселективные β-блокаторы при циррозе печени: эффект «терапевтического окна» и выживаемость пациентов
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проведено ретроспективное исследование по типу «случай-контроль». В группу «случай» были включены 278 взрослых пациентов с декомпенсированными заболеваниями печени различной этиологии, включенных в ЛОТП, которым во время ожидания ТП проводили терапию НСББ. Группу «контроль» составили 72 пациента с декомпенсированными заболеваниями печени различной этиологии, включенные в ЛОТП, которые во время ожидания ТП не получали терапию НСББ. Для последующего анализа группа пациентов, получавших НСББ (n = 278), была разделена на две подгруппы: с наличием «терапевтического окна» (n = 175), и без него (n = 103). Выживаемость пациентов определяли методом Каплана – Майера. Предикторы смертности пациентов, получавших НСББ при отсутствии «терапевтического окна» для НСББ, определяли с помощью модели пропорциональных рисков Кокса в группах пациентов c РА (n = 103) и без РА (n = 175).
Результаты. Выживаемость пациентов, получавших НСББ при наличии «терапевтического окна», для НСББ значимо выше, чем в группе больных, получавших НСББ в ЛОТП, при ожидании ТП в отсутствие «терапевтического окна» для НСББ (логарифмический ранг < 0,0001). Риск развития смерти у больных с РА, получавших НСББ, был значимо выше, чем у больных без РА (отношение риска смерти, HR = 2,285; доверительный интервал 1,237–4,220; р = 0,008). Риск развития смерти для больных, получавших пропранолол, оказался значимо отличным от карведилола (HR = 2,152 и HR = 0,765; p = 0,042 соответственно).
Заключение. Результаты исследования подтвердили гипотезу о существовании «терапевтического окна» для НСББ при их назначении больным с декомпенсированным циррозом печени и включенным в ЛОТП. Использование НСББ способствует увеличению смертности пациентов с РА независимо от вида препарата в случае, когда развивается фаза «закрытого терапевтического окна». В целях снижения смертности пациентов, ожидающих ТП в течение нескольких лет вследствие острого дефицита органов, врачи, ведущие пациентов в ЛОТП, должны оценивать риск и пользу от применения НСББ.
Материал и методы. Проведено ретроспективное исследование по типу «случай-контроль». В группу «случай» были включены 278 взрослых пациентов с декомпенсированными заболеваниями печени различной этиологии, включенных в ЛОТП, которым во время ожидания ТП проводили терапию НСББ. Группу «контроль» составили 72 пациента с декомпенсированными заболеваниями печени различной этиологии, включенные в ЛОТП, которые во время ожидания ТП не получали терапию НСББ. Для последующего анализа группа пациентов, получавших НСББ (n = 278), была разделена на две подгруппы: с наличием «терапевтического окна» (n = 175), и без него (n = 103). Выживаемость пациентов определяли методом Каплана – Майера. Предикторы смертности пациентов, получавших НСББ при отсутствии «терапевтического окна» для НСББ, определяли с помощью модели пропорциональных рисков Кокса в группах пациентов c РА (n = 103) и без РА (n = 175).
Результаты. Выживаемость пациентов, получавших НСББ при наличии «терапевтического окна», для НСББ значимо выше, чем в группе больных, получавших НСББ в ЛОТП, при ожидании ТП в отсутствие «терапевтического окна» для НСББ (логарифмический ранг < 0,0001). Риск развития смерти у больных с РА, получавших НСББ, был значимо выше, чем у больных без РА (отношение риска смерти, HR = 2,285; доверительный интервал 1,237–4,220; р = 0,008). Риск развития смерти для больных, получавших пропранолол, оказался значимо отличным от карведилола (HR = 2,152 и HR = 0,765; p = 0,042 соответственно).
Заключение. Результаты исследования подтвердили гипотезу о существовании «терапевтического окна» для НСББ при их назначении больным с декомпенсированным циррозом печени и включенным в ЛОТП. Использование НСББ способствует увеличению смертности пациентов с РА независимо от вида препарата в случае, когда развивается фаза «закрытого терапевтического окна». В целях снижения смертности пациентов, ожидающих ТП в течение нескольких лет вследствие острого дефицита органов, врачи, ведущие пациентов в ЛОТП, должны оценивать риск и пользу от применения НСББ.


Введение
Около сорока лет назад D. Lebrec и соавт. [1] сообщили о способности пропранолола предупреждать рецидивирующие кровотечения из варикозных узлов у больных циррозом печени (ЦП). Это исследование дало старт использованию неселективных β-блокаторов (НСББ) при ЦП и, в частности, при наличии портальной гипертензии (ПГ). В последующие годы в нескольких рандомизированных клинических исследованиях была продемонстрирована эффективность НСББ для предупреждения развития первичных и вторичных кровотечений из пищеводно-желудочных варикозных узлов [2–6] и портальной гипертензивной гастропатии [7]. Было установлено, что в результате снижения сердечного выброса и индукции висцеральной вазоконстрикции, опосредованных блокадой β1- и β2-адренергических рецепторов, соответственно, НСББ снижают внутрипеченочное венозное портальное давление [2]. В дополнение к этому эффекту за счет снижения градиента печеночного венозного давления НСББ способствуют уменьшению риска развития рефрактерного асцита и гепаторенального синдрома [8, 9]. Независимо от гемодинамического ответа НСББ снижают кишечную проницаемость и бактериальную транслокацию, предупреждая развитие спонтанного бактериального перитонита (СБП) – распространенной фатальной инфекции у пациентов с декомпенсированным ЦП [10, 11], увеличивая выживаемость пациентов, не связанную с развитием кровотечений [12]. Предполагается, что НСББ снижают риск развития гепатоцеллюлярной карциномы [13].
Несмотря на важную роль НСББ в первичной и вторичной профилактике кровотечений из варикозных узлов, появились доказательства их нежелательного использования у части пациентов с декомпенсированным ЦП. Так, практически одновременно с публикацией, предопределившей начало использования этой группы препаратов при ЦП [1], было опубликовано письмо R.P. Wilkinson [14] в журнале Lancet, в котором обращалось внимание читателей на потенциально сильную гипотензию, вызываемую пропранололом у больных с асцитом, связанную с его влиянием на ренин-ангиотензиновую систему. T. Sersté и соавт. [15] сообщили об увеличении смертности пациентов с ЦП и рефрактерным асцитом (РА), получавших НСББ. Это сообщение породило дискуссию о безопасности данных препаратов у пациентов с асцитом, инфекционными осложнениями, а также о риске развития острого поражения почек у больных с СБП [16]. В последующем на основе множества преимущественно наблюдательных сообщений была сформулирована гипотеза «терапевтического окна», которая породила дискуссию о целесообразности использования НСББ у больных на ранних стадиях развития ЦП, не имеющих варикозных узлов среднего или большого размеров [17, 18]. Авторы этой гипотезы и их последователи рекомендовали избегать использования НСББ у пациентов с терминальной стадией ЦП и РА.
Таким образом, наличие открытого «терапевтического окна» (первичная и вторичная профилактика кровотечений из варикозных узлов среднего и большого диаметра) предусматривает активное использование НСББ у больных с компенсированным и декомпенсированным ЦП [18]. В связи с естественной прогрессией ЦП наступает фаза «закрытия терапевтического окна» (при наличии РА, СБП, гепаторенального синдрома), что обусловливает ухудшение исходов вследствие негативного влияния НСББ на сердечный выброс в условиях снижения сердечного компенсаторного резерва [17].
В настоящее время появились исследования, которые не столь категоричны в оценке влияния НСББ на безопасность, особенно после внедрения нового представителя этого класса – карведилола. Карведилол оказывает больший эффект на снижение портального давления, чем традиционные НСББ, и имеет расширенные показания для использования у больных компенсированным ЦП [19]. Тем не менее в литературе отсутствуют исследования со сравнительным анализом переносимости карведилола по сравнению с другими НСББ, что требует дальнейшего изучения его свойств.
Баланс между риском и пользой от применения НСББ в качестве патогенетической терапии является предметом продолжающихся исследований у больных с декомпенсированным ЦП. До сих пор четко не определено, продолжать или прекращать терапию у пациентов с терминальными заболеваниями печени, включенными в лист ожидания трансплантации печени (ЛОТП).
Цели исследования: провести анализ выживаемости пациентов, получавших и не получавших различные препараты класса НСББ при ожидании трансплантации печени (ТП) в ЛОТП в зависимости от наличия или отсутствия «терапевтического окна» для назначения НСББ; определить факторы риска развития смерти при назначении различных представителей класса НСББ у больных с РА.
Материал и методы
Проведен ретроспективный анализ результатов терапии 350 пациентов с декомпенсированным ЦП различной этиологии, включенных в ЛОТП Центра хирургии и координации донорства Ростовской областной клинической больницы в период с 2015 по 2019 г. Проведение анализа одобрено этическим комитетом при Ростовской областной клинической больнице.
Критерии включения больных с декомпенсированным ЦП в ЛОТП:
- безуспешность или отсутствие предшествующей терапии;
- развитие отечно-асцитического синдрома и/или печеночного гидроторакса;
- указание на наличие в прошлом СБП, купированного назначением антибиотиков;
- наличие гепаторенального синдрома;
- наличие печеночной энцефалопатии (ПЭ);
- наличие варикозных кровотечений из ЖКТ.
Дополнительные критерии при включении в лист ожидания печени:
- показатели индекса MELD ≥ 16;
- показатели индекса Чайлда – Пью (Child-Turcotte-Pugh) ≥ 7.
Критерии исключения пациентов из исследования:
- гепатоцеллюлярная карцинома;
- острая печеночная недостаточность;
- поликистоз печени;
- амилоидоз;
- распространенный тромбоз воротной вены и ее магистральных притоков;
- синдром Бадда – Киари;
- синдром синусоидальной обструкции.
Дополнительные критерии исключения:
- выраженная легочно-сердечная патология;
- продолжающийся прием алкоголя;
- рецидивирующий холангит при первичном склерозирующем холангите;
- планируемая повторная ТП или предшествующие включению в ЛОТП трансплантации других органов.
Больным обеих групп при включении в ЛОТП проводили эластографию печени, биопсию печени и анализ асцитической жидкости. Скрининг и диагностику HBV и HCV-инфекции проводили с использованием ПЦР-диагностики и иммуноферментного анализа. При включении в ЛОТП, а также в динамике терапии проводили клинические исследования крови и мочи, биохимические исследования, исследования параметров гемостаза, рассчитывали индексы: MELD-Na [20], ПЭ (The West Haven criteria) [21], Child-Turcotte-Pugh (CPT) [22].
Далее проведено исследование по типу «случай-контроль». В группу «случай» были включены 278 взрослых пациентов с декомпенсированными заболеваниями печени различной этиологии, состоящих в ЛОТП, которым во время ожидания ТП проводили терапию НСББ. Группу «контроль» составили 72 пациента с декомпенсированными заболеваниями печени различной этиологии, включенные в ЛОТП, которым во время ожидания ТП не проводили терапию НСББ. В случае HCV-ассоциированного ЦП пациенты обеих групп получали терапию препаратами прямого противовирусного действия (комбинация софосбувира, даклатасвира и рибивирина) в течение 12 недель. При наличии противопоказания для приема рибавирина продолжительность терапии софосбувир/даклатасвир составляла 24 недели. Достижение устойчивого вирусологического ответа (УВО) свидельствовало об элиминации вируса. В случае HBV-ассоциированного ЦП терапия пациентов обеих групп включала назначение нуклеозидных аналогов (энтекавира, тенофовира). Критерием вирусологического ответа (ВО) на терапию являлось отсутствие ДНК HBV в крови, определяемое c помощью высокочувствительной ПЦР-диагностики. Пациенты обеих групп с аутоиммунными заболеваниями печени в качестве патогенетической терапии получали урсодезоксихолевую кислоту, или иммуносупрессанты (азатиоприн), или глюкокортикостероиды (метилпреднизолон).
У части больных обеих групп проводили патогенетическую терапию НСББ (пропранолол, карведилол, окспренолол, надолол) и мочегонными средствами. Для купирования проявлений явной печеночной энцефалопатии (ЯПЭ) применяли комбинацию рифаксимина, лактулозы (перорально) в сочетании с внутривенными введениями L-орнитин-L-аспартата. У части пациентов использовали методы экстракорпоральной гемокоррекции: плазмосорбцию и продленную вено-венозную гемодиафильтрацию.
В целях профилактики вторичных кровотечений из пищеводно-желудочных варикозных узлов части пациентов провели оперативное лечение, включающее наложение трансъюгулярного внутрипеченочного портосистемного шунтирования (ТИПС) и азигопортальное разобщение (АПР, патент РФ № 2412657) по оригинальной методике [22].
Все результаты для последующего статистического анализа, включающие демографические, клинические и лабораторные показатели, были получены из электронной базы данных Центра хирургии и координации донорства Ростовской областной клинической больницы, непрерывно обновляющейся и пополняющейся.
Для статистического анализа полученных данных использовали программу IBM SPSS Statistics, версия 21 (StatSoft Inc., США). В целях проверки нормальности распределения полученных данных использовали критерий Колмогорова – Смирнова. Выборки с нормальным распределением данных характеризовались средними арифметическими величинами (М) и стандартного отклонением (SD, standard deviation) с определением 95%-го доверительного интервала (ДИ). В случае нормального распределения статистическую значимость различий между сравниваемыми параметрами определяли по t-критерию Стьюдента. При отсутствии нормального распределения данных использовались непараметрические критерии: Уилкоксона для парных сравнений зависимых переменных, для сравнения независимых переменных – критерий Манна – Уитни (U-критерий) и Хи-квадрат Пирсона. В выборках с распределением, отличным от нормального, количественные показатели представляли в виде медианы и интерквантильного размаха (интервал между 25-м и 75-м процентилями). Качественные данные анализировали с помощью определения частот и долей (%). Различия между сравниваемыми параметрами при условии вероятности ошибки менее 0,05 (p < 0,05) считали статистически значимыми.
Результаты
При использовании критерия Колмогорова – Смирнова нормальному распределению соответствовали такие показатели, как возраст пациентов, индекс массы тела (ИМТ), количество лейкоцитов и тромбоцитов, концентрация альбумина и Na, значения индексов MELD-Na (на момент включения в ЛОТП), которые анализировали с помощью методов параметрической статистики.
Показатели пола, степени ПЭ, креатинина и билирубина, МНО, индекса CTP на момент включения в ЛОТП не соответствовали нормальному распределению, и для их последующего анализа использовали непараметрические методы статистики (критерий Манна – Уитни – U-критерий, Хи-квадрат). В таблицах 1 и 2 представлены показатели демографических, клинических, лабораторных исследований, ИМТ, MELD-Na, CTP в группе больных, не получавших НСББ при ожидании ТП (n = 72) и получавших НСББ при ожидании ТП (n = 278).
Таким образом, сравниваемые группы не имели значимых различий по индексам MELD-Na, СТР, показателям альбумина, билирубина, Na и МНО, а также по возрасту и полу. В группе больных, не получавших НСББ, показатели ИМТ, количества тромбоцитов были значимо выше, а концентрации билирубина – значимо ниже, чем в группе пациентов, получавших НСББ в период ожидания ТП в ЛОТП.
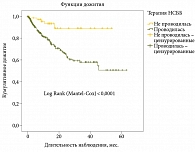
Выживаемость пациентов в сравниваемых группах (получавших и не получавших НСББ при ожидании ТП в ЛОТП) определяли методом Каплана – Майера, показатели выживаемости сравнивали с учетом логарифмического критерия Log-Rank (Mantel-Cox) (рис. 1). Как показано на рис. 1, выживаемость пациентов, не получавших НСББ, значимо выше, чем в группе больных, получавших НСББ при ожидании ТП (Log-Rank < 0,0001).
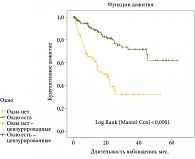
Для последующего анализа мы разделили группу пациентов, получавших НСББ (n = 278), на две подгруппы: с наличием «терапевтического окна» (n = 175) и без него (n = 103). Выживаемость пациентов в сравниваемых подгруппах (получавших НСББ при ожидании ТП в ЛОТП при наличии или отсутствии «терапевтического окна» для назначения НСББ) определена методом Каплана – Майера, показатели выживаемости сравненивали с учетом логарифмического критерия Log-Rank (Mantel-Cox) (рис. 2).
Как показано на рис. 2, выживаемость пациентов, получавших НСББ при наличии «терапевтического окна» для НСББ, значимо выше, чем в группе больных, получавших НСББ при ожидании ТП в ЛОТП в отсутствие «терапевтического окна» для НСББ (Log-Rank < 0,0001).
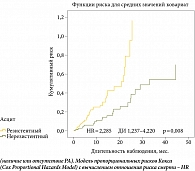
Предикторы смертности пациентов, получавших НСББ при отсутствии «терапевтического окна» для НСББ, определяли с помощью модели пропорциональных рисков Кокса (Cox Proportional Hazards Model) с вычислением отношения риска смерти (HR) в группах пациентов c РА (n = 103) и без РА (n = 175) (рис. 3). Как показано на рис. 3, риск развития смерти у больных с РА был значимо выше, чем у больных без РА (HR = 2,285; ДИ 1,237 ‑ 4,220; р = 0,008).
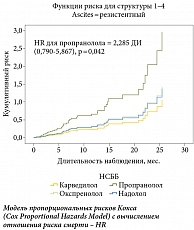
Предикторы смертности пациентов, получавших различные препараты класса НСББ при отсутствии «терапевтического окна» для НСББ, определяли с помощью модели пропорциональных рисков Кокса (Cox Proportional Hazards Model) с вычислением HR в группе пациентов c РА (n = 103) пациентов (рис. 4). Как показано на рис. 4, риск развития смерти для больных, получавших пропранолол, значимо отличался от такового с терапией карведилолом (HR = 2,152 и HR = 0,765; p = 0,042 соответственно).
Обсуждение
Основным показанием для применения НСББ, эндоскопического лигирования варикозных узлов, а также выполнения операций по АПР и ТИПС в нашем исследовании была профилактика первичных и вторичных кровотечений как осложнений ПГ у больных с декомпенсированным ЦП. В качестве скрининга пациентов с угрозой развития первичных и вторичных кровотечений мы использовали данные эзофагогастродуоденоскопии. Скринирующая эзофагогастродуоденоскопия позволяет идентифицировать варикозные узлы с высоким риском развития кровотечения, получившие в зарубежной литературе название «узлы с необходимостью проведения терапии» (varices needing treatment – VNT) [24]. VNT являются узлами большого (> 5 мм в диаметре) или среднего размера (2–3 мм в диаметре) и представляют опасность развития кровотечения [24]. Современные руководства рекомендуют для предупреждения первичного кровотечения использовать НСББ или эндоскопическое лигирование у пациентов со средними или большими размерами варикозных улов и не рекомендуют эти методы в случае, если размеры узлов небольшие [25].
НСББ являются важной составной частью терапии ПГ у пациентов с декомпенсированным ЦП, находящихся в ЛОТП и ожидающих ТП неопределенно долгое время, в частности для профилактики первичных и повторных кровотечений из варикозно-расширенных узлов пищевода и желудка [26, 27]. Позитивный эффект НСББ на профилактику кровотечений характеризуется снижением абсолютного риска до 16% [25].
Результаты нашего исследования подтвердили данные зарубежных авторов, установивших негативное влияние НСББ у пациентов с РА на фоне декомпенсации ЦП [15, 16, 28]. Так же как и в цитируемых исследованиях [28, 29], мы показали высокую смертность у больных с РА, ожидающих ТП в ЛОТП.
Наше исследование подтвердило выводы A. Krag и соавт. [17, 18], впервые сформулировавших гипотезу «открытого или закрытого терапевтического окна» для НСББ в случае их использования у больных с декомпенсированным ЦП и РА.
В соответствии с установленными эффектами НСББ на больных с терминальной фазой ЦП (выраженная вазодилатация, активация адренергических механизмов, падение сердечного выброса, а также снижение почечной перфузии) ряд исследований породил непрекращающуюся до сих пор дискуссию о безопасности использования НСББ у пациентов с декомпенсированным ЦП [15, 16, 28–31].
Следует отметить, что в ряде исследований не установлено негативное влияние НСББ на смертность больных с декомпенсированным ЦП. Так, T. Ngwa и соавт. [32] провели исследование 65 пациентов, получавших НСББ в течение нескольких месяцев ожидания ТП. Авторами исследования установлено, что использование НСББ обусловило снижение 90-дневной смертности пациентов, ожидающих ТП. Тем не менее авторы приводят данные, свидетельствующие об увеличении частоты развития эпизодов острого повреждения почек (ОПП) у лиц, получавших НСББ в сравнении с лицами, не получавшими эти препараты (22 и 11% соответственно). Как правило, эти нарушения являются первой стадией ОПП, разрешившихся после прекращения приема препаратов. Тем не менее у части пациентов (27%), принимавших НСББ более чем 90 дней, развилась гипотензия и ОПП второй и третьей степеней, обусловившие увеличение показателя MELD и смертности.
Результаты нашего исследования показали, что риск развития летального исхода у больных с РА, ожидающих ТП в течение длительного периода, наиболее высок при применении пропранолола, в меньшей степени для окспренолола, надолола и карведилола. Это соответствует рекомендациям зарубежных исследователей, не рекомендующих использование высоких доз пропранолола (> 160 мг/день) в связи с плохими исходами у пациентов [25, 33]. Поскольку количество исследований, рекомендующих использование карведилола вместо пропранолола у пациентов с асцитом и/или нарушениями функции почек, весьма ограничено [25, 34], в целях безопасности карведилол не рекомендуется к назначению больным с тяжелыми формами асцита [25, 27].
Таким образом, проведенное нами исследование подтвердило гипотезу о существовании «терапевтического окна» для НСББ при их применении у больных с декомпенсированным ЦП, включенными в ЛОТП. Использование НСББ увеличивает смертность пациентов с РА независимо от вида препарата в случае, когда развивается фаза «закрытого терапевтического окна». В целях снижения смертности пациентов, ожидающих ТП в течение нескольких лет вследствие острого дефицита органов, врачи, ведущие пациентов в ЛОТП, должны оценивать риск и пользу от применения НСББ.
Авторы заявляют об отсутствии конфликта интересов.
V.L. Korobka, PhD, V.D. Pasechnikov, PhD, Prof., R.V. Korobka, PhD, A.M. Shapovalov, PhD
Rostov Regional Clinical Hospital
Rostov State Medical University
Stavropol State Medical University
Contact person: Victor D. Pasechnikov, passetchnikov@mail.ru
Objectives of the study: to analyze the survival rate of patients who received and did not receive various drugs of the class of non-selective beta-blockers (NSBB) while waiting for liver transplantation (LT) on the waiting list for liver transplantation (WLLT), depending on the presence or absence of a "therapeutic window" for the appointment of NSBB; to determine risk factors for death when prescribing various representatives of the NSBB class in patients with refractory ascites (RA).
Material and methods. The retrospective case-control study was conducted. The "case" group included 278 adult patients with decompensated liver diseases of various etiologies included in the WLLT, who were treated with NSBB while waiting for LT. The "control" group consisted of 72 patients with decompensated liver diseases of various etiologies included in the WLLT, who did not receive NSBB therapy during the waiting period for LT. For the subsequent analysis, the group of patients receiving NSBB (n = 278) was divided into two subgroups: with the presence of a "therapeutic window" (n = 175), and without it (n = 103). The survival rate of patients was determined by the Kaplan - Mayer method. Predictors of mortality of patients receiving NSBB in the absence of a" therapeutic window "for NSBB were determined using the Cox proportional hazards model in the groups of patients with RA (n = 103) and non-RA (n = 175).
Results. The survival rate of patients receiving NSBB in the presence of a" therapeutic window "for NSBB is significantly higher than in the group of patients receiving NSBB in WLLP while waiting for LT in the absence of a" therapeutic window " for NSBB (Log-Rank < 0.0001). The risk of death in patients with RA treated with NSBB was significantly higher than in patients with non-RA (HR = 2.285; CI 1.237 4.220; p = 0.008). The risk of death for patients treated with propranol was significantly different from carvedilol (HR = 2,152 and HR = 0.765; p = 0.042, respectively).
Conclusion. The results of the study confirmed the hypothesis that there is a "therapeutic window" for NSBB when they are prescribed to patients with decompensated cirrhosis of the liver and included in the WLLP. The use of NSBB contributes to an increase in the mortality of patients with RA, regardless of the type of drug, in the case when the "closed therapeutic window" phase develops. In order to reduce the mortality of patients waiting for LT for several years due to acute organ deficiency, doctors who lead patients to WLLT should assess the risk and benefit of using NSBB.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.