Лактулоза: преимущества и место препарата в клинических рекомендациях
- Аннотация
- Статья
- Ссылки
- English
Введение
Лактулоза – дисахарид, полученный из лактозы с использованием β-галактозидазы или эпимеразы и состоящий из фруктозы и галактозы. Ввиду того что лактулоза плохо всасывается в желудочно-кишечном тракте, она поступает в толстую кишку в практически неизмененном виде и затем ферментируется кишечной микробиотой. Вследствие этого достигается эффект увеличения количества каловых масс и их смягчения, поэтому лактулоза активно применяется в качестве слабительного средства [1].
Однако применение лактулозы не ограничивается слабительным действием. В частности, препарат широко используется в ведении пациентов с печеночной энцефалопатией (ПЭ), связанной с накоплением азотсодержащих продуктов в системном кровотоке [2]. Образование молочной кислоты и небольшого количества уксусной и муравьиной кислот в кишечнике способствует образованию летучих метаболитов жирных кислот, что приводит к снижению проницаемости кишечной мембраны [3]. В результате аммиак диффундирует в кислую среду толстой кишки и ионизируется до аммония. Важную роль в патогенезе ПЭ играет кишечная микробиота, которую способна модифицировать лактулоза, оказывающая пребиотический эффект [1]. Благодаря своим пребиотическим свойствам лактулоза способна оказывать благоприятное воздействие на уровень глюкозы натощак и после приема пищи, уровни маркеров воспаления, а также улучшать чувствительность к инсулину и показатели липидного профиля у пациентов с предиабетом [4].
Лактулоза также может применяться в ведении пациентов с хронической болезнью почек (ХБП). Так, препарат подавлял тубулоинтерстициальный фиброз в крысиной модели заболевания почек [5], а прием 30 мл сиропа лактулозы трижды в день в течение восьми недель замедлял прогрессирование ХБП вследствие подавления выработки уремического токсина [5, 6].
Все это позволяет рассматривать лактулозу как препарат многоцелевого применения, оказывающий положительное влияние как на здоровье желудочно-кишечного тракта, так и на системный метаболизм.
Из истории препарата
Впервые лактулоза была описана в 1929 г. E. Montgomery и C. Hudson [7], однако клинический интерес к ней появился значительно позже, когда в 1957 г. F. Petuely обнаружил, что применение лактулозы увеличивало количество фекальных бактерий рода Bifidobacterium у младенцев. Было установлено, что при вскармливании младенца детскими смесями или молоком с добавлением 2%-ной лактулозы содержание Bifidobacterium в фекальной микрофлоре составляло 90% от нормы. Ввиду этого эффекта лактулоза была охарактеризована как бифидогенный фактор [8, 9]. Впоследствии было предложено использовать лактулозу в качестве препарата для лечения запоров [10]. В клинической практике лактулоза была впервые использована в 1966 г. [11]. В Японии лактулоза включена в особый список, состоящий из 12 ингредиентов пищевых продуктов, укрепляющих здоровье нации.
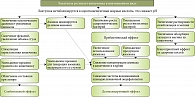
В современной клинической практике лактулоза применяется как слабительное средство для симптоматического лечения запоров у детей и взрослых, а также как дезинтоксикационное средство для лечения ПЭ у взрослых, однако препарат обладает и многими другими эффектами (рисунок) [12–14]. Так, низкие дозы лактулозы можно использовать в качестве пребиотика для стимуляции роста бактерий-мутуалистов (тесные взаимовыгодные отношения между бактериями и человеком) в кишечнике, тогда как средние и высокие дозы препарата используют для лечения запоров и ПЭ соответственно [12, 15].
Пребиотики, подобные лактулозе, представляют собой субстраты, избирательно используемые микроорганизмами, а также стимулирующие рост и/или активность одного или нескольких видов бактерий в толстой кишке [16–18]. В целом способность лактулозы стимулировать рост бактерий-мутуалистов известна уже более 60 лет [7, 9].
Эффекты применения лактулозы
Лечебные эффекты лактулозы обусловлены ее воздействием на кишечник, прежде всего изменением микробиоты толстой кишки [9]. В тонкой кишке человека отсутствует фермент, необходимый для расщепления дисахарида лактулозы на составляющие ее моносахариды, таким образом, лактулоза достигает толстой кишки практически в неизмененном виде. При попадании в толстую кишку лактулоза избирательно метаболизируется резидентной микробиотой толстой кишки [15], в результате чего образуются короткоцепочечные жирные кислоты, кишечные газы (водород, углекислый газ и метан), что в итоге приводит к увеличению бактериальной массы [12, 15, 19]. Лактулоза как пребиотическое вещество усиливает рост полезных бактерий, таких как бифидобактерии и лактобактерии, что обеспечивает возможность подавления роста потенциально патогенных бактерий, таких как Clostridium и Escherichia coli. Соотношение продуцируемых жирных кислот определяется составом микробиоты хозяина, а также типом и количеством ферментируемого субстрата, рН и факторами, влияющими на абсорбцию короткоцепочечных жирных кислот [20].
Ацетат, пропионат и бутират представляют собой основные короткоцепочечные жирные кислоты, обнаруженные в толстой кишке человека [19]. Ацетат при этом является основной жирной кислотой, получаемой путем ферментации лактулозы [21, 22]. Хотя ни бифидобактерии, ни лактобациллы не производят бутират напрямую при ферментации лактулозы, между кишечной микробиотой происходит перекрестное взаимодействие с образованием бутирата. Различные бифидобактерии и лактобациллы продуцируют ацетат и лактат, которые затем трансформируются в бутират под действием других представителей микробиоты кишечника [23–25].
Жирные кислоты всасываются в толстой кишке, где они действуют как субстрат [20] и представляют собой основной поток углерода из рациона через микробиом к хозяину [26, 27], при этом бутират является предпочтительным источником энергии для колоноцитов [28, 29]. Помимо того что жирные кислоты являются источником энергии для клеток толстой кишки, они также принимают участие в регулировании иммунного ответа, метаболизме и барьерной функции кишечника [30].
Повышение концентрации короткоцепочечных жирных кислот вследствие ферментации лактулозы приводит к снижению рН толстой кишки [19]. Снижение рН кишечника до уровня ниже того, при котором патогены могут эффективно конкурировать, может помочь поддерживать гомеостаз кишечника и предотвратить инфекцию [31]. Кислая среда также увеличивает растворимость минералов, таких как соли кальция и магния [13, 14, 32].
Использование же лактулозы в качестве средства детоксикации при ПЭ в основном связано с ее способностью изменять микробиоту кишечника вследствие снижения выработки и абсорбции аммиака [19]. В условиях сниженного рН аммиак крови диффундирует в толстую кишку, а затем ионизируется до аммония и/или включается в микробную биомассу и выводится с фекалиями [12, 33]. Также считается, что подавление колонизации патогенов происходит из-за пролиферации бактерий-мутуалистов и последующего конкурентного эффекта [31].
Рост резидентных микробных популяций в толстой кишке приводит к увеличению бактериальной массы, а более высокая фекальная бактериальная биомасса связана с более коротким временем кишечного транзита [34]. Больший объем стула способствует перистальтике кишечника, ускоряя прохождение стула через толстую кишку [12]. Увеличение объема стула также может быть достигнуто из-за более высокого содержания воды в фекалиях: метаболизм лактулозы повышает осмолярность содержимого кишечника [35], что увеличивает объем воды в просвете кишки [12].
В то же время эффекты лактулозы, по всей видимости, дозозависимы. Так, препарат может действовать как пребиотик, слабительное или дезинтоксикационное средство в зависимости от дозы: низкие дозы (~15 мл/сут или ~10 г/сут для взрослых) вызывают пребиотический эффект и усиливают всасывание кальция и магния; средние дозы (~30–45 мл/сут или ~20–40 г/сут) используют при запорах, так как они обладают слабительным эффектом; высокие же дозы (> 90 мл/сут или > 60 г/сут) оказывают дезинтоксикационное действие и используются при ПЭ [9, 12]. Сопутствующие пребиотические и слабительные эффекты высоких доз лактулозы были продемонстрированы у пациентов с хроническими идиопатическими запорами [36].
Применение лактулозы при запорах
Клиническая эффективность и безопасность лактулозы при лечении запоров была установлена в нескольких рандомизированных плацебо-контролируемых исследованиях, проведенных в течение последних десятилетий. В первой публикации, датируемой 1968 г., представлены результаты двойного слепого исследования с участием пожилых пациентов: лактулоза в дозах 5–20 г/сут превосходила плацебо в виде сиропа глюкозы в отношении частоты дефекации у пациентов с запорами [37]. В другом исследовании лактулоза в дозах 7,5–20 г/сут повышала количество дефекаций и уменьшала выраженность желудочно-кишечных симптомов, таких как спазмы, схваткообразные боли, метеоризм, тенезмы и вздутие живота, у пожилых пациентов с запорами [38].
В рандомизированном контролируемом многоцентровом исследовании с участием пациентов с хроническими идиопатическими запорами, в котором участники получали лактулозу или полиэтиленгликоль-4000, были показаны сравнимые клиническая эффективность и переносимость для обоих видов лечения [36]. При этом в группе лактулозы наблюдали увеличение популяции числа фекальных бифидобактерий (р = 0,04) и активность бета-галактозидазы (р < 0,001) с первого по 28-й дни, тогда как в группе полиэтиленгликоля (ПЭГ) отмечено снижение общего количества короткоцепочечных жирных кислот (р = 0,02), бутирата (р = 0,04), ацетата (р = 0,02) и фекальной бактериальной массы (р = 0,001).
Отмечено, что лактулоза обладает свойствами пребиотика [39]: пероральный прием лактулозы способствовал увеличению разнообразия бифидобактерий в толстой кишке у здоровых добровольцев. Аналогичные результаты были показаны в отношении фекальной микрофлоры у пациентов с ХБП [6]. Это свойство позволяет рассматривать лактулозу в качестве препарата с множественным действием. Лактулозу можно принимать длительно, без привыкания, что особенно важно для коморбидных пациентов, не имеющих возможности нивелировать основное заболевание и терапию.
Доказано, что лактулоза улучшает показатели кишечного транзита. Небольшая доза лактулозы – 10 г/сут (раствора или кристаллической лактулозы) – предотвращала замедление пассажа содержимого по толстой кишке и развитие запора у госпитализированных пациентов (пациенты с нормальным опорожнением кишечника, госпитализированные в связи с заболеваниями, не сопровождающимися запором или диареей), не вызывая при этом нежелательных симптомов [40]. В двух других исследованиях сравнивали эффекты лактулозы и ПЭГ, а также время прохождения через толстую кишку у здоровых добровольцев. В одном из исследований применение высоких доз лактулозы (67 или 134 г/сут) приводило к дозозависимому ускорению транзита как в проксимальном, так и в дистальном отделах толстой кишки [41]. В другой работе применение оригинальной лактулозы в дозе 10 г два раза в день в течение пяти дней значимо ускоряло опорожнение восходящей ободочной кишки по сравнению с ПЭГ 4000 (макрогол) [42]. При этом отмечалось, что в конце исследования 50,18% радиоактивного вещества покинуло восходящую кишку у пациентов, проходивших лечение лактулозой, по сравнению с 35,18% в группе ПЭГ (р < 0,05). Среднее число дефекаций в течение последних трех дней лечения для лактулозы и ПЭГ составило 1,40 ± 0,12 и 1,30 ± 0,18 в день соответственно (р = 0,75). Этот результат подтверждает дополнительный стимулирующий эффект толстокишечной ферментации лактулозы.
Одно из последних многоцентровых исследований с участием 250 пациентов с хроническими запорами, которые принимали 26 или 39 г/сут кристаллической лактулозы в течение двух недель, показало дозозависимое увеличение частоты спонтанной дефекации по сравнению с плацебо. Кроме того, отмечалось улучшение показателей консистенции стула, тяжести запора, а также отсутствие нежелательных явлений [43].
Положительное влияние лактулозы на характер стула отмечается и у педиатрических пациентов. В исследованиях было показано, что у детей с хроническими запорами лактулоза позволяет улучшить состояние моторной функции кишечника [43–46] в виде нормализации частоты и консистенции стула через шесть недель применения [46].
Еще одним преимуществом лактулозы перед ПЭГ является отсутствие лекарственного взаимодействия, что особенно важно для коморбидных пациентов, длительно принимающих несколько препаратов. Так, ПЭГ может вступать во взаимодействие с пищевыми загустителями на основе крахмала и нейтрализовать его загущающий эффект, разжижая препараты, которые должны оставаться густыми. Также есть упоминание, что при совместном применении с ПЭГ снижаются абсорбция и эффективность дигоксина, противоэпилептических препаратов, кумаринов, иммунодепрессантов и пр. [47].
Влияние лактулозы на моторику желудочно-кишечного тракта продемонстрировано во многих работах. В перекрестном исследовании [48], в котором сравнивали опорожнение желудка и транзит по кишечнику после употребления комбинации лактулозы 20 мл три раза в сутки и псиллиума 3,5 г три раза в сутки или только лактулозы в той же дозе, было показано, что псиллиум значительно замедлял опорожнение желудка, при этом транзит по тонкой кишке не изменялся. И хотя время достижения 50% изотопа толстой кишки значимо не отличалось между группами, прием псиллиума значительно замедлял рост концентрации изотопа водорода в выдыхаемом воздухе, которая достигала 50% своего пика через 217 ± 34 минуты по сравнению с контрольными значениями 155 ± 27 минут. Таким образом, авторы исследования сделали вывод о том, что псиллиум задерживает эвакуацию из желудка, вероятно, из-за увеличения вязкости пищи, а также замедляет прохождение содержимого через толстую кишку, возможно, вследствие задержки образования газообразных продуктов брожения.
Эффективность и переносимость лактулозы и псиллиума оценивали также в открытом рандомизированном исследовании с участием пациентов с запорами в течение более трех недель. В течение четырехнедельного периода лечения оба вида терапии показали свою эффективность, однако оригинальная лактулоза была оценена пациентами как более приемлемое средство по вкусовым качествам, удобству приема [49].
В другом исследовании участвовали пациенты с хронической болезнью почек до диализа [50]. При этом оценивали эффективность лактулозы, а также сенны и псиллиума у пациентов с диагнозом запора в соответствии с Римскими критериями IV. В конце исследования среднее недельное значение полного спонтанного опорожнения кишечника увеличилось в обеих группах без значимых различий между ними. Однако необходимо учитывать тот факт, что в данном исследовании сравнивали эффективность монотерапии лактулозы и комбинации двух препаратов: сенны и псиллиума. Также следует иметь в виду, что одновременный прием сразу нескольких лекарственных средств может негативно сказаться на приверженности к терапии и вызвать нежелательные побочные явления [50, 51].
Нередко лактитол, представляющий собой неабсорбированный сахар, предлагается применять в качестве альтернативы лактулозе, однако данные о сравнении их эффективности ограничены [52]. Кроме этого, проведенные в последние годы исследования указывают на то, что лактулоза, вероятно, обладает более выраженными пребиотическими свойствами по сравнению с лактитолом [53, 54]. Так, применение лактулозы у здоровых добровольцев продемонстрировало более выраженное увеличение количества пребиотических бактерий и уменьшение гнилостных и потенциально патогенных микроорганизмов. Эти изменения в кишечной флоре оказывали влияние на: а) снижение активности проканцерогенных ферментов азоредуктазы, 7α-дегидроксилазы, β-глюкуронидазы, нитроредуктазы, а также активности уреазы; б) увеличение содержания короткоцепочечных жирных кислот в фекалиях; в) изменение рН и содержание воды в фекалиях; г) изменение содержания ароматических соединений, таких как фенол, крезол, индол и скатол. На основании этого можно заключить, что лактулоза и лактитол несопоставимы по своему влиянию на микрофлору толстой кишки.
Важно отметить, что именно пребиотическое свойство лактулозы обеспечивает пост-эффект препарата. В одном из исследований с участием женщин в послеродовом периоде отмечается 120 дней практически безрецидивного течения запора (у 96% пациентов) после четырехнедельного приема препарата [55].
В рандомизированном исследовании с участием пациентов, поступивших в больницу по причинам, не связанным с запорами или диареей, сравнивали влияние жидкой лактулозы, кристаллической лактулозы, кристаллического лактитола или отсутствия лечения на среднее время транзита по толстой кишке [39]. В каждой исследуемой группе было по 18 пациентов, при этом во время исследования пациенты получали обычную диету и не принимали дополнительных лекарств от запора. Среднее время транзита по толстой кишке для каждой из групп составило: 52,16 часа (95% доверительный интервал (ДИ) 39,42–64,84) для контрольной группы, 22,45 часа (95% ДИ 13,84–31,06) для группы, принимавшей жидкую лактулозу, 24,05 часа (95% ДИ 12,13–35,97) для группы кристаллической лактулозы и 35,95 часа (95% ДИ 23,82–35,97) для группы кристаллического лактитола. Следовательно, эффект от жидкой лактулозы наступал в среднем через сутки. Дальнейшее изучение характера транзита показало, что эти различия связаны со скоростью пассажа по восходящей ободочной кишке. Таким образом, небольшая доза лактулозы (жидкой или кристаллической) предотвращала замедление пассажа содержимого по толстой кишке и развитие запора у госпитализированных пациентов, не вызывая при этом нежелательных реакций. Замедление пассажа затрагивало главным образом восходящую ободочную кишку, и именно в этой области слабительное оказывало свое действие.
Вздутие как побочный эффект характерно для большинства слабительных препаратов и отмечается достаточно часто. Ряд пациентов в первые дни после приема лактулозы также могут отмечать вздутие, которое, как правило, исчезает через несколько дней. Усиление метеоризма или вздутия на фоне продолжающегося приема препарата может свидетельствовать о наличии синдрома избыточного бактериального роста, который высоко распространен в популяции, и пациенту может понадобиться дополнительная антибактериальная терапия [53]. В этой ситуации прием лактулозы может позволить не просто скорректировать проблему запора, но и выявить у пациента дополнительный диагноз и впоследствии улучшить качество его жизни.
С учетом положительного влияния лактулозы на моторику желудочно-кишечного тракта и микрофлору толстой кишки, применение данного препарата у пациентов с запорами более чем оправданно.
Применение лактулозы при печеночной энцефалопатии
ПЭ является частым осложнением цирроза печени и состоянием, при возникновении которого необходима госпитализация. ПЭ в широком смысле определяется как дисфункция головного мозга, вызванная печеночной недостаточностью и/или портально-системным шунтированием, что проявляется широким спектром неврологических или психических отклонений от субклинических изменений до комы [57, 58].
С патофизиологической точки зрения аммиак остается центральным игроком в патогенезе ПЭ. Однако известно, что к развитию ПЭ также причастны системное и нейровоспаление, а также окислительный стресс и клеточное старение. Кроме того, при ПЭ нарушаются проницаемость/функция гематоэнцефалического барьера, состав спинномозговой жидкости, лимфатический поток, церебральный энергетический метаболизм, нейротрансмиссия и межклеточные связи, что вызывает неврологические нарушения [59–63].
Лактулоза как невсасывающий дисахарид рекомендована в качестве терапии первой линии при ПЭ [64]. Лактулоза является наиболее изученным препаратом у пациентов с эпизодом ПЭ. Она ускоряет кишечный транзит и закисляет кишечную среду, вследствие чего экскреция аммиака увеличивается, а его абсорбция снижается. В большинстве клинических исследований продемонстрировано преимущество лактулозы в сравнении с отсутствием терапии. Недавний Кокрановский обзор продемонстрировал положительное влияние невсасывающихся дисахаридов на тяжесть ПЭ (количество пациентов, которых необходимо лечить (NNT), = 4), профилактику ПЭ (NNT = 6), а также смертность (относительный риск 0,36; 95% ДИ 0,14–0,94) [62].
Пациенты с циррозом печени после эпизода ПЭ имеют повышенный риск развития повторных эпизодов ПЭ. Лактулоза эффективна для предотвращения последующего эпизода ПЭ у пациентов с циррозом печени, однако не влияет на частоту госпитализаций или смертность [65, 66].
Лактулоза остается наиболее изученным препаратом для лечения и профилактики ПЭ, а данные сравнительных исследований с другими препаратами весьма ограничены.
Место лактулозы в клинических рекомендациях
Благодаря своим свойствам лактулоза включена в клинические рекомендации по лечению как запоров, так и ПЭ.
В российских рекомендациях по диагностике и лечению запоров у взрослых [67] отмечается, что консервативное лечение хронического запора после неуспеха проведения диетических мероприятий и лечения оболочкой семян подорожника рекомендовано начинать с назначения одного из следующих препаратов на четыре – шесть недель: макрогол (ПЭГ), лактулоза или лактитол. Все эти препараты способствуют размягчению кишечного содержимого и увеличению его объема.
В рекомендациях Индийского общества детской гастроэнтерологии, гепатологии и питания и отделения детской гастроэнтерологии Индийской академии педиатрии лактулоза также является терапией первой линии при функциональном запоре [68], при этом применение лактулозы возможно для детей младше одного года (тогда как для ПЭГ – для детей от одного года).
В рекомендациях института Американской гастроэнтерологической ассоциации по медицинскому лечению запоров, вызванных применением опиоидов, лактулоза рассматривается как один из вариантов лечения [69]. Авторы замечают, что при приеме обоих препаратов наблюдались значимые изменения в консистенции и частоте стула. Аналогичные рекомендации приводятся в европейских рекомендациях [70]: макрогол и лактулоза значительно превосходят плацебо по эффективности и могут рассматриваться в качестве терапии при опиоид-индуцированной дисфункции кишечника.
Лактулоза включена также в рекомендации по ведению пациентов с ПЭ. Так, в рекомендациях Итальянской ассоциации изучения печени 2018 г. отмечено [71], что стандартным лечением для снижения уровня аммиака является применение лактулозы внутрь или в виде клизмы, а также применение рифаксимина. Эффективность лактулозы зависит от различных факторов, среди которых и слабительное действие, и закисление содержимого кишечника, а также пребиотическое действие. При этом ректальный путь введения с помощью клизмы также эффективен и может рассматриваться у пациентов с затрудненным глотанием.
В рекомендациях AASLD и EASL 2022 г. по ПЭ [57, 58] лактулоза выступает препаратом первого выбора для терапии эпизодической явной ПЭ, а также в качестве профилактики повторных эпизодов ПЭ после первого эпизода. Рифаксимин в этих рекомендациях также рассматривается в качестве препарата, дополняющего действие лактулозы.
В Российской Федерации лактулоза встречается в виде лекарственных препаратов и биологически активных добавок (БАД). Важно помнить, что БАД не подвергаются независимым испытаниям для подтверждения эффективности их применения, а порою могут содержать небезопасные вещества, что ограничивает их использование.
Заключение
В многочисленных исследованиях, опубликованных за последние 60 лет, показано, что лактулоза обладает различными свойствами, позволяющими рассматривать ее как препарат множественного действия. Лактулоза обладает свойствами не только слабительного препарата, но и пребиотика благодаря своей способности стимулировать пролиферацию бифидобактерий и лактобацилл в толстой кишке вследствие увеличения концентрации полезных короткоцепочечных жирных кислот. Пребиотическое свойство обеспечивает пост-эффект препарата длительностью до четырех месяцев. Благодаря своим свойствам и хорошей изученности лактулоза обладает рядом преимуществ перед другими препаратами, применяемыми при запорах и печеночной энцефалопатии.
Авторы заявляют об отсутствии конфликта интересов.
D.S. Bordin, PhD, Prof., L.Kh. Indeikina, PhD, E.V. Vinnitskaya, PhD, M.A. Danilov, PhD, E.A. Sabelnikova, PhD
A.S. Loginov Moscow Clinical Scientific Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Tver State Medical University
Scientific Research Institute of Healthcare and Medical Management of the Moscow City Health Department
Contact person: Dmitry S. Bordin, d.bordin@mknc.ru
Lactulose is a disaccharide derived from lactose milk sugar using β-galactosidase or epimerase and consisting of fructose and galactose. The first mention of lactulose dates back to 1929, but clinical interest in this drug appeared much later. In 1957, Petuely discovered that the use of lactulose increased the number of fecal bacteria of the genus Bifidobacterium in infants. The features of the drug are described, the mechanism of action of which allows reproducing both laxative and prebiotic effects. The restoration of intestinal microbiocenosis is associated with the improvement in the course of diseases (constipation, hepatic encephalopathy) and the quality of patients’ life. Due to the possibility of use in different age periods, especially in sensitive categories, children, pregnant and elderly patients, as well as the duration and safety of its use, lactulose has advantages in comparison with other drugs. Considered the principles of lactulose use in patients with chronic functional constipation and liver diseases reflected in clinical recommendations.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.