Сравнительная эффективность лечения печеночной энцефалопатии у пациентов с циррозом печени после шунтирующих вмешательств
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить динамику и эффективность лечения разными схемами антибактериальной терапии (АБТ) печеночной энцефалопатии у пациентов с циррозом печени после трансъюгулярного внутрипеченочного портосистемного шунтирования (ТИПС).
Материал и методы. В проспективное когортное исследование последовательно включено 69 пациентов с циррозом печени различной этиологии с наличием показаний к проведению ТИПС. В зависимости от получаемой схемы АБТ для профилактики нарастания ПЭ в послеоперационном периоде пациенты были разделены на три группы: первая – монотерапия метронидазолом (1500 мг в сутки); вторая – монотерапия рифаксимином-α (1200 мг в сутки); третья – интермиттирующая терапия: метронидазол (1500 мг в сутки) 10 дней, затем рифаксимин-α (1200 мг в сутки) 10 дней, далее 10-дневный перерыв в применении АБТ и повторение курса. Для оценки эффективности лечения изучали показатели шкалы оценки тяжести состояния пациентов с циррозом печени (Model for End-Stage Liver Disease, MELD), определяли баллы по Чайлд-Пью (СТР), фиксировали стадии печеночной энцефалопатии по West-Haven (W.-H.) до и после установки ТИПС на фоне проведенной АБТ.
Результаты. В ходе исследования из анализа было исключено 11 пациентов, получавших парентеральную терапию антибиотиками широкого спектра, в связи с наличием сопутствующей патологии и выраженным инфекционно-воспалительным процессом. Пациенты всех групп – первой (n = 39), второй (n = 9) и третьей (n = 10) были сопоставимы по возрасту (р = 0,31), исходному уровню MELD (р = 0,14) и СТР (р = 0,22). Во всех группах на фоне терапии в течение двух – четырех недель у пациентов отмечалось снижение баллов СТР: в первой – на 0,41 балла; во второй – на 1 балл; в третьей – на 0,6 балла. Также во второй и третьей группах отмечено снижение MELD: на 0,66 балла для второй и на 1,9 балла для третьей группы (р = 0,04). Отмечена достоверная разница между группами по исходному уровню ПЭ вследствие более тяжелого течения в третьей группе (р = 0,005). Через семь дней терапии после проведения ТИПС группы стали сопоставимы по стадии ПЭ (р = 0,239) преимущественно вследствие ухудшения состояния пациентов в первой и второй группах. Оценка стадии ПЭ после лечения показала отсутствие достоверных различий между группами (р = 0,67), в первой группе произошло ухудшение – у 2 (5,1%) пациентов, а улучшение – у 32 (82,1%) пациентов, во второй группе улучшение – у 5 (55,6%) пациентов, в третьей группе улучшение – у 9 (90%) пациентов.
Заключение. Терапия печеночной энцефалопатии в послеоперационном периоде ТИПС по интермиттирующей схеме метронидазол + рифаксимин-α показала большие возможности по улучшению прогноза для больных, а также способствовала более выраженному улучшению когнитивных функций у пациентов. В ходе исследования обосновано проведение дополнительных исследований различных режимов АБТ у пациентов в послеоперационном периоде ТИПС с привлечением многопрофильных центров с целью оптимизация затрат на оказание медикаментозной помощи и адекватной коррекции развернутой формы ПЭ, ассоциированной с ТИПС.
Цель исследования – оценить динамику и эффективность лечения разными схемами антибактериальной терапии (АБТ) печеночной энцефалопатии у пациентов с циррозом печени после трансъюгулярного внутрипеченочного портосистемного шунтирования (ТИПС).
Материал и методы. В проспективное когортное исследование последовательно включено 69 пациентов с циррозом печени различной этиологии с наличием показаний к проведению ТИПС. В зависимости от получаемой схемы АБТ для профилактики нарастания ПЭ в послеоперационном периоде пациенты были разделены на три группы: первая – монотерапия метронидазолом (1500 мг в сутки); вторая – монотерапия рифаксимином-α (1200 мг в сутки); третья – интермиттирующая терапия: метронидазол (1500 мг в сутки) 10 дней, затем рифаксимин-α (1200 мг в сутки) 10 дней, далее 10-дневный перерыв в применении АБТ и повторение курса. Для оценки эффективности лечения изучали показатели шкалы оценки тяжести состояния пациентов с циррозом печени (Model for End-Stage Liver Disease, MELD), определяли баллы по Чайлд-Пью (СТР), фиксировали стадии печеночной энцефалопатии по West-Haven (W.-H.) до и после установки ТИПС на фоне проведенной АБТ.
Результаты. В ходе исследования из анализа было исключено 11 пациентов, получавших парентеральную терапию антибиотиками широкого спектра, в связи с наличием сопутствующей патологии и выраженным инфекционно-воспалительным процессом. Пациенты всех групп – первой (n = 39), второй (n = 9) и третьей (n = 10) были сопоставимы по возрасту (р = 0,31), исходному уровню MELD (р = 0,14) и СТР (р = 0,22). Во всех группах на фоне терапии в течение двух – четырех недель у пациентов отмечалось снижение баллов СТР: в первой – на 0,41 балла; во второй – на 1 балл; в третьей – на 0,6 балла. Также во второй и третьей группах отмечено снижение MELD: на 0,66 балла для второй и на 1,9 балла для третьей группы (р = 0,04). Отмечена достоверная разница между группами по исходному уровню ПЭ вследствие более тяжелого течения в третьей группе (р = 0,005). Через семь дней терапии после проведения ТИПС группы стали сопоставимы по стадии ПЭ (р = 0,239) преимущественно вследствие ухудшения состояния пациентов в первой и второй группах. Оценка стадии ПЭ после лечения показала отсутствие достоверных различий между группами (р = 0,67), в первой группе произошло ухудшение – у 2 (5,1%) пациентов, а улучшение – у 32 (82,1%) пациентов, во второй группе улучшение – у 5 (55,6%) пациентов, в третьей группе улучшение – у 9 (90%) пациентов.
Заключение. Терапия печеночной энцефалопатии в послеоперационном периоде ТИПС по интермиттирующей схеме метронидазол + рифаксимин-α показала большие возможности по улучшению прогноза для больных, а также способствовала более выраженному улучшению когнитивных функций у пациентов. В ходе исследования обосновано проведение дополнительных исследований различных режимов АБТ у пациентов в послеоперационном периоде ТИПС с привлечением многопрофильных центров с целью оптимизация затрат на оказание медикаментозной помощи и адекватной коррекции развернутой формы ПЭ, ассоциированной с ТИПС.
Введение
Цирроз печени (ЦП) – это терминальная стадия ряда хронических заболеваний печени, представляющая собой диффузный фиброз и трансформацию органа с образованием узлов [1] и развитием печеночной недостаточности. ЦП является причиной смерти около 1 млн человек ежегодно [2]. Средняя длительность жизни пациентов с компенсированным циррозом печени достигает 9–12 лет, тогда как при декомпенсации заболевания не превышает обычно двух лет [3]. Наиболее тяжелыми осложнениями ЦП являются состояния, связанные с портальной гипертензией (кровотечение из варикозных вен пищевода и желудка (ВВПиЖ)), асцит и гидроторакс, гепаторенальный синдром (ГРС), печеночная энцефалопатия (ПЭ) и гепатоцеллюлярная недостаточность [1]. Портальная гипертензия – синдром, характеризующийся повышением портального градиента давления > 10 мм рт. ст. с развитием порто-системных коллатералей, что обеспечивает сброс крови из портальной вены в системный кровоток, минуя печень [1, 4]. Клинические проявления портальной гипертензии связаны с вазодилатацией и формированием ВВПиЖ, которые могут осложниться кровотечением.
Единственным радикальным методом лечения цирроза печени является трансплантация печени [1, 2]. Однако дефицит донорских органов приводит к увеличению длительности нахождения пациентов в листе ожидания, что диктует необходимость применения бридж-технологий для достижения компенсации и снижения летальности пациентов с циррозом печени. Симптоматическим лечением ВВПиЖ является эндоскопическое лигирование вен пищевода. В качестве патогенетического лечения ВВПиЖ целесообразен длительный прием неселективных β-адреноблокаторов (БАБ), эффективность которых сопоставима с эффективностью эндоскопического лигирования [4]. Тем не менее, по данным исследования Krag и соавт. от 2014 г. [5], длительный прием БАБ может увеличивать частоту развития асцита и ассоциированных осложнений. Патогенетически обусловленными являются шунтирующие методы коррекции портальной гипертензии – трансъюгулярное внутрипеченочное портосистемное шунтирование (ТИПС), баллон-окклюзионная ретроградная трансвенозная облитерация (БРТО) путей притока к желудочным варикозно-расширенным венам, эндоваскулярная эмболизация селезеночной артерии и азигопортальное разобщение [4, 6]. Из всех этих методов именно ТИПС получил наибольшее распространение в клинической практике.
Показаниями для проведения ТИПС в плановом порядке являются частые повторные кровотечения из варикозно раширенных вен пищевода (ВРВП), резистентный асцит, рецидивирующий гидроторакс, синдром Бадда – Киари, тромбоз ствола воротной вены при неэффективности антикоагулянтной терапии, в экстренном порядке – желудочно-кишечное кровотечение (ЖКК) при неэффективности консервативной терапии и эндоскопического лигирования [4].
Относительными противопоказаниями к ТИПС являются: тяжелая печеночная недостаточность (международное нормализованное отношение – более 2, нарастание печеночной энцефалопатии выше второй стадии по West-Haven (W.-H.)), тромбоцитопения ниже 75 × 109/л, тяжелая систолическая или диастолическая дисфункция, легочная гипертензия, сопутствующая инфекция, нарастающая почечная недостаточность, тяжелая сопутствующая патология других органов и систем, возраст старше 70 лет, кахексия, когнитивные нарушения, отсутствие социальной и семейной поддержки [7, 8].
Своевременное проведение шунтирующих операций улучшает качество жизни больных, однако может приводить к значительному усугублению ПЭ у 20–50% пациентов [9–11, 19], что ограничивает применение данного метода.
Факторами риска развития ПЭ, развивающейся после установки ТИПС (пост-ТИПС ПЭ), являются: наличие ПЭ в анамнезе, пожилой возраст (старше 70 лет), наличие спонтанных портосистемных шунтов диаметром > 6 мм, диаметр установленного стента 10 мм, гипонатриемия, саркопения, прием ингибиторов протонной помпы (ИПП), сахарный диабет, хроническая болезнь почек (скорость клубочковой фильтрации < 30 мл/мин/1,73 кв. м) [9–13].
Основным патогенетическим фактором развития пост-ТИПС ПЭ является шунтирование крови, богатой аммиаком, в системный кровоток, минуя орнитиновый цикл в печени [8, 14]. Аммиак является основным продуктом дезаминирования аминокислот. Проходя через гематоэнцефалический барьер, он вызывает ряд следующих эффектов. При острой пост-ТИПС ПЭ наблюдается отек астроцитов, обусловленный осмотическим градиентом и вазодилатацией сосудов головного мозга, что, в конечном итоге, может привести к вклинению ствола головного мозга. При хронической пост-ТИПС ПЭ выработка свободных радикалов и последующее развитие воспаления приводят к митохондриальной дисфункции, эксайтотоксичности и опосредованной стимуляции рецепторов гамма-аминомасляной кислоты [15–17].
К методам профилактики развития пост-ТИПС ПЭ относятся: коррекция гипонатриемии и нутритивного статуса, прекращение приема ИПП при отсутствии показаний, эмболизация спонтанных портосистемных шунтов (SPSS), использование при ТИПС стентов диаметром 8 мм, модификация шунта (например, частичная окклюзия ТИПС) и медикаментозная терапия [10, 19]. По результатам исследований комбинация рифаксимина-α и лактулозы ассоциирована с более низкой частотой возникновения ПЭ, в то время как клиническая эффективность L-орнитин L-аспартата (LOLA), согласно ряду исследований, недостаточна у данной группы больных [20].
Опубликованные на настоящий момент данные не содержат информации о длительности приема и адекватных дозировках препаратов, приводящих к регрессу негативной симптоматики, отсутствует единообразный подход к ведению пациентов с post-TIPS ПЭ [9, 11, 18, 19].
В Московском многопрофильном научно-клиническом центре (ММНКЦ) им. С.П. Боткина в период 2018–2022 гг. наблюдалось 724 пациента, проходивших стационарное лечение в связи с двумя и более эпизодами декомпенсации цирроза печени, из них 422 (58,3%) женщины и 302 (41,75%) мужчины, средний возраст пациентов – 54 ± 12,46 года. У 449 (62%) пациентов диагностирована клинически значимая ПЭ стадий II–IV по W.-H. Декомпенсация ПЭ до стадии III–IV по W.-H. отмечена у всех пациентов с циррозом печени, осложненным либо кровотечением из ВВПиЖ, либо спонтанным бактериальным перитонитом. Пациенты с явной ПЭ были госпитализированы не менее двух раз в год. За период 2019–2022 гг. 55 пациентам была выполнена коррекция портальной гипертензии методом ТИПС, в послеоперационном периоде все больные получали LOLA и лактулозу, помимо этого 33 пациентам проводили лечение пероральными антибактериальными препаратами (рифаксимин-α, метронидазол, норфлоксацин, ципрофлоксацин) с целью санации кишечника в первые 14 дней после вмешательства и далее ежемесячно в течение 7–10 дней каждого месяца; 32 пациентам циклическую санацию кишечника не назначали. Предварительный анализ данных показал, что в группе пациентов с назначением циклической санации кишечника нарастание печеночной энцефалопатии до явной (второй и более стадии по W.-H.) отмечено лишь у 7 (21,2%) пациентов, в то время, как в группе пациентов, не получавших АБТ для санации кишечника, – у 27 (84,8%) пациентов.
Таким образом, отсутствие стандартизированного лечения ПЭ, ассоциированной с шунтирующими вмешательствами, определяет необходимость проведения исследований с целью улучшения результатов лечения больных с ЦП.
Цель исследования – оценка динамики и эффективности лечения печеночной энцефалопатии с использованием различных схем антибактериальных препаратов у пациентов с циррозом печени различной этиологии после проведенного ТИПС.
Материал и методы
В ходе проспективного когортного исследования, одобренного локально-этическим комитетом, на базе ММНКЦ им. С.П. Боткина в число наблюдаемых последовательно включали пациентов с циррозом печени, госпитализированных для проведения ТИПС в период с 2021 по 2024 г. Все пациенты подписывали форму информированного согласия на участие в исследовании.
Критерии включения: наличие цирроза печени любой этиологии с MELD > 8 баллов с ассоциированными осложнениями: ВРВП второй-третьей степени с повторными эпизодами кровотечений, ВВПиЖ, резистентный асцит и/или рецидивирующий гидроторакс.
Критерии исключения: злокачественное новообразование, септическое состояние, печеночная энцефалопатия четвертой стадии по W.-H. до ТИПС.
В ходе исследования оценивали следующие параметры: пол, возраст, баллы MELD [1] и СТР [1] до проведения ТИПС и через две недели после него, наличие и степень ВРВПиЖ, наличие асцита и его степень, наличие лигирования в анамнезе, наличие кровотечений ВВПиЖ в анамнезе, показания к выполнению ТИПС, рецидив ЖКК после ТИПС, несостоятельность ТИПС, стадия ПЭ до проведения ТИПС, а также в течение двух недель после ТИПС и в конце АБТ, наличие гепаторенального синдрома до ТИПС, наличие спонтанного бактериального перитонита (СБП) в анамнезе, наличие гидроторакса до ТИПС. Временными точками контроля были приняты исходное состояние пациента и состояние пациента в динамике через 7–14 дней и через четыре недели после ТИПС.
Стадию печеночной энцефалопатии оценивали по шкале W.-H. [1] с использованием теста связывания чисел [1] и теста с наименованиями животных [22, 23].
В предоперационный период всем пациентам выполняли эзофагогастродуоденоскопию и компьютерную томографию органов брюшной полости с внутривенным контрастированием, проводили водородный дыхательный тест, при необходимости рентгенографию органов грудной клетки и ультразвуковое исследование плевральных полостей. В послеоперационный период выполняли скрининговое ультразвуковое исследование органов брюшной полости с оценкой состоятельности стента.
Во время вмешательства (ТИПС) всем пациентам по стандартной методике установлены единообразные стенты – HANAROSTENT Hepatico-Biliary (NC) 10-080-060 с диаметров 8 мм.
При формировании групп были учтены такие факторы риска декомпенсации печеночной энцефалопатии, как наличие у пациента на момент выполнения ТИПС синдрома избыточного бактериального роста в кишечнике (СИБР) и указания в анамнезе на эпизоды декомпенсации печеночной энцефалопатии, потребовавшие стационарного лечения в течение предшествовавшего года.
В первую группу вошли пациенты, у которых отсутствовали анамнестические указания на стационарное лечение по поводу декомпенсации печеночной энцефалопатии в течение предшествующего года, однако на момент выполнения ТИПС был выявлен СИБР. Пациенты первой группы получали метронидазол (таблетки) в дозе 1500 мг в сутки в течение 7–14 дней.
Пациенты второй группы не проходили стационарное лечение в связи с печеночной энцефалопатией в течение предшествующего года, данных за СИБР не было получено. Пациенты второй группы получали рифаксимин-α (таблетки Альфа Нормикс) в дозе 1200 мг в сутки в течение 7–14 дней.
В третью группу вошли пациенты с одним и более эпизодом госпитализации, связанной с декомпенсацией печеночной энцефалопатии в течение предшествующего года, у которых был выявлен СИБР. Пациенты третьей группы получали продленную АБТ по интермиттирующей схеме в следующем режиме: метронидазол (таблетки) 1500 мг в сутки – 10 дней, далее рифаксимин-α (таблетки Альфа Нормикс) 1200 мг в сутки – 10 дней, далее 10-дневный перерыв (антибактериальные препараты не принимались), а затем курс лечения повторялся.
В четвертую группу вошли пациенты, которые вынужденно получали парентеральные системные антибактериальные препараты в связи с ассоциированными состояниями.
Статистический анализ данных проводили с использованием среды для статистических вычислений Statistica (StatSoft Inc, США). Для выбора статистического критерия оценки количественных переменных предварительно проводили сравнение их распределения с нормальным (отдельно для каждой из групп) с использованием критерия Колмогорова – Смирнова. При нормальном распределении для оценки статистической значимости различий был применен критерий Стьюдента. Если распределение параметра хотя бы в одной из групп статистически значимо отличалось от нормального, выбирали критерий Манна – Уитни. Значения нормально распределенных переменных представлено как среднее (М) ± стандартное отклонение (SD). При несоответствии распределения переменной нормальному значение переменных представлено как медиана (Ме) и 25-й и 75-й квартили. Для оценки статистической значимости различий значений качественных переменных использовали χ-критерий, или точный критерий Фишера (если более чем в 25% ячеек ожидаемые значения были меньше 5). За уровень значимости принято р ≤ 0,05.
Результаты
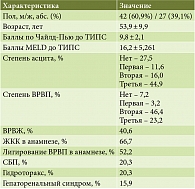
В период с марта 2021 по ноябрь 2024 г. в исследование было последовательно включено 69 больных, из них 42 (60,9%) мужчины и 27 (39,1%) женщин (табл. 1). Средний возраст исследуемых составил 53,9 ± 9,9 года. По этиологии цирроза печени на долю вирусных гепатитов пришлось 28 (40,6%) случаев, алкогольный цирроз печени встречался у 18 (26,1%) пациентов, в 15 (21,75%) случаях отмечалось сочетание этих факторов, в 8 (11,6%) определены иные причины ЦП.
До выполнения оперативного вмешательства средний балл по Чайлд-Пью (СТР) составлял 9,48 ± 2,1, средний балл по MELD – 16,2 ± 5,261.
У 51 (74%) пациента перед выполнением ТИПС был диагностирован СИБР.
Практически у половины пациентов – 31 (44,9%) человек – отмечался асцит третьей степени, ВРВП второй-третьей степени были диагностированы более чем у половины пациентов – 48 (69,6%) человек, ВРВЖ выявлено у 28 (40,6%) больных. У большей части больных – 46 (66,7%) человек – в анамнезе отмечались эпизоды ЖКК. У половины пациентов – 36 (52,2%) человек – ранее проводили эндоскопическое лигирование ВРВП. Кроме того, с равной частотой у 14 (20,3%) пациентов выявлены правосторонний (печеночный) гидроторакс и спонтанный бактериальный перитонит, у 11 (15,9%) пациентов – гепаторенальный синдром (табл. 1).
Чаще всего показанием к ТИПС являлся резистентный асцит (43,5%) с необходимостью не менее трех лапароцентезов в год. Почти у трети пациентов показаниями стали рецидив ВВПиЖ после ранее выполненного эндоскопического лигирования – 18 (26,1%) человек и повторные эпизоды ЖЖК – 20 (27,5%) человек. В 1 (1,4%) случае ТИПС проводили в связи с рецидивирующим гидротораксом.
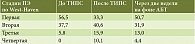
В раннем послеоперационном периоде несостоятельность ТИПС была выявлена у 3 (4,3%) пациентов и сопровождалась нарастанием отечно-асцитического синдрома и рецидивом ВВПиЖ. Максимальное нарастание печеночной энцефалопатии отмечено в среднем к 4 ± 1,5 суткам после вмешательства (табл. 2).
В группе исследования общая летальность составила 7 (10,2%) случаев в течение шести недель после оперативного вмешательства. Причиной смерти в двух случая стало ЖКК, в двух случаях – декомпенсация печеночно-клеточной недостаточности, у трех больных – нарастание печеночной энцефалопатии.
11 (15,9%) пациентов четвертой группы в нашем исследовании получали парентеральные системные антибактериальные препараты в связи с ассоциированными состояниями: шесть человек получали данную схему терапии в связи с развитием печеночной энцефалопатии стадии IV (кома) и невозможностью перорального приема лекарственных средств, оставшиеся пять человек получали данную схему из-за наличия активного инфекционного процесса. Все пациенты четвертой группы в раннем послеоперационном периоде пребывали в тяжелом состоянии и имели признаки выраженного системного воспалительного процесса, что послужило причиной исключения группы из дальнейшего анализа и исследования. Летальность в четвертой группе составила 27,3%.
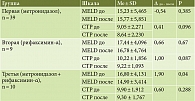
Первая, вторая, третья группы были сопоставимы по возрасту (53,36 ± 9,634; 59,22 ± 11,189; 55,10 ± 9,146 года соответственно, р = 0,031). В первой и второй группах не было значимых различий между мужчинами и женщинами (27 (69,2%) в сравнении с 12 (30,8%); 5 (55,6%) в сравнении с 4 (44,4%) соответственно), в третьей группе значимо преобладали женщины (8 (80,0%) в сравнении с 2 (20,0%), р = 0,018).
Первая, вторая, третья группы были сопоставимы по исходному уровню MELD (р = 0,142) и CTP (0,22) до проведения вмешательства. На фоне проводимой последовательной терапии метронидазолом и рифаксимином-α в третьей группе отмечалось статистически значимое снижение уровня MELD (р = 0,04) (табл. 3).
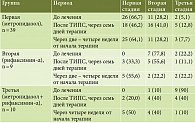
Отмечалась достоверная разница между группами по исходному уровню ПЭ вследствие более тяжелого течения в третьей группе (р = 0,005). Через семь дней терапии после проведения ТИПС группы стали сопоставимы по стадии ПЭ (р = 0,239), преимущественно из-за ухудшения в первой и второй группах. В первой группе ухудшение отмечалось у 14 (35,9%) пациентов, во второй – у 5 (55,6%) пациентов, в третьей группе – у 4 (40%) пациентов (р = 0,47). Ко второй неделе лечения во всех группах отмечалось снижение стадии ПЭ по сравнению с состоянием после ТИПС: в первой группе у 38 (97,4%) пациентов, во второй группе – у 8 (88,9%) пациентов, в третьей группе – у 10 (100%) пациентов. Оценка стадии ПЭ после лечения показала отсутствие достоверных различий между группами (р = 0,67) (табл. 4).
Сравнение исходной стадии ПЭ и стадии ПЭ через две – четыре недели после вмешательства на фоне проводимой АБТ терапии не показало достоверных различий (р = 0,171): ухудшение было в первой группе – у 2 (5,1%) пациентов, улучшение в первой – у 32 (82,1%), во второй – у 5 (55,6%), в третьей группе – у 9 (90%) пациентов.
Обсуждение
Лечение печеночной энцефалопатии у пациентов в послеоперационном периоде ТИПС, согласно действующим клиническим рекомендациям Российского общества по изучению печени и Российской гастроэнтерологической ассоциации по диагностике и лечению фиброза и цирроза печени и их осложнений от 2021 г., включало назначение лактулозы, L-орнитин L-аспартата (LOLA) и обязательное (с учетом патогенетического механизма нарастания пост-ТИПС ПЭ) использование антибактериальных препаратов для подавления аммониепродуцирующей флоры.
Рифаксимин является наиболее обоснованным выбором для антибактериальной терапии при циррозе печени. Доказано его влияние на снижение уровня аммиака в крови, улучшение психического статуса, уменьшение выраженности астериксиса, снижение стадии ПЭ. Назначение рифаксимина включено в критерии оценки качества оказания медицинской помощи у пациентов с печеночной энцефалопатией любой стадии [24]. Согласно мета-анализу рандомизированных исследований, назначение рифаксимина-α в суточной дозе 1100 мг в течение 6–12 месяцев показало эффективность рифаксимина-α для профилактики инфицированного асцита при циррозе печени. Помимо снижения риска инфицирования асцитической жидкости у пациентов с циррозом печени применение рифаксимина-α сопровождалось увеличением общей выживаемости, при этом частота развития Clostridium difficile-ассоциированной диареи не превышала таковую в сравнении с пациентами, получающими лактулозу [25]. Стоит отметить, что в когорте больных с показаниями к проведению ТИПС у 74% пациентов (51 больной) был диагностирован СИБР, что дополнительно подчеркивает наличие патогенетически обоснованной мишени для применения АБТ в послеоперационный период. В актуальных научных публикациях по лечению пациентов с печеночной энцефалопатией предлагается использовать рифаксимин-α, также могут применяться такие препараты, как метронидазол, неомицин, пероральный ванкомицин, паромомицин и пероральные хинолоны. Оба применяемых нами препарата имеют широкий спектр антибактериальной активности, воздействуя на большинство грамположительных и грамотрицательных как аэробных, так и анаэробных бактерий. Они рекомендованы к применению у пациентов с СИБР [26, 27] и показывают свою эффективность в отношении клостридиальной инфекции [28], что особенно важно для нашей когорты пациентов, часто проходящих стационарное лечение и имеющих повышенные риски развития антибиотико-ассоциированного колита.
По имеющимся данным, рифаксимин в полиморфной форме альфа практически не всасывается в желудочно-кишечном тракте и имеет низкий риск системных эффектов [29]. Метронидазол – препарат с описанным системным действием и некоторыми побочными эффектами (подробно изученными и управляемыми), рекомендованный к применению при лечении СИБР и клостридиальных колитов [26–28]. В ходе представленного исследования не выявлено нарастания печеночно-клеточной недостаточности, оцениваемой по MELD и СТР при применении различных схем АБТ, в том числе продленная интермиттирующая терапия метронидазолом и рифаксимином-α не сопровождалась нарастанием гепатотоксичности.
Нарастание ПЭ ожидаемо стало основным осложнением послеоперационного периода ТИПС (см. табл. 2), в этот период развитие печеночной энцефалопатии стадий III–IV отмечено у 18 (26%) пациентов.
В третью группу были включены наиболее сложные пациенты с двумя факторами риска декомпенсации печеночной энцефалопатии и ожидаемо исходно более тяжелой стадией ПЭ (р = 0,005), что определяло назначение интермиттирующей схемы терапии. Использование данной схемы показало достоверно значимое понижение уровня MELD (р = 0,04), что позволило улучшить их прогноз. Во всех группах после проведения ТИПС ожидаемо происходило ухудшение когнитивных функций у пациентов. В то же время обращает на себя внимание, что именно в третьей группе удалось достичь наибольшего результата по переходу ПЭ в более легкую стадию (90%) по сравнению с исходной.
К ограничениям исследования относится небольшое количество наблюдений, которое не позволило достичь необходимого уровня достоверности для изучаемых переменных.
Проведенное клиническое исследование затрагивает актуальную тему – снижение летальности и улучшения качества жизни больных с терминальной стадией заболевания печени. Согласно опубликованным данным [30], смертность в листе ожидания трансплантации достигает 27,8% в течение года, печеночная энцефалопатия повышает риск негативного исхода в 4,2 раза, а развитие неконтролируемого асцитического синдрома и кровотечений и варикозно-расширенных вен пищевода и желудка являются независимыми предикторами негативного исхода с наибольшим риском смерти, что обусловливает актуальность поиска терапевтических подходов к лечению этих состояний.
Заключение
Применение интермитирующей продленной схемы лечения с использованием метронидазола и рифаксимина-α показало значительные возможности на примере группы пациентов с наиболее высокими рисками к усугублению ПЭ после перенесенной ТИПС. Результаты исследования свидетельствуют о необходимости разработки стандартизированного подхода к лечению больных с печеночной энцефалопатией после шунтирующих вмешательств и проведению дополнительных исследований различных режимов АБТ у пациентов в послеоперационный период после проведения ТИПС с привлечением многопрофильных центров для оптимизации затрат на оказание медикаментозной помощи и адекватной коррекции клинически значимой печеночной энцефалопатии.
Авторы заявляют об отсутствии конфликта интересов.
S.V. Osipova, Ch.S. Pavlov, PhD, Prof., P.A. Drozdov, PhD, S.M. Sorokoletov, PhD, O.N. Levina, PhD, N.A. Ivanova, G.S. Mikhailyants, PhD, Prof., A.A. Novikоva
S.P. Botkin Moscow Multidisciplinary Scientific and Clinical Center, S.P. Botkin City Clinical Hospital, Moscow
I.M. Sechenov First Moscow State Medical University
Russian Medical Academy of Continuous Professional Education, Moscow
Contact person: Svetlana V. Osipova, osipovasv@botkinmoscow.ru
The progression of hepatic encephalopathy (HE) is a major complication of shunting methods for the correction of portal hypertension. However, at present, there are no standardized treatment and prevention regimens for this condition.
Aim – to assess the dynamics and effectiveness of different schemes of antibiotic therapy (ABT) for hepatic encephalopathy in patients with liver cirrhosis after undergoing TIPS.
Material and methods. A prospective cohort study sequentially included 69 patients with liver cirrhosis of various etiologies who had indications for TIPS (transjugular intrahepatic portosystemic shunt). Based on the antibiotic therapy (ABT) scheme received to prevent the progression of hepatic encephalopathy (HE) in the postoperative period, patients were divided into groups: group 1 – monotherapy with metronidazole (1500 mg per day); group 2 – monotherapy with rifaximin-α (1200 mg per day); group 3 – intermittent therapy: metronidazole (1500 mg per day) for 10 days, followed by rifaximin-α (1200 mg per day) for 10 days, then a 10-day break from ABT administration and repetition of the course. To evaluate the efficacy of treatment, the following parameters were analyzed before and after TIPS placement while receiving ABT: MELD score, Child-Pugh (C-P) class, and degrees of hepatic encephalopathy according to West-Haven (W.-H.).
Results. During the study, 11 patients receiving parenteral broad-spectrum antibiotic therapy due to concomitant pathology and severe infectious-inflammatory bacterial processes were excluded from the analysis. Groups 1 (n = 39), 2 (n = 9), and 3 (n = 10) were comparable in terms of age (p = 0.31), baseline MELD scores (p = 0.14), and CTR scores (p = 0.22). In all patient groups, during 2–4 weeks of therapy, a decrease in CTR scores was observed: group 1 decreased by 0.41 points; group 2 decreased by 1.0 point; group 3 decreased by 0.6 points. Additionally, groups 2 and 3 showed a reduction in MELD scores: group 2 decreased by 0.66 points, and group 3 decreased by 1.9 points (p = 0.04). There was a significant difference between the groups regarding the initial level of HE, mainly due to more severe disease progression in group 3 (p = 0.005). After 7 days of therapy following TIPS, the groups became comparable in terms of HE severity (p = 0.239), primarily due to worsening conditions in groups 1 and 2. The assessment of HE severity after treatment revealed no significant differences between the groups (p = 0.67): in group 1, 5.1% (2 patients) experienced deterioration, whereas improvement occurred in 82.1% (32 patients) of group 1, 55.6% (5 patients) of group 2, and 90% (9 patients) of group 3.
Conclusion. Treatment of hepatic encephalopathy in the postoperative period after TIPS using an intermittent metronidazole + rifaximin-α regimen demonstrated greater potential for improving prognosis for patients and contributed to more pronounced improvements in cognitive function among patients. During the study, it was justified to conduct additional research on various ABT regimens in patients in the postoperative period after TIPS, involving multidisciplinary centers, with the aim of optimizing costs for providing medical care and adequately correcting the advanced form of HE associated with TIPS.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.