Cравнительная эффективность различных режимов терапии рифаксимином-α у пациентов с минимальной печеночной энцефалопатией и циррозом печени (анализ шестимесячного наблюдения)
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – изучение оптимальных режимов применения рифаксимина-α и его влияния на основные клинико-лабораторные показатели и качество жизни пациентов с МПЭ на фоне ЦП в ходе продолжительного лечения.
Материал и методы. Критерии включения: мужчины и женщины от 18 до 75 лет; наличие ЦП; наличие МПЭ; подписанное добровольное информированное согласие. Критерии невключения: отказ от участия в исследовании; острый гепатит; коинфекция вирусом иммунодефицита человека; тяжелая коморбидная патология; психические заболевания; болезнь Вильсона – Коновалова. Проведены клиническое обследование (анализ жалоб пациентов, оценка объективного статуса); лабораторные исследования (уровень аммиака); оценка степени тяжести заболевания печени по шкале Чайлда – Пью; оценка степени ПЭ по результатам психометрических тестов (тест связи чисел, тест на наименование животных, краткая шкала оценки психического статуса); анкета оценки качества жизни (SF-36).
Результаты. При отсутствии терапии рифаксимином-α отмечается ухудшение качества жизни вследствие снижения показателей психического компонента здоровья, а также увеличение времени выполнения психометрического теста связи чисел.
На фоне постоянной и циклической терапии рифаксимином-α у пациентов с ЦП и МПЭ в течение шести месяцев наблюдения снизился уровень аммиака капиллярной крови.
Заключение. При сравнении эффективности непрерывной и курсовой терапии рифаксимином-α результаты не показали существенных различий, что указывает на равноценность указанных режимов терапии через шесть месяцев наблюдения.
Цель исследования – изучение оптимальных режимов применения рифаксимина-α и его влияния на основные клинико-лабораторные показатели и качество жизни пациентов с МПЭ на фоне ЦП в ходе продолжительного лечения.
Материал и методы. Критерии включения: мужчины и женщины от 18 до 75 лет; наличие ЦП; наличие МПЭ; подписанное добровольное информированное согласие. Критерии невключения: отказ от участия в исследовании; острый гепатит; коинфекция вирусом иммунодефицита человека; тяжелая коморбидная патология; психические заболевания; болезнь Вильсона – Коновалова. Проведены клиническое обследование (анализ жалоб пациентов, оценка объективного статуса); лабораторные исследования (уровень аммиака); оценка степени тяжести заболевания печени по шкале Чайлда – Пью; оценка степени ПЭ по результатам психометрических тестов (тест связи чисел, тест на наименование животных, краткая шкала оценки психического статуса); анкета оценки качества жизни (SF-36).
Результаты. При отсутствии терапии рифаксимином-α отмечается ухудшение качества жизни вследствие снижения показателей психического компонента здоровья, а также увеличение времени выполнения психометрического теста связи чисел.
На фоне постоянной и циклической терапии рифаксимином-α у пациентов с ЦП и МПЭ в течение шести месяцев наблюдения снизился уровень аммиака капиллярной крови.
Заключение. При сравнении эффективности непрерывной и курсовой терапии рифаксимином-α результаты не показали существенных различий, что указывает на равноценность указанных режимов терапии через шесть месяцев наблюдения.





Введение
Печеночная энцефалопатия (ПЭ) – это прогностически значимый нейропсихиатрический синдром, который возникает в ходе острого или хронического заболевания печени. Пациенты с ПЭ обычно испытывают широкий спектр когнитивных нарушений, степень тяжести которых варьируется от изменений скорости психомоторных движений и рабочей памяти до более прогрессирующих психиатрических проявлений, таких как грубая дезориентация и кома [1]. При циррозе печени (ЦП) в течение одного года, пяти и 10 лет совокупная заболеваемость ПЭ колеблется от 0 до 21%, от 5 до 25% и от 7 до 42% соответственно. Данные о распространенности ПЭ варьируются в зависимости от основной причины, тяжести проявления заболевания и определения ПЭ (латентной/минимальной или явной) [2].
ПЭ варьируется по тяжести от минимальной ПЭ (обнаруживаемой только с помощью нейропсихометрического тестирования и затрагивающей 20–80% пациентов с ЦП) до явной ПЭ (определяемой как Уэст-Хейвен второй степени или выше и затрагивающей до 40% пациентов с ЦП) [3].
Минимальная печеночная энцефалопатия (МПЭ), ранее называемая субклинической ПЭ, представляет собой самую раннюю и легкую форму ПЭ. При МПЭ отсутствуют явные клинические проявления, поэтому ее можно диагностировать только с помощью нейропсихологических или психометрических тестов [4]. МПЭ также может проявляться как недавние падения (40% в течение предыдущего года для тех, у кого диагностирована МПЭ, по сравнению с 12,9% для лиц без МПЭ), а также нарушением качества сна [5, 6]. Помимо этого, наличие МПЭ у пациентов с ЦП имеет более высокий однолетний риск автомобильных аварий (17% из 97 пациентов с МПЭ против 3% из 70 лиц без МПЭ) [7].
Проведены исследования, направленные на анализ распространенности МПЭ при ЦП в различных группах. В исследовании с участием 1868 пациентов с ПЭ при ЦП МПЭ была обнаружена у 650 человек (35%). При этом после исключения пациентов с анамнезом явной ПЭ распространенность MПЭ составила 29%. Распространенность МПЭ у пациентов с ЦП была высокой, но существенно варьировалась между стадиями заболевания [8].
По результатам исследования с участием 170 пациентов с ЦП, пациенты с МПЭ имели более высокие показатели госпитализации (47% в сравнении с 15%) и смерти (18% в сравнении с 3%) [9]. Кроме того, МПЭ может иметь медико-социальное и прогностическое значение. Так, приводятся данные, что пациенты с МПЭ входят в группу риска по развитию осложнений ЦП и госпитализации. Кроме того, около 50% пациентов с ЦП и МПЭ в течение трех лет демонстрируют развитие явной ПЭ, что указывает на необходимость ранних лечебно-профилактических мероприятий при МПЭ [10].
В настоящее время терапия МПЭ преимущественно включает в себя лактулозу, препараты L-орнитин-L-аспартата (LOLA), рифаксимин-α и другие препараты, которые не всегда корректно объединяют в группу «гепатопротекторов» [11]. Однако сведений об эффективности различных режимов применения рифаксимина-α на данный момент по-прежнему недостаточно. В связи с этим в последнее время активно изучается влияние рифаксимина-α на МПЭ у пациентов с ЦП [12].
Авторами проведено исследование, направленное на изучение оптимальных режимов применения рифаксимина-α и его влияния на основные клинико-лабораторные показатели и качество жизни пациентов с МПЭ на фоне ЦП в ходе продолжительного лечения.
Материал и методы
Исследование проводилось в разных отделениях клиники им. Петра Великого Северо-Западного государственного медицинского университета (СЗГМУ) им. И.И. Мечникова, а также в Северо-Западном гепатологическом центре СЗГМУ им. И.И. Мечникова и одобрено локальным этическим комитетом СЗГМУ им. И.И. Мечникова.
Все пациенты подписали информированное добровольное согласие на участие в исследовании. Отбор пациентов проведен согласно критериям включения: мужчины и женщины от 18 до 75 лет; наличие ЦП; наличие МПЭ; подписанное добровольное информированное согласие. Критерии невключения: отказ от участия в исследовании; острый гепатит; коинфекция вирусом иммунодефицита человека; тяжелая коморбидная патология; психические заболевания; болезнь Вильсона – Коновалова.
Методы исследования включали в себя:
- клиническое обследование (анализ жалоб пациентов, оценка объективного статуса);
- лабораторные исследования (клинический анализ крови, биохимический анализ крови (аланинаминотрансфераза, аспартатаминотрансфераза, гамма-глутамилтранспептидаза, щелочная фосфатаза, общий белок, альбумин, билирубин, креатинин, глюкоза, международное нормализованное отношение, протромбиновый индекс), уровень аммиака;
- оценку степени тяжести заболевания печени по шкале Чайлда – Пью;
- оценку степени ПЭ по результатам психометрических тестов (тест связи чисел, тест на наименование животных, краткая шкала оценки психического статуса);
- анкету оценки качества жизни (SF-36);
- расчеты с использованием математической статистики (динамику клинико-лабораторных данных рассчитывали с помощью критерия Фридмана для количественных показателей, для качественных показателей использовали критерий χ2 Пирсона).
Согласно дизайну проспективного наблюдательного исследования, на первом этапе были изучены данные клинико-лабораторного и инструментального обследования пациентов с ЦП различной этиологии с проведением психометрического теста связи чисел и выделением группы пациентов с МПЭ.
На втором этапе исследования у пациентов с ЦП и МПЭ были изучены клинико-лабораторные показатели, а также качество жизни через шесть месяцев при применении рифаксимина-α, оценены исходы заболевания (частота декомпенсации, нарастание ПЭ и др.) с выявлением предикторов (благоприятных и неблагоприятных) течения ЦП. На основании полученных результатов предполагается предложить алгоритм диагностики и лечения ЦП с МПЭ.
Результаты
Представлены результаты промежуточных данных по итогам шести месяцев наблюдения. Всего в исследование включено 72 пациента с МПЭ на фоне ЦП различной этиологии и степени тяжести по шкале Чайлда – Пью. В зависимости от схемы лечения МПЭ пациенты были рандомизированно разделены на группы: первая (n = 23; 32%) – постоянная терапия рифаксимином-α в дозе 1200 мг/сут, вторая (n = 23; 32%) – циклическая терапия рифаксимином-α в дозе 1200 мг/сут (курсами по семь дней каждого месяца), третья (n = 26; 36%) – без терапии рифаксимином-α.
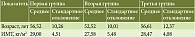
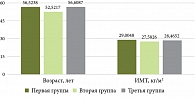
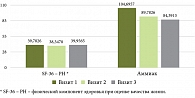
Пациенты трех групп были сопоставимы по возрасту и индексу массы тела (ИМТ): средний возраст пациентов в первой группе (постоянная терапия) составил 56,52 года, во второй группе (циклическая терапия) – 52,52 года, в третьей группе (отсутствие терапии рифаксимином-α) – 56,61 года. Средний ИМТ в группе постоянной терапии – 29 кг/м2, в группе циклической терапии – 27,58 кг/м2, в группе без терапии рифаксимином-α – 28,47 кг/м2 (табл. 1, рис. 1).
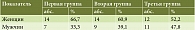
Количество женщин в группе постоянной терапии составило 14 (66,7%), в группе циклической терапии – 14 (60,9%), в группе пациентов, не получавших терапию рифаксимином-α, – 12 (52,2%). Количество мужчин в группе постоянной терапии – 7 (33,3%), в группе циклической терапии – 9 (39,1%) и в группе без терапии рифаксимином-α – 11 (47,8%) (табл. 2, рис. 2).
Далее представлена динамика показателей в исследуемых группах в течение шести месяцев. Стоит отметить, что при сравнении показателей по шкале Чайлда – Пью во всех трех группах значимых изменений выявлено не было.
Результаты психометрических тестов, оценки качества жизни в первой группе представлены в табл. 3. В результате оценки динамики показателей психометрических тестов, оценки качества жизни и уровня аммиака в первой группе (постоянная терапия) были получены достоверные различия только по аммиаку капиллярной крови.
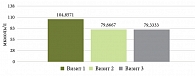
В течение трех визитов показатель аммиака достоверно снизился (р ≤ 0,001). На первом визите средний уровень аммиака составил 104,86 мкмоль/л, на втором – 79,67 мкмоль/л, на третьем визите – 79,33 мкмоль/л (рис. 3).
В результате оценки динамики показателей во второй группе (циклическая терапия) были получены достоверные различия по показателям аммиака и физическому компоненту здоровья при оценке качества жизни (табл. 4).
В течение трех визитов уровень аммиака достоверно снизился (р = 0,001). На первом визите средний уровень аммиака составил 104,70 мкмоль/л, на втором – 89,78 мкмоль/л, на третьем визите – 84,39 мкмоль/л. Показатель физического компонента здоровья при оценке качества жизни (SF-36 – PH) на втором визите снизился, а на третьем – вырос: на первом визите – 39,78 балла, на втором – 38,35 балла, на третьем визите – 39,96 балла (р = 0,009) (рис. 4).
В результате оценки динамики показателей в третьей группе (отсутствие терапии рифаксимином-α) были получены достоверные различия по показателям теста связи чисел, теста на наименование животных, а также психологического компонента здоровья при оценке качества жизни (табл. 5).
Показатель теста связи чисел достоверно повысился (p = 0,001): на первом визите – 49,52 секунды, на втором – 52,22 секунды, на третьем визите – 53,17 секунды. Показатель теста на наименование животных на втором визите повысился, а на третьем – снизился (p = 0,001), что указывает на некоторое улучшение в выполнении психометрического теста: на первом визите – 17,96 животных в минуту, на втором – 18,04 животных в минуту, на третьем визите – 16,78 животных в минуту. Показатель психологического компонента здоровья при оценке качества жизни (SF-36 – МН) достоверно снизился (p = 0,017): на первом визите – 44,04 балла,на втором – 42,30 балла, на третьем визите – 40,87 балла (рис. 5).
Обсуждение
В последнее время уделяется большое внимание терапии рифаксимином-α при ПЭ на фоне ЦП. Систематический обзор показал, что клиническая эффективность рифаксимина-α была эквивалентна дисахаридам или другим пероральным антибиотикам, но с лучшим профилем безопасности. По завершении протоколов лечения у пациентов, получающих рифаксимин-α, отмечены более низкий уровень аммиака в сыворотке крови, лучший психический статус по результатам психометрического тестирования и уменьшение астериксиса [13].
Согласно данным исследования, терапия рифаксимином-α способствует значительному улучшению как когнитивных функций, так и качества жизни у пациентов с МПЭ [14].
Длительную терапию рифаксимином-α ПЭ при ЦП также неоднократно изучали в различных исследованиях. По результатам исследований, шестимесячное лечение рифаксимином-α поддерживает ремиссию более эффективно, чем плацебо, снижая риск эпизода ПЭ и риск госпитализации [15].
Доказано, что долгосрочное лечение (≥ 24 месяцев) рифаксимином-α (1100 мг/сут: по 550 мг два раза в день) обеспечивает постоянное снижение уровня госпитализации, связанной с ПЭ и всеми причинами, без увеличения числа побочных эффектов [16].
В недавно опубликованном исследовании с участием 288 пациентов с ЦП и МПЭ оценивали влияние различных схем применения рифаксимина-α в течение 12 месяцев на клинические и лабораторные параметры, а также качество жизни пациентов данной категории. Было показано, что непрерывный режим рифаксимина-α у пациентов с ЦП и МПЭ в течение 12 месяцев превосходил циклическое использование с более выраженным влиянием на качество жизни пациентов и на симптомы, связанные с ПЭ [17]. Однако данных об оптимальном применении различных схем терапии рифаксимином-α при МПЭ на фоне ЦП недостаточно.
Результаты, полученные в нашем исследовании, показали, что у пациентов первой группы на фоне постоянной терапии рифаксимином-α в дозе 1200 мг/сут в течение шести месяцев было отмечено достоверное снижение уровня аммиака капиллярной крови (104,86 мкмоль/л на визите 1 в сравнении с 79,33 мкмоль/л на визите 3) (р ≤ 0,001). По результатам исследования, показатели оценки качества жизни и психометрических тестов в течение шести месяцев наблюдения не показали достоверных отличий.
В ходе наблюдения за пациентами второй группы на фоне циклической терапии рифаксимином-α в дозе 1200 мг/сут по семь дней каждого месяца получены данные о достоверном снижении уровня аммиака капиллярной крови (104,70 мкмоль/л на визите 1 в сравнении с 84,39 мкмоль/л на визите 3) (р = 0,001). Кроме того, выявлена достоверная положительная динамика по показателям физического компонента здоровья при оценке качества жизни (39,78 балла на визите в сравнении с 39,96 балла на визите 3) (р = 0,009).
В третьей группе на фоне отсутствия терапии рифаксимином-α были получены неоднозначные результаты по показателям психометрических тестов. В ходе наблюдения было отмечено увеличение времени выполнения теста связи чисел (49,52 секунды на визите 1 в сравнении с 53,17 секунды на визите 3). Однако при выполнении теста на наименование животных были получены противоположные результаты (17 животных в минуту на визите 1 в сравнении с 16 животными в минуту на визите 3). Показатель психологического компонента здоровья при оценке качества жизни по результатам анкеты SF-36 достоверно снизился (44,04 балла на визите 1 в сравнении с 40,87 балла на визите 3) (p = 0,017). Уровень аммиака капиллярной крови при этом почти не менялся – около 100 мкмоль/л.
Заключение
По итогам промежуточных результатов исследования (через шесть месяцев наблюдения) установлено, что в отсутствие терапии рифаксимином-α отмечается ухудшение качества жизни вследствие снижения показателей психического компонента здоровья, а также увеличение времени выполнения психометрического теста связи чисел; при этом сохраняется повышенный уровень аммиака.
На фоне постоянной и циклической терапии рифаксимином-α у пациентов с ЦП и МПЭ через шесть месяцев снижается уровень аммиака капиллярной крови. Однако при сравнении эффективности непрерывной и курсовой терапии рифаксимином-α результаты не показали существенных различий, что указывает на равноценность шестимесячного курса терапии с применением различных режимов приема рифаксимина-α.
В связи с тем что пациентам с ЦП требуется длительная терапия с целью профилактики прогрессирования заболевания, целесообразно продолжить дальнейшие исследования у пациентов с ЦП и МПЭ для представления об эффективности различных по длительности и режимам вариантов терапии рифаксимином-α.
Авторы заявляют об отсутствии конфликта интересов.
I.G. Bakulin, PhD, Prof., K.N. Ivanova, A.V. Abdrakhmanov
North-Western State Medical University named after I.I. Mechnikov, St. Petersburg
Contact person: Kristina N. Ivanova, napoleonovna20@gmail.com
Minimal hepatic encephalopathy (MHE) is the earliest and mildest form of hepatic encephalopathy (HE), however, its occurrence is associated with an unfavorable prognosis for cirrhosis in patients in this category.
MHE increases the number of falls, injuries, patients getting into road traffic accidents, and accidents, which has serious consequences for the quality of life, and also affects the increase in the frequency of hospitalizations and mortality in patients in this category.
Timely correction of cognitive impairment is the key to treating and reversing MHE, as well as improving the quality of life in patients with cirrhosis.
Objectives. To study the optimal regimens for the use of rifaximin-α and study its effect on the main clinical and laboratory parameters and quality of life of patients with MHE against the background of cirrhosis during long-term treatment.
Material and methods. Inclusion criteria: men and women from 18 to 75 years old; availability of CPU; presence of MHE; signed voluntary informed consent. Non-inclusion criteria: refusal to participate in the study; acute hepatitis; HIV co-infection; severe comorbid pathology; mental illness; Wilson – Konovalov disease.
Research methods: clinical examination (analysis of patient complaints, assessment of objective status); laboratory tests (ammonia levels); assessment of the severity of liver disease according to the Child – Pugh scale; assessment of the degree of HE based on the results of psychometric tests (number connection test, animal naming test, brief mental status scale); quality of life questionnaire (SF-36).
Results. In the absence of rifaximin-α therapy, there is a deterioration in the quality of life due to a decrease in indicators of the mental component of health, as well as an increase in time in performing the psychometric number connection test. Against the background of continuous and cyclic therapy with rifaximin-α in patients with cirrhosis and MHE during 6 months of observation, the level of capillary blood ammonia decreases.
Conclusions. When comparing the effectiveness of continuous and course therapy with rifaximin-α, the results did not show significant differences, which indicates the equivalence of these treatment regimens after 6 months of observations.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.