Неврологические осложнения сахарного диабета: синдром запястного канала
- Аннотация
- Статья
- Ссылки
- English
При СД широко распространены туннельные (компрессионные) невропатии, главным образом – синдром запястного канала (СЗК). На сегодняшний день основой его патогенеза признана модель двойного повреждения.
Исходя из клинических проявлений, выделяют три стадии СЗК. На ранних стадиях отмечаются характерные ночные боли и покалывания, локализующиеся преимущественно в дистальных отделах кисти и зоне иннервации срединного нерва. Позднее присоединяются скованность и неловкость в кисти в дневное время. При длительном течении – атрофия мышц тенара.
Диагноз СЗК ставится на основании клинических проявлений. Однако могут использоваться тесты и электронейромиография. Последняя позволяет определить тип невропатии (аксональная или демиелинизирующая), тяжесть процесса и исключить другие причины повреждения нерва.
Терапия СЗК при СД предполагает применение немедикаментозных, медикаментозных и хирургических методов в зависимости от стадии заболевания и выраженности симптомов. Наиболее простыми немедикаментозными способами лечения считаются иммобилизация кисти и изменение двигательного стереотипа. Фармакотерапия предусматривает назначение нестероидных противовоспалительных препаратов, антиконвульсантов и антидепрессантов, витаминов группы В и альфа-липоевой кислоты. В отсутствие эффекта показано оперативное вмешательство.
При СД широко распространены туннельные (компрессионные) невропатии, главным образом – синдром запястного канала (СЗК). На сегодняшний день основой его патогенеза признана модель двойного повреждения.
Исходя из клинических проявлений, выделяют три стадии СЗК. На ранних стадиях отмечаются характерные ночные боли и покалывания, локализующиеся преимущественно в дистальных отделах кисти и зоне иннервации срединного нерва. Позднее присоединяются скованность и неловкость в кисти в дневное время. При длительном течении – атрофия мышц тенара.
Диагноз СЗК ставится на основании клинических проявлений. Однако могут использоваться тесты и электронейромиография. Последняя позволяет определить тип невропатии (аксональная или демиелинизирующая), тяжесть процесса и исключить другие причины повреждения нерва.
Терапия СЗК при СД предполагает применение немедикаментозных, медикаментозных и хирургических методов в зависимости от стадии заболевания и выраженности симптомов. Наиболее простыми немедикаментозными способами лечения считаются иммобилизация кисти и изменение двигательного стереотипа. Фармакотерапия предусматривает назначение нестероидных противовоспалительных препаратов, антиконвульсантов и антидепрессантов, витаминов группы В и альфа-липоевой кислоты. В отсутствие эффекта показано оперативное вмешательство.
Введение
Сахарный диабет (СД) занимает седьмое место среди причин снижения качества жизни, в том числе вследствие неврологических осложнений [1]. К наиболее частым относится диабетическая невропатия (ДН). По некоторым данным, она встречается с частотой до 50% [2]. В масштабном исследовании EURODIAB диабетическая невропатия отмечалась у 28% больных СД [3]. Учитывая, что в мире насчитывается около 415 млн пациентов с СД, порядка 140 млн страдают ДН [4].
В 2011 г. Торонтская группа экспертов по диабетической невропатии представила обновленную классификацию, а также критерии диагностики и оценки тяжести заболевания [1, 5]. Согласно данной классификации выделяют генерализованные и фокальные/мультифокальные формы ДН. К первой относятся типичная дистальная сенсомоторная и атипичная сенсорная (острая, болевая) невропатии, ко второй – множественные мононевропатии, краниальные невропатии, туннельные невропатии и пояснично-грудная радикулопатия. При этом 80% случаев приходится на хроническую дистальную симметричную сенсорную и сенсомоторную полиневропатии [6].
Среди фокальных/мультифокальных невропатий чаще встречаются туннельные (компрессионные) невропатии, преимущественно синдром запястного канала (СЗК), или карпальный туннельный синдром.
Причиной СЗК являются сдавление и растяжение срединного нерва в остеофиброзном канале. Нерв располагается между поперечной связкой и костями запястья.
Заболевание может развиться на любой стадии СД и часто протекает бессимптомно.
Эпидемиология
Частота встречаемости СЗК в общей популяции составляет от 3 до 5%, риск развития в течение жизни может достигать 10% [7].
Среди пациентов с СД распространенность клинически выраженного СЗК, тем более асимптомного, выше. В Рочестерском исследовании таковой выявлен у 11 и 6% больных СД 1 и 2 типов соответственно [8]. В длительном наблюдательном Фремантльском исследовании с участием 1284 пациентов с СД частота встречаемости СЗК составила 5,5 случая на 1000 пациентов в год, что в 4,2 раза выше, чем в общей популяции [9]. По-видимому, существует и обратная зависимость, поскольку в ряде проспективных исследований у пациентов с СЗК зафиксировано повышение риска развития СД в два раза, у 80% больных – как минимум резистентность к инсулину [10, 11].
Распространенность СЗК среди больных СД варьируется от возраста, пола популяции, географии исследования, критериев диагностики и наличия у обследуемых факторов риска развития патологии.
B. Perkins и соавт. установили, что СЗК обусловлен симметричной дистальной сенсомоторной или сенсорной полиневропатией. Так, патология диагностирована у 14% пациентов с СД без полиневропатии и 30% больных СД с полиневропатией [12].
Более высокий риск развития СЗК в течение жизни зарегистрирован у лиц с СД 1 типа – после 54 лет болезни он увеличивается до 85% [13].
У пациентов с впервые выявленным СД патологию обнаруживали в 28% случаев, с длительным течением заболевания (в среднем 14,5 года) – в 63% [14, 15]. Эти данные позволили предположить, что риск развития СЗК в большей степени связан с продолжительностью СД, а не с возрастом пациентов.
Синдром запястного канала при СД, как и в общей популяции, чаще встречается у женщин. В исследовании с участием 146 пациентов с СД заболевание отмечалось в 39% случаев: у женщин – в 46%, у мужчин – в 28% [16].
Патогенез
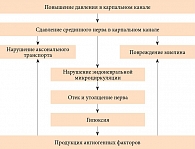
В настоящее время в основе патогенеза СЗК при СД рассматривается модель двойного повреждения (рисунок) [17, 18]. Вследствие гипергликемии поражаются периферические нервы, которые становятся более восприимчивыми к вторичному повреждению местными компрессионными факторами, такими как давление, деформация и/или растяжение [19].
Поражение периферических нервов и замедление репаративных процессов в нервных волокнах при СД связывают не только с гипергликемией, но и недостатком инсулина, С-пептида. Указанные нарушения приводят к каскаду метаболических и сосудистых изменений.
Одним из основных механизмов повреждения нервной системы считается активация полиолового пути утилизации глюкозы. В результате в нервной ткани накапливаются сорбитол, фруктоза, активируется протеинкиназа С, истощается мио-инозитол и угнетаются Na+-К+-АТФазы. Как следствие, внутринейрональная аккумуляция Na+, задержка жидкости, отек миелиновой оболочки, уменьшение числа глиальных клеток аксонов и в конечном итоге дегенерация периферических нервов.
Значительная роль отводится окислительному стрессу, при котором образуются свободные радикалы, способствующие эндоневральной гипоксии.
Возможно участие таких факторов, как эндотелиальная дисфункция, поражение артерий мелкого калибра, генетическая предрасположенность [20].
Описанные выше эндоневральные, периневральные метаболические и сосудистые нарушения приводят к функциональным и структурным изменениям периферических нервов, что повышает вероятность компрессии в анатомически узких каналах. Доказано, что при сгибании/разгибании руки в запястье в восемь – десять раз повышается давление в кистевом туннеле и растягивается нерв, что обусловливает снижение внутриневральной микроциркуляции, повреждение миелиновой оболочки, нарушение функции аксонов, а также дисплазию соединительнотканных структур [18].
Клиническая картина
На ранних стадиях заболевания могут возникнуть боль и неприятные сенсорные симптомы – покалывание в кисти. Боль и онемение чаще локализуются в дистальных отделах кисти, зоне иннервации срединного нерва (области большого, указательного и среднего пальцев, а также на радиальной поверхности безымянного пальца). Указанные симптомы, как правило, появляются в ночное время.
В дневное время пациенты жалуются на неловкость в руке при выполнении движений, требующих ее сгибания в запястье [21]. Чтобы уменьшить онемение и неловкость, больным достаточно встряхнуть кистью (симптом встряхивания, или щелчка) [22].
При СЗК, как правило, поражается доминантная рука, однако возможно и двустороннее поражение [16].
В случае поражения вегетативных волокон, входящих в состав срединного нерва, отмечаются вегетативно-трофические нарушения: изменение температуры кисти, чувствительности к холоду и расстройство потоотделения [23].
В зависимости от наличия тех или иных симптомов выделяют три стадии СЗК (таблица) [21].
У большинства пациентов симптомы локализуются не только в зоне иннервации срединного, но и в зоне иннервации локтевого нерва, а также в области кисти, предплечья, локтя, плеча и шеи [24].
У некоторых пациентов наблюдается атипичное течение – например, писчий спазм либо слабость и боль в области плеча, или предплечья, или среднего пальца руки [21].
Однако СЗК при СД часто протекает бессимптомно и выявляется только при проведении электронейромиографии. Во время скрининга патологию обнаруживают у 30–36% лиц с впервые диагностированным СД. Этот факт подтверждает, что поражение проксимального сегмента нерва и/или сенсорных волокон при ДН может уменьшать вероятность развития клинически выраженного СЗК [25].
Болевой синдром
Болевой синдром при любой этиологии СЗК отмечается в 52–85% случаев [26, 27]. При этом болезненными могут быть и парестезии. Установлено, что парестезии и боль при СЗК встречаются с одинаковой частотой – 88,4 и 84,5% случаев соответственно [27].
При СЗК интенсивность боли не зависит от выраженности электрофизиологических изменений, пола, возраста и длительности заболевания. Она связана главным образом с неправильным представлением пациента о боли, депрессией, а также с наличием нескольких дополнительных источников боли [28]. При сочетании СЗК с болевой формой диабетической полиневропатии (ДПН) интенсивность боли может повышаться.
Несмотря на часто описываемые в литературе признаки невропатической боли (аллодиния, гиперпатия, прострелы по типу ударов электрическим током), данные о частоте ее встречаемости при СЗК противоречивы.
M. Sonohata и соавт. достоверный невропатический компонент боли с помощью опросника Pain DETECT обнаружили только у 10,5% пациентов с СЗК, вероятный – у 20,3%. При этом положительный результат тестирования был связан с пароксизмальным характером боли в ночное время [29].
В другом исследовании (все участники жаловались на ночные приступы боли) невропатический компонент наблюдался у 92% пациентов с болевым синдромом, что представляется более вероятным [30].
Однако боль при СЗК обусловлена не только невропатическим, но и ноцицептивным компонентом. При проведении биопсии у пациентов с симптоматическим СЗК выявлена повышенная экспрессия простагландина Е2 и сосудистого эндотелиального фактора роста, приводящая к сосудистой пролиферации и фиброзу с образованием рубцовой ткани вокруг срединного нерва и, как следствие, его сдавлению. Одновременно прогрессируют тендосиновит и воспаление синовиальной ткани сухожилий сгибателей. Это приводит к повышению давления в карпальном канале [31].
Диагностика
Диагностика СЗК основывается на клинических проявлениях.
В отсутствие выраженных сенсорных и моторных феноменов большое значение отводится сбору анамнеза. Следует установить время появления симптомов (ночные парестезии), провоцирующие факторы (положение руки, повторяющиеся движения), профессиональную вредность (использование в работе вибрационных инструментов), факторы, облегчающие симптомы (встряхивание кисти, изменение ее положения), наличие нисходящей или восходящей иррадиации боли [32].
Для верификации диагноза используются следующие инструменты [33]:
тест Тинеля. Постукивание неврологическим молоточком по запястью со стороны ладони в месте прохождения срединного нерва вызывает покалывание в пальцах. Чувствительность данного теста составляет от 26 до 79%, специфичность – от 40 до 100%;
тест Фалена. Сгибание/разгибание кисти на 90 градусов (при прямом локте) в течение 60 секунд или менее приводит к онемению и парестезиям в зоне иннервации срединного нерва. Тест позволяет подтвердить диагноз в 67–83% случаев, его специфичность варьируется от 47 до 100%;
тест Палея и МакМерфи. Считается положительным, если давление в точке проекции срединного нерва (1–2 см проксимальнее сгиба запястья) приводит к появлению или усилению боли и парестезий. Чувствительность теста составляет 89%, специфичность – 45%.
Проведенная перекрестная оценка чувствительности симптомов, а также тестов продемонстрировала наибольшую диагностическую значимость ночных акропарестезий (96%) и теста Палея и МакМерфи (89%).
Точность диагноза повышается (0,86), если по результатам трех тестов получен положительный ответ и отмечаются ночные акропарестезии.
Если результаты трех тестов отрицательные, акропарестезии отсутствуют, вероятность СЗК крайне низкая (0,0068) [33].
Для определения степени тяжести синдрома и обусловленных им функциональных нарушений разработан Бостонский опросник (Boston Carpal Tunnel Questionnaire – BCTQ) [34]. Результаты, полученные с помощью опросника, коррелируют не только в отношении клинической картины, но и в отношении электрофизиологических изменений. На сегодняшний день Бостонский опросник признан надежным и чувствительным инструментом стандартизации тяжести процесса и оценки результатов лечения.
В ряде публикаций продемонстрирована валидность данного способа диагностики у пациентов с СЗК на фоне СД и сопутствующей ДПН [35].
Дифференциальную диагностику СЗК проводят с артритом карпо-метакарпального сустава большого пальца, шейной радикулопатией (особенно корешков С6 и С7), плечевой плексопатией, ДПН, невропатией проксимальных отделов срединного нерва и др. [21].
Электрофизиологические методы исследования проводящей функции нерва являются базисом диагностики компрессионных невропатий, в частности СЗК [36]. Оценка проводящей функции двигательных и чувствительных волокон срединного нерва позволяет подтвердить компрессионную невропатию, признаком которой служат локальные изменения проводимости пораженного нерва в анатомически узких каналах.
Считается, что для диагностики СЗК более значимы параметры сенсорного ответа. Сенсорные волокна срединного нерва имеют большую долю толстых миелинизированных волокон с высокой потребностью в энергии, что обусловливает их большую восприимчивость к ишемическому и метаболическому повреждению. Электронейромиография также помогает определить тип невропатии (аксональная или демиелинизирующая), тяжесть процесса и исключить другие патологии.
Особенности проведения электродиагностики СЗК описаны в монографии Американской ассоциации нервно-мышечной и электродиагностической медицины (American Association of Neuromuscular & Electrodiagnostic Medicine – AANEM) [36, 37].
Так, у пациентов с СД и СЗК в отличие от общей популяции больных СЗК во избежание ложноположительного результата не рекомендуется сравнивать значения амплитуд и латентностей ответов срединного нерва со среднепопуляционными нормами, поскольку ряд факторов (возраст, пол, диаметр большого пальца, системные заболевания, ожирение и др.) могут повлиять на точность исследования. Более корректно сравнивать показатели, полученные у одного и того же больного на разных участках срединного нерва, например в области запястного канала и на интактном участке срединного нерва.
У пациентов с СД при подозрении на СЗК и ДПН в обязательном порядке проводятся сравнительные исследования срединного, локтевого и лучевого нервов [36, 37].
В последнее время широко используются ультразвуковые методы исследования периферических нервов. Они обладают рядом преимуществ: неинвазивность, отсутствие противопоказаний, сокращение времени проведения и др. [38]. Основными признаками туннельной невропатии при ультразвуковом исследовании считаются локальное утолщение нерва и увеличение площади поперечного сечения в проксимальном направлении от места локализации сдавления. Диагностическая ценность и специфичность ультразвукового исследования превышают 85% [39]. Менее распространенными признаками заболевания являются гипоэхогенная структура, уплощение нерва в месте компрессии, увеличение числа одиночных или множественных фасцикул, а также повышение васкуляризации нерва [39].
Магнитно-резонансная томография позволяет исключить редкие причины СЗК, такие как гемангиома, остеомиелит и деформация костей, артропатия Шарко.
Недавно был внедрен метод магнитно-резонансной трактографии, позволяющий оценить тяжесть морфологических изменений и воспаления. Однако его доступность пока ограничена [40].
Лечение и профилактика
Лечение СЗК предполагает применение немедикаментозных, медикаментозных и хирургических методов в зависимости от стадии заболевания и выраженности симптомов. К сожалению, приходится констатировать, что за помощью пациенты обращаются уже при развернутой стадии заболевания, чаще всего с жалобой на болевой синдром или атрофию мышц тенара.
Среди немедикаментозных методов на первом месте стоит изменение двигательных стереотипов (избегание движений в кисти и подъема тяжестей). В помощь пациентам проводятся образовательные программы. Показана также иммобилизация области повреждения, что позволяет прекратить или ограничить физическое воздействие и уменьшить отек. Добиться иммобилизации в зоне повреждения помогают шины, ортезы, брейсы, лонгета для запястного сустава. Однако, несмотря на наличие рандомизированных контролируемых исследований (РКИ) с шинированием до восьми недель, уровень доказательности данного метода признан умеренным.
Обсуждаются также возможности лазеротерапии, чрескожной электронейростимуляции, фонофореза глюкокортикостероидами, акупунктуры, лечебной гимнастики [27].
Медикаментозная терапия предполагает воздействие на различные компоненты болевого синдрома: ноцицептивный, невропатический и в ряде случаев дисфункциональный. Для воздействия на ноцицептивный компонент боли, а также для уменьшения воспаления показаны нестероидные противовоспалительные препараты (НПВП). Однако данная, широко исследованная при других нозологиях группа лекарственных средств при СЗК недостаточно изучена с позиций доказательной медицины [27].
В этой связи представляет интерес исследование эффективности препарата мелоксикам. У пациентов с СЗК препарат применяли в течение десяти дней. На фоне проводимой терапии снизилась интенсивность боли, а также уровень субстанции Р – одного из основных медиаторов боли. При этом снижение отмечено в синовиальной оболочке сухожилий (параневрально), но не в адвентициальной оболочке срединного нерва, что подтверждает избирательность действия препарата в отношении ноцицептивного компонента боли [41].
На сегодняшний день зарегистрирован ряд биоэквивалентных аналогов мелоксикама, в том числе российский препарат Артрозан, который производится в инъекционной и таблетированной формах.
При выборе НПВП необходимо учитывать риск развития желудочно-кишечных и сердечно-сосудистых осложнений и принять меры для снижения таковых [42].
В случае выявления невропатического компонента боли также целесообразно назначение антиконвульсантов (габапентина (Конвалиса), прегабалина), антидепрессантов (венлафаксина, дулоксетина, амитриптилина) [43].
Применение данных средств будет оправданно для облегчения боли как при ДПН, так и при СЗК. Однако если при болевой форме ДПН применение указанных препаратов имеет высокий уровень доказательности, то при СЗК исследован только габапентин. Габапентин продемонстрировал эффективность в отношении купирования боли при СЗК как в низкой (300–600 мг/сут), так и в средней терапевтической (1800 мг/сут) дозе. Длительность наблюдения составила от двух до шести месяцев [44–47].
При назначении габапентина следует соблюдать схему титрации дозы и учитывать возможность развития преходящих побочных эффектов, таких как головокружение и сонливость.
В России помимо оригинального габапентина зарегистрированы его аналоги, например препарат Конвалис. В российском исследовании последний подтвердил свою эффективность у больных ДПН [48].
В качестве дополнительных методов лечения СЗК, развившегося на фоне ДПН, следует рассматривать препараты альфа-липоевой кислоты (Октолипен) и витаминов группы В (Комбилипен).
При ДПН назначение альфа-липоевой кислоты признано патогенетически обоснованным из-за способности препарата связывать свободные радикалы и таким образом предупреждать нейрососудистые нарушения [49].
Результаты метаанализа РКИ по применению альфа-липоевой кислоты 300–600 мг внутривенно в течение двух – четырех недель у пациентов с ДПН свидетельствуют, что такая терапия способствует не только уменьшению боли, но и повышению скорости проведения возбуждения по нервам [50].
Учитывая особенности патогенеза СЗК на фоне СД и описанные выше функциональные и структурные изменения нервов, использование альфа-липоевой кислоты (Октолипена) у таких больных оправданно.
Кроме того, в одном из РКИ продемонстрирована большая эффективность комбинации габапентина и альфа-липоевой кислоты по сравнению с плацебо и монотерапией указанными препаратами в отношении облегчения невропатической боли [51].
В другом РКИ у пациентов с болевой формой ДПН сравнивали эффекты комбинации «габапентин + витамины группы В» и прегабалина. Через 12 недель лечения уменьшение боли на 30% удалось достичь на 900 мг габапентина плюс 100 мг витамина В1/20 мг витамина В12 и 300 мг прегабалина. Был сделан вывод, что комбинация габапентина с витаминами группы В позволяет снизить дозы габапентина, что в свою очередь улучшает переносимость и приверженность терапии [52].
При воздействии на ноцицептивный компонент боли важно учитывать синергизм витаминов группы В и НПВП. Установлено, что в одних случаях данная комбинация позволяет добиться лучшего анальгетического эффекта, чем монотерапия НПВП, в других – эффективность комбинации и монотерапии сопоставима, однако при использовании комбинации требуется меньшая доза НПВП, что повышает безопасность лечения [53, 54].
Среди инвазивных методов лечения СЗК наиболее исследованным являются инъекции глюкокортикостероидов в область туннеля запястья. В отношении купирования боли и уменьшения симптомов их эффект превышает плацебо, местные анестетики и НПВП.
Использование ладонного доступа более эффективно, чем введение иглы в область запястья, а проведение процедуры под контролем ультразвукового исследования обеспечивает ее точность.
В одном РКИ показана эффективность локальных инъекций лидокаина [27].
В отсутствие значимого эффекта от консервативного лечения показано оперативное. Хирургическое лечение СЗК заключается в декомпрессии срединного нерва путем рассечения поперечной связки запястья. Операция может быть открытого доступа (как обширного, так и минимального) либо эндоскопическая. Эти два подхода значимо не различаются в отношении уменьшения выраженности клинических проявлений и улучшения функционального состояния кисти. Однако в недавнем исследовании продемонстрировано преимущество второго [55].
Данные об эффективности хирургической декомпрессии при СЗК вследствие СД и идиопатическом СЗК противоречивы. В ряде длительных проспективных наблюдений отмечено, что отдаленный эффект хирургического вмешательства у пациентов с СЗК и СД несколько ниже, чем в общей популяции [56]. В других исследованиях различий между группами по отдаленным результатам лечения не выявлено [57].
Профилактика СЗК при СД заключается прежде всего в контроле массы тела и гликемии. Пациенту также необходимо правильно организовать рабочее место, если его профессиональная деятельность предполагает повышенную нагрузку на запястье (работа за компьютером, повторяющиеся движения и т.д.) [21, 27].
Заключение
СЗК, развившийся вследствие СД, особенно при длительном течении и наличии ДПН, встречается достаточно часто. Поэтому от врача требуется настороженность в отношении этой патологии и назначение дополнительных диагностических тестов для ее выявления на ранней стадии. Это позволит ограничиться консервативными методами лечения.
O.S. Davydov, D.A. Tumurov
Scientific-Research Institute of General Pathology and Pathophysiology
Z.P. Solovyov Scientific Practical Psychoneurological Center
Contact person: Oleg Sergeyevich Davydov, oleg35_69@mail.ru
Diabetes mellitus (DM) is ranked the seventh in the world among the reasons for the quality of life reduction, particularly due to neurological complications.
In DM tunnel (compression) neuropathies are widely observed, mainly carpal tunnel syndrome (CTS). To date, the model of double damage is considered as the basis of its pathogenesis.
On the basis of clinical manifestations, there are three stages of CTS. In the early stages characteristic night pains and tingling are observed, localized predominantly in the distal parts of the hand and the area of innervation of the median nerve. Later stiffness and awkwardness appeared in the hand in the daytime. In the long – atrophy of the thenar muscles.
Usually the diagnosis of CTS is based on clinical manifestations. However, as well there may be used the tests and electroneuromyography. The latter allows to determine the type of neuropathy (axonal or demyelinating), the severity of the process and to exclude the other causes of nerve damage.
Therapy of CTS in DM involves the use of non-pharmacological, pharmacological and surgical methods, depending on the stage of the disease and severity of symptoms. Immobilization of the hand and changing movement patterns are the simplest non-pharmacological methods of treatment. Pharmacotherapy involves the use of non-steroidal anti-inflammatory drugs, anticonvulsants and antidepressants, B vitamins and alpha lipoic acid. Surgical intervention is recommended in the absence of the effect.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.