количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
Нейропротекция при заболеваниях заднего отрезка глаза у взрослых и детей
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Офтальмология" "№ 1 (30)
- Аннотация
- Статья
- Ссылки
В связи с высокой распространенностью заболеваний заднего отрезка глаза поиск их эффективного лечения приобретает особую актуальность. В последние годы широкое применение получила нейропротекторная терапия, по праву считающаяся перспективным направлением за счет патогенетически обоснованного механизма действия. Применение пептидных препаратов в офтальмологии, в том числе детской, позволяет активировать репаративные процессы и функциональное взаимодействие клеток сетчатки.
В рамках ХХ Юбилейного международного офтальмологического конгресса «Белые ночи» (Санкт-Петербург, 28 мая 2014 г.) состоялся сателлитный симпозиум «Офтальмонейропротекция заболеваний заднего отрезка глаза у взрослых и детей» под председательством профессора, заслуженного врача Российской Федерации, директора Московского научно-исследовательского института глазных болезней (МНИИ ГБ) им. Гельмгольца, главного офтальмолога Министерства здравоохранения Российской Федерации Владимира Владимировича Нероева и профессора, академика РАЕН и РАМТН, заведующего кафедрой офтальмологии лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова Евгения Алексеевича Егорова. В ходе симпозиума были заслушаны доклады ведущих специалистов в области офтальмологии – профессора Е.А. Егорова, профессора В.В. Бржеского, профессора А.Ф. Габдрахмановой, доцента, ведущего научного сотрудника отделения глаукомы МНИИ ГБ им. Гельмгольца Д.Н. Ловпаче, посвященные применению препаратов с нейропротекторными свойствами в лечении таких серьезных заболеваний, как глаукома, диабетическая ретинопатия, ретинопатия новорожденных.


Профессор В.В. Нероев

Профессор Е.А. Егоров

Рис. 1. Эффект пептидного каскада

К.м.н. Д.Н. Ловпаче

Профессор В.В. Бржеский

Профессор А.Ф. Габдрахманова
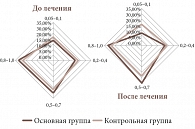
Рис. 2. Повышение остроты зрения на фоне применения Ретиналамина по сравнению с Эмоксипином
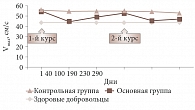
Рис. 3. Динамика максимальной линейной скорости кровотока в системе глазничной артерии

Рис. 4. Динамика максимальной линейной скорости кровотока в центральной артерии сетчатки
Открывая симпозиум, профессор Владимир Владимирович НЕРОЕВ обратился к участникам с приветственным словом, подчеркнув значение эффективной и качественной офтальмологической помощи населению во всех регионах нашей страны. Он отметил, что в системе оказания современной офтальмологической помощи имеются сложности, связанные, с одной стороны, с неравномерностью распределения ресурсов как по регионам, так и внутри региона, с другой – с их нерациональным использованием. Большинство проблем по-прежнему сосредоточено в первичном амбулаторном звене (недостатки материально-технической базы, отсутствие высококвалифицированных кадров на местах). В то же время В.В. Нероев констатировал, что процесс усовершенствования офтальмологической службы в России продолжается благодаря качественной работе специалистов, новым рекомендациям и научным разработкам. Он особо отметил важность внедрения современных методов лечения глазных заболеваний, являющихся основными причинами слепоты и слабовидения у взрослых и детей. В целях повышения эффективности, доступности и качества офтальмологической помощи ведущими фармацевтическими компаниями страны на основании инновационных научных подходов разрабатываются эффективные препараты для лечения патологии глаз.
Профессор В.В. Нероев от имени всех присутствовавших поблагодарил компанию ООО «ГЕРОФАРМ» за многолетний труд по разработке и выпуску российских инновационных препаратов для лечения социально значимых заболеваний, в том числе для эффективной нейропротекторной терапии заболеваний глаз, а также за большую работу по организации
симпозиума.
Нейропротекция в офтальмологии
Нейропротекция – комплекс терапевтических мероприятий, направленных на предотвращение, уменьшение, а в ряде случаев на обратимость процессов гибели нейрональных клеток. Ведущий лидер отечественной офтальмологии академик РАЕН, РАМТН, профессор Евгений Алексеевич ЕГОРОВ в своем докладе сравнил различные классы нейропротекторов и рассказал о перспективах применения нейропротекции в офтальмологической практике.
В настоящее время под нейропротекторной терапией глаукомы понимают мероприятия, направленные на предотвращение каскада реакций, приводящих к поражению нейронов сетчатки и зрительного нерва. Уменьшить скорость гибели ганглионарных клеток можно за счет снижения внутриглазного давления (ВГД), поддержания нормального кровоснабжения в головке зрительного нерва, оптимального функционирования клеток Мюллера, предотвращения гипоксического/ишемического повреждения в аксонах ганглионарных клеток, их чрезмерной деполяризации, глутаматной токсичности в ретинальных нейронах. В связи с этим лечение глаукомной оптической нейропатии предусматривает использование лекарственных препаратов для сохранения нейронов сетчатки, коррекции метаболизма, устранения или уменьшения гипоксии тканевых структур глаза, а также специализированную терапию сопутствующих заболеваний.
Становится очевидным, что фармакологические характеристики препаратов нейропротекторного действия должны иметь специфические точки приложения (рецепторы) в структурах сетчатки и проявлять активность с достоверной эффективностью в отношении ганглионарных клеток. Препарат должен достигать сетчатки в концентрациях, достаточных для получения нейропротекторного эффекта. В клинической практике нейропротекторная активность препаратов подтверждена в ходе рандомизированных контролируемых исследований, проводимых в соответствии с требованиями доказательной медицины.
Как известно, нейропротекторы в офтальмологической практике представлены препаратами прямого действия, которые непосредственно защищают нейроны сетчатки и волокна зрительного нерва за счет блокирования прямых факторов повреждения клеток, вызывающих увеличение концентрации продуктов перекисного окисления липидов (ПОЛ), свободных радикалов, ионов Са++, ацидоза. Это ингибиторы глутаматных рецепторов, блокаторы кальциевых каналов, антиоксиданты, препараты пептидной структуры (Ретиналамин, Кортексин, Семакс).
Условно выделяют и нейропротекторы непрямого действия, влияющие на различные патофизиологические нарушения (снижение перфузионного давления, изменение реологических свойств крови, ангиоспазм) и повышающие устойчивость различных функциональных систем к снижению содержания кислорода в тканях. Все они опосредованно оказывают защитное действие. Это как антиоксиданты, так и препараты, улучшающие микроциркуляцию, реологические свойства крови, снижающие уровень холестерина в крови.
Антиоксиданты предотвращают повреждение клеточных структур, вызванное окислительным стрессом. Они хорошо известны офтальмологам и находят широкое применение в лечении глаукомы. В частности, витамин Е (альфа-токоферол) – основной источник жирорастворимых антиоксидантов в клетках. Его использование уменьшает степень повреждения сетчатки. Перспективный препарат мелатонин обладает антиоксидантными свойствами и снижает степень глутаматной эксайтотоксичности.
Нифедипин и верапамил – блокаторы кальциевых каналов. Они активно применяются в терапевтической практике, прежде всего при сердечно-сосудистых заболеваниях. Однако эти препараты способны обеспечивать нейропротекцию за счет улучшения кровообращения в ганглионарном слое сетчатки. Они опосредованно нормализуют метаболизм глутамата, восстанавливая гомеостаз в диске зрительного нерва. Основным терапевтическим эффектом данных препаратов является расширение периферических, в основном артериальных сосудов, в том числе коронарных, и снижение артериального давления. На уровне зрительного анализатора это может приводить к снижению перфузии зрительного нерва и сетчатки и усугублять течение глаукомной оптиконейропатии1.
Между тем широко распространенными в офтальмологической практике считаются препараты прямого действия – офтальмонейропептиды (или пептидные биорегуляторы, цитомедины) – Ретиналамин и Кортексин. Они обладают способностью индуцировать процессы специфической дифференцировки в популяции клеток тканевых структур глаза и зрительного нерва, влияют на клеточный и гуморальный иммунитет, состояние системы гомеостаза и другие защитные реакции организма.
После введения пептидных препаратов (в конкретном органе) происходит выброс собственных эндогенных регуляторных пептидов, для которых введенный пептид является индуктором (эффект пептидного каскада) (рис. 1). Действие пептидного каскада заключается в пролонгации и активации уже собственного синтеза пептидов, который сохраняется даже после распада в процессе метаболизма введенного извне индуктора.
Нейротрофический эффект Ретиналамина в начальной и развитой стадии глаукомы выражается в достоверном увеличении средней толщины ретинальных нервных волокон. Результаты клинического исследования применения Ретиналамина при первичной открытоугольной глаукоме (ПОУГ) продемонстрировали у большинства пациентов:
- положительную динамику периферического зрения по показаниям пороговой чувствительности сетчатки;
- субъективное улучшение остроты зрения;
- достоверное объективное улучшение центрального зрения;
- положительную динамику психо- и электрофизиологических показателей;
- уменьшение количества и глубины скотом в характерных для глаукомы зонах;
- увеличение толерантности зрительного нерва к повышенной нагрузке2.
Механизм действия Ретиналамина основан на регуляции внутриклеточного белкового синтеза в клетках сетчатки и пигментного эпителия, активации репаративных процессов и функционального взаимодействия клеток. Препарат корректирует процессы метаболизма и предотвращает окислительный стресс и эксайтотоксичность, усиливает активность клеток Мюллера, обладает выраженным протекторным эффектом в отношении сосудистого эндотелия и предупреждает апоптоз, уменьшает деструктивные изменения в пигментном эпителии сетчатки при различных формах дегенерации, оказывает иммуномодулирующее действие. Фармакокинетика препарата показывает, что Ретиналамин накапливается в сетчатке. Время достижения максимальной концентрации составляет около двух часов, период полувыведения – два-три часа (рис. 1).
Эффективность и безопасность препарата Ретиналамин доказаны в многочисленных исследованиях. Так, у всех пациентов с I и III стадией глаукомы на фоне хроматической стимуляции (аппарат «Визотроник М3») и терапии с использованием Ретиналамина улучшились показатели остроты зрения, расширились поля зрения, достоверно снизился уровень ВГД3.
Исследования нейропротекторной эффективности Ретиналамина в лечении ПОУГ II и III стадии, проведенные на кафедре офтальмологии РНИМУ им. Н.И. Пирогова, показали положительную динамику критической частоты слияния мельканий у 76,4% больных. Положительная динамика электрофизиологических показателей выявлена у 84,7% пациентов.
Результаты десятидневного курса эндоназального электрофореза на аппарате «Поток-1» с применением Ретиналамина продемонстрировали его эффективность в лечении ПОУГ I и II стадии. После курса терапии установлено достоверное повышение остроты зрения и уменьшение абсолютных скотом в начальной и развитой стадии глаукомы (эффективность была выше в группе электрофореза с использованием Ретиналамина). Анализ структурных изменений зрительного нерва (НRT-II) выявил достоверное увеличение средней толщины ретинальных нервных волокон у пациентов, применявших в комплексной терапии Ретиналамин в начальной и развитой стадии глаукомы.
Исследования терапевтической эффективности и безопасности препарата Ретиналамин при миопической болезни продемонстрировали положительное влияние препарата на функциональную активность нейронов внутреннего ядерного слоя периферических и центральных отделов сетчатки, а также фоторецепторов макулярной области. Доказано, что средний дефект центральной пороговой световой чувствительности снижается статистически достоверно и остается стабильно сниженным до окончания исследования4.
Таким образом, клинически доказано, что терапия Ретиналамином способствует повышению светочувствительности сетчатки и снижению уровня среднего дефекта центральной пороговой световой чувствительности, субъективному улучшению зрения вдаль и вблизи.
С марта 2014 г. Ретиналамин выпускается в новой удобной упаковке с более высокой степенью защиты от фальсификата.
В заключение профессор Е.А. Егоров подчеркнул эффективность применения Ретиналамина в повседневной офтальмологической практике и значимость нейропротекторной терапии, в том числе за счет поиска новых технологий, направленных на адресную доставку лекарственных средств к заднему полюсу глаза. Он особо отметил, что, несмотря на все усилия зарубежных производителей, таких ретинопротекторов для лечения патологии глаза, как Ретиналамин, нет в клинической практике других стран.
Актуальность нейропротекции при глаукоме: вопросы и ответы
В начале своего выступления к.м.н., доцент, ведущий научный сотрудник отделения глаукомы МНИИ ГБ им. Гельмгольца Джамиля Нурийтдиновна ЛОВПАЧЕ подчеркнула, что нейропротекция должна осуществляться, пока поражение нервной ткани не стало необратимым. Терапевтические мероприятия необходимо проводить сразу после постановки диагноза ПОУГ.
Глаукома – хроническое заболевание глаз, характеризующееся повышением ВГД, развитием оптической нейропатии и нарушениями зрительной функции. Глаукома сопровождается трофическими нарушениями в сетчатке и зрительном нерве. Идеальная терапия по нейропротекции и сохранению зрительных функций может эффективно проводиться только на фоне нормализованного ВГД. Д.Н. Ловпаче отметила, что повышенное ВГД является ведущим, но не единственным фактором риска возникновения глаукоматозных изменений. По данным ряда зарубежных и отечественных исследований, эффективное снижение ВГД не может служить гарантией стабилизации глаукомного процесса, который продолжает прогрессировать у части больных5–8. В связи с этим особенно актуально своевременное назначение препаратов нейропротекторного действия. Назначаемые нейропротекторы должны соответствовать следующим критериям:
- иметь специфические точки приложения (рецепторы) в структурах сетчатки;
- проявлять нейропротекторную активность с достоверной эффективностью в отношении ганглионарных клеток сетчатки;
- достигать сетчатки в терапевтически значимых концентрациях;
- обладать доказательной базой, полученной в результате рандомизированных контролируемых клинических исследований.
От других современных методов лечения терапию с применением пептидных препаратов отличают адресность, патогенетическая обоснованность и тканеспецифическое действие, характеризующееся нормализацией функции того органа, для которого предназначены эти полипептиды.
В частности, подтверждено, что препарат Ретиналамин способен стимулировать нейрональную дифференцировку клеток и восстановление утраченных связей за счет новых элементов и тем самым обеспечивать регенерацию сетчатки. Ретиналамин оказывает защитный эффект – снижает гибель клеток до 50% (p < 0,05 по сравнению с группой контроля).
Назначение препарата Ретиналамин в комплексном лечении глаукомы обеспечивает высокий терапевтический эффект и стабилизацию зрительных функций. При изучении морфологических параметров сетчатки на фоне циркуляторной гипоксии выявлены существенное уменьшение толщины пигментного слоя с участками полного истончения и незначительные зоны пролиферации. На фоне применения Ретиналамина сохранение клеточных элементов сетчатки (пигментного эпителия и внутреннего ядерного слоя) более выражено. У пациентов, применявших Ретиналамин, впервые были выявлены неизмененные нейроны9.
Завершая выступление, Д.Н. Ловпаче отметила: «Клинические результаты убеждают нас в том, что нейропротекторная терапия глаукомы в ближайшие годы станет основополагающей в лечении этого тяжелого заболевания».
Применение пептидных препаратов в детской офтальмологии
Профессор, заведующий кафедрой офтальмологии Санкт-Петербургского государственного педиатрического медицинского университета Владимир Всеволодович БРЖЕСКИЙ остановился на лечебных свойствах пептидных препаратов. Он подробно рассмотрел свойства Ретиналамина и Кортексина.
Доказано, что Ретиналамин нормализует метаболизм в сетчатке глаза, стимулирует функции и регенерацию клеток сетчатки, улучшает функциональное взаимодействие нейроэпителия и пигментного эпителия, усиливает активность ретинальных макрофагов. Кроме того, он обладает протекторным эффектом в отношении эндотелия сосудов, оказывает опосредованное церебропротекторное и ноотропное действие.
Кортексин обладает тропным действием в отношении коры головного мозга и регулирует процессы метаболизма в нейронах коры головного мозга, зрительном нерве и нейронах сетчатки. Кортексин запускает механизмы регенерации в страдающих, поврежденных волокнах зрительного нерва, применяется в комплексном лечении больных хориоретинальными дистрофиями и атрофиями зрительного нерва в качестве нейропротекторной терапии. Кортексин для лечения глаукомной оптической нейропатии, диабетической ретинопатии у взрослых больных целесообразно применять совместно с Ретиналамином10.
Заболевания сетчатки и зрительного нерва – наиболее распространенная патология у детей. Ретиналамин в детской офтальмологии показан при заболеваниях и повреждениях сетчатки, частичной атрофии зрительного нерва, амблиопии и миопии. Он используется в качестве эффективной терапии при абиотрофии и контузии сетчатки, ретинопатии недоношенных, врожденной миопии.
Прогрессирование миопии приводит к развитию дистрофических изменений в сетчатке и значительному снижению зрения у детей. У детей с миопией нарастает атрофия световоспринимающих клеток сетчатки, следствием чего является снижение зрения, усиливающееся по мере развития изменений на глазном дне.
Абиотрофии – это дистрофии, связанные с преимущественным поражением нейрорецепторов, пигментного эпителия или ганглионарных клеток сетчатки.
Анализ результатов применения Ретиналамина в комплексном лечении врожденной миопии и тапеторетинальной абиотрофии сетчатки у детей показал, что препарат значительно повышает зрительные функции, улучшает электрофизиологические характеристики сетчатки, гемодинамические показатели, расширяет поля зрения.
В лечении ретинопатии недоношенных одним из наиболее эффективных препаратов с патогенетической направленностью действия признан Ретиналамин, поскольку он повышает функциональную ретинальную активность в результате регенерации нейрорецепторного аппарата глаза и способствует достижению лучшей реабилитации после лазерного воздействия на сетчатку. Ретиналамин при пороговой III стадии активной ретинопатии недоношенных оказывает выраженное ангиопротекторное действие, приводит к стабилизации патологического процесса с последующим регрессом заболевания11.
Выявлено положительное влияние Ретиналамина на течение миопии у пациентов с компьютерным зрительным синдромом. Отмечено купирование клинических признаков компьютерного зрительного синдрома в 66% случаев и снижение их выраженности в 29,7%, увеличение некорригированной и корригированной остроты зрения и повышение резервов аккомодации12.
Таким образом, Ретиналамин стабилизирует процесс при многих заболеваниях сетчатки, что заметно отодвигает начало инвалидизации. Эффективность Ретиналамина при офтальмологических патологиях у детей позволяет рекомендовать его для постоянного использования в составе комплексной терапии.
Дальнейшие перспективы применения пептидных препаратов в детской офтальмологии, по мнению докладчика, нейроретинопротекция при врожденной глаукоме, комплексное лечение ретинопатии недоношенных, нейроретинопротекция в офтальмотравматологии. Изучается эффективность нейропротекторной терапии в комплексном лечении периферических хориоретинальных дистрофий у детей. Актуально совершенствование неинвазивных, эффективных способов доставки лекарственных средств в пораженный орган, особенно при заболеваниях заднего отрезка глаза у детей.
Новые подходы к оценке ретинопротекторной терапии непролиферативной диабетической ретинопатии
Рассмотрению этой проблемы посвятила свое выступление профессор кафедры офтальмологии с курсом ИПО ГБОУ ВПО «Башкирский государственный медицинский университет» Минздрава России Аныя Фавзиевна ГАБДРАХМАНОВА.
Диабетическая ретинопатия – позднее неспецифическое сосудистое осложнение сахарного диабета, в основе которого лежит микроангиопатия сосудов клетчатки глаза. Диабетическая ретинопатия проявляется геморрагиями, микроаневризмами, неравномерностью калибра сосудов сетчатки, отеком, отслоением сетчатки, образованием твердого и мягкого экссудата, ишемических зон, неоваскуляризацией сетчатки и/или диска зрительного нерва, неоваскулярной глаукомой, гемофтальмами, разрастанием соединительной ткани.
Общие методы лечения диабетической ретинопатии направлены на максимальную компенсацию сахарного диабета с тщательным гликемическим контролем, а также на жесткий контроль артериального давления и коррекцию липидного обмена. Для восстановления и поддержания ретинального гомеостаза и предупреждения прогрессирования проводится консервативная терапия с применением ангио- и ретинопротекторов, витаминов, антиоксидантов и сосудорасширяющих препаратов, где особое место занимает отечественный препарат Ретиналамин.
В исследовании участвовали 60 пациентов с сахарным диабетом (12 мужчин, 48 женщин) в возрасте 25–55 лет. Длительность заболевания – от одного года до пяти лет. Все пациенты были разделены на две группы – основную и контрольную. В обеих группах проводили комплексное медикаментозное лечение, включавшее прием витамина В6 1,0 внутримышечно № 10, витамина В12 1,0 внутримышечно № 10 и пентоксифиллина в дозе 1,0 внутривенно № 10. В основной группе к этой терапии добавили Ретиналамин по 0,5 мл парабульбарно № 10, а в контрольной – эмоксипин по 0,5 мл парабульбарно № 10. Второй курс лечения проводили через шесть месяцев. Исследование зрительных вызванных корковых потенциалов проводили для получения объективной оценки функционального состояния сетчатки, зрительного нерва, зрительных путей и коркового анализатора.
В ходе работы отмечено повышение остроты зрения в основной группе на 19,5% и в контрольной на 8,6% (рис. 2). Наблюдалось расширение суммарных границ поля зрения в основной группе – 25% глаз и контрольной – 10% глаз, улучшились показатели зрительного потенциала. Целенаправленно при этой патологии определяли динамику кровотока глазничной артерии и центральной артерии сетчатки спустя месяц после первого курса лечения, через три и шесть месяцев после первого и второго курса лечения.
Через месяц после первого курса лечения отмечалось снижение основных гемодинамических параметров, кроме пульсационного индекса плазмы артерии. Во всех случаях использования Ретиналамина у пациентов основной группы по сравнению с контрольной наблюдались достоверное улучшение параметров регионарной гемодинамики и положительный клинический эффект. Ретиналамин улучшал гемодинамические показатели максимальной линейной скорости кровотока в системе глазничной артерии и центральной артерии сетчатки (рис. 3 и 4). На протяжении трех – шести месяцев показатели кровотока в основной группе оставались стабильными. После второго курса Ретиналамина в основной группе сохранялись стабильные показатели гемодинамики. При оценке глазного дна отмечалось полное и/или частичное рассасывание гема- и плазморрагий в основной группе в 25% случаев, в контрольной – в 17%.
Таким образом, применение Ретиналамина в комплексной терапии позволяет уменьшить проявления фоновой диабетической ретинопатии, в значительной степени снизить риск перехода заболевания в пролиферативную стадию.
Офтальмонейропротекция с использованием Ретиналамина при непролиферативной диабетической ретинопатии обеспечивает улучшение функциональных и электрофизиологических параметров, нормализацию регионарной гемодинамики глаза. Своевременно начатое нейропротективное лечение позволяет сохранить зрительные функции и отсрочить развитие пролиферативной диабетической ретинопатии. Профессор А.Ф. Габдрахманова отметила, что главная цель офтальмологов – снизить процент инвалидизации, риск прогрессирования диабетической ретинопатии и улучшить качество жизни больных сахарным диабетом. Поиск способов эффективной профилактики слепоты на фоне диабета продолжается.
Заключение
Нейропротекторная терапия является перспективным методом лечения пациентов с различными патологиями глаза. Назначение современного препарата Ретиналамин с адресным, патогенетически обоснованным эффективным лечебным действием в комплексной терапии ряда офтальмологических заболеваний обеспечивает сохранение ганглионарных клеток и волокон зрительного нерва и стабилизацию зрительных функций. Согласно результатам исследований Ретиналамин позволяет увеличивать период трудоспособности, снижает процент инвалидизации, повышает качество жизни пациентов.
1. Caprioli J. Neuroprotection of the optic nerve in glaucoma // Acta Ophthalmol. Scand. 1997. Vol. 75. № 4. P. 364–367.
2. Максимов И.Б., Нероев В.В. Ретиналамин. Нейропротекция в офтальмологии. СПб.: Наука, 2007.
3. Жаров В.В., Лялин А.Н., Бутолина О.Е. и др. Активация фармакодинамики препарата Ретиналамин методом оптической кинезиотерапии при глаукоме // Русский медицинский журнал. 2013. № 4. С. 166–168.
4. Егоров Е.А., Сарыгина О.И., Зайцева О.В. и др. Терапевтическая эффективность и безопасность препарата Ретиналамин® при миопической болезни. Результаты клинического исследования // Российский офтальмологический журнал. 2012. № 4.
5. Ederer F., Gaasterland D.E., Sullivan E.K. et al. The Advanced Glaucoma Intervention Study (AGIS): 1. Study design and methods and baseline characteristics of study patients // Control. Clin. Trials. 1994. 15. № 4. P. 299–325.
6. Sommer A. Collaborative normal-tension glaucoma study // Am. J. Ophthalmol. 1999. Vol. 128. № 6. P. 776–777.
7. The advanced glaucoma intervention study, 6: Effect of cataract on visual field and visual acuity. The AGIS Investigators // Arch. Ophthalmol. 2000. Vol. 118. № 12. P. 1639–1652.
8. Lichter P.R., Musch D.C., Gillespie B.W. et al. Interim clinical outcomes in the Collaborative Initial Glaucoma Treatment Study comparing initial treatment randomized to medications or surgery // Ophthalmology. 2001. Vol. 108. № 11. P. 1943–1953.
9. Ставицкая Т.В., Егоров Е.А., Топчиева Г.В. и др. Сравнение ретинопротекторных свойств ретиналамина и эмоксипина // Клиническая офтальмология. 2004. Т. 5. № 3. С. 13–14.
10. Хавинсон В.Х., Хокканен В.М., Трофимова С.В. Пептидные биорегуляторы в лечении диабетической ретинопатии. СПб.: ИКФ Фолиант, 1999.
11. Пшеничнова О.В., Заболоцкая Е.А., Ишанова Н.Л. Ретиналамин в комплексном лечении детей с врожденной патологией сетчатки // Terra Medica Nova. 2008. № 5. C. 5–7.
12. Александрова Н.Н., Колбенев И.О., Еременко К.Ю. Миопия и компьютерный зрительный синдром у детей // Ретиналамин: нейропротекция в офтальмологии. СПб., 2007.
Новости на тему
21.09.2023
09.09.2022 01:00:00
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.