NB




Герпесвирусная инфекция широко распространена в человеческой популяции, поскольку вирусы этой группы пантропны и способны поражать многие системы и органы человека. Восприимчивость человека к вирусам герпеса высока. Около 90% всего населения планеты инфицированы одним или несколькими серотипами семейства герпесвирусов. По данным разных исследователей, от 12 до 25% носителей страдают рецидивирующими формами герпесвирусной инфекции, у 30% из них обнаруживается атипичная или бессимптомная форма заболевания [1, 2, 3].
Анализ ежегодной заболеваемости в России показал: 15% населения страдают герпетическим поражением кожи и слизистых, при этом у 10% встречается генитальная форма заболевания. Герпетические инфекции как этиологический фактор выявляются в 60–65% при поражении роговицы глаза, в 10% случаев – при заболеваниях нервной системы (менингиты, энцефалиты). По данным некоторых исследователей, в России ежегодно различными формами герпесвирусной инфекции заболевают около 20 млн человек [4, 5].
Одной из распространенных форм простого герпеса является генитальный герпес, частота которого достигает 6–10% среди взрослого населения [1, 6], а в целом по России – до 20% [4]. Показатель заболеваемости генитальным герпесом в Москве увеличился в 6 раз, в Московской области – в 2 раза (по сравнению с 2000 г.). Эти данные являются приблизительными, поскольку отсутствует обязательная регистрация случаев заболеваемости простым герпесом.
Исследование патогенеза простого герпеса показало, что инфекция включает острый или субклинический первый эпизод, установление латентного состояния вируса и последующую реактивацию. Вирус простого герпеса (ВПГ) попадает в организм через кожу или слизистые оболочки путем прямого контакта с биологическими жидкостями или поверхностью слизистой оболочки зараженного человека. Показано, что заражение может происходить от инфицированного пациента как при наличии симптомов заболевания, так и при их отсутствии. Вирус простого герпеса распространяется в тканях из-за способности заражать соседние клетки напрямую через клеточные контакты [7], что позволяет ему избежать воздействия внеклеточных факторов, включающих антитела и систему комплемента. Такой способ инфицирования, характерный для эпителиальных тканей, предполагает наличие гликопротеинов gE и gI [8]. Во время рецидива герпесвирусной инфекции в материале из очагов поражения находят зрелые вирионы с дополнительными мембранными слоями, а у больных со спокойным клиническим течением заболевания чаще всего выявляются незрелые формы (капсиды и нуклеокапсиды).
Взаимодействие между вирусом и организмом человека является решающим этапом в развитии герпесвирусной инфекции. Для подавления иммунной защиты вирус использует различные механизмы. Первой линией защиты являются факторы естественного иммунного ответа (клетки моноцитарно-макрофагального ряда, естественные киллеры). Эта система защиты вступает в действие с первых дней контакта с вирусными антигенами. Естественные киллеры (NK-клетки) относятся к важным факторам естественной врожденной резистентности. Для реализации цитотоксической реакции NK-клеткам не требуется распознавать специфические антигены. Это одно из преимуществ быстрого цитолиза, осуществляемого NK-клетками по отношению к ВПГ-инфицированным мишеням. Кроме того, продукция альфа- и бета-интерферонов приводит чувствительные клетки в состояние резистентности к ВПГ, под их влиянием усиливается функция макрофагов и естественных киллеров, в результате разрушаются вирус-инфицированные клетки. В ходе эволюции вирус выработал различные механизмы модуляции активности NK-клеток: блокирование лигандов (NKG2D) для активирующих рецепторов, синтез гомологов цитокинов человека, взаимодействие вирусных белков с ингибирующими рецепторами NK-клеток [9, 10, 11].
Лечение пациентов с рецидивирующим простым герпесом представляет определенные трудности из-за способности вируса простого герпеса к длительному персистированию, часто рецидивирующему течению, что приводит к снижению противовирусной иммунной защиты. Исследование механизмов репликации вируса простого герпеса, изучение взаимодействия вируса с клетками-мишенями позволило за последние 30 лет создать целый ряд химиотерапевтических препаратов, обладающих противогерпетической активностью [3, 12, 13, 14].
Клинический опыт их применения показал, что они способны быстро и эффективно купировать острые проявления простого герпеса, но не предотвращают развитие рецидивов хронической герпесвирусной инфекции и не снижают их частоту [15]. Именно поэтому актуальной задачей остается изучение механизмов функционирования иммунной и цитокиновой системы при рецидивирующей герпесвирусной инфекции и поиск новых препаратов с противовирусной и иммуномодулирующей активностью для лечения этого заболевания.
Целью настоящего исследования стало определение клинической эффективности стандартной и альтернативной противовирусной терапии пациентов с хронической рецидивирующей герпесвирусной инфекцией (ХРГВИ).
Материалы и методы
Исследование проводилось открытым методом у 60 пациентов с ХРГВИ. В состав исследуемых включались пациенты (возрастной интервал от 18 до 65 лет) мужского и женского пола с установленным диагнозом «ХРГВИ, генитальная форма». Все пациенты, включенные в исследование, находились в периоде продрома или обострения не более 48 часов от момента появления высыпаний. К исследованию не допускались пациенты с некомпенсированными заболеваниями сердечно-сосудистой, эндокринной, желудочно-кишечной, нервной систем, которые могли повлиять на результаты исследований, беременные и кормящие женщины. Условием включения для женщин детородного возраста было соблюдение полноценной контрацепции. Пациенты, вошедшие в изучаемые группы, отбирались методом произвольной выборки при поступлении на амбулаторное лечение. На предварительном этапе были сформированы две группы пациентов по 30 человек. Клиническими проявлениями простого герпеса у пациентов были пузырьковые или эрозивные высыпания в области гениталий, субъективные симптомы – болезненность, зуд, жжение. Верификация ВПГ 1, 2 типа проводилась методом ПЦР мазка из области высыпаний, положительный результат был получен в 95% случаев.
Дозировка и схемы введения
В основной группе (n = 30) терапия проводилась препаратом Аллокин-альфа по следующей схеме: 3 подкожные инъекции препарата в дозе 1 мг с интервалом 48 часов. Курсовая доза составляла соответственно 3 мг. Аллокин-альфа – коммерческое название лекарственной формы аллоферона – синтетического линейного олигополипептида, который относится к индукторам синтеза интерферона и активаторам системы натуральных киллеров, обладает противовирусной активностью в экспериментальных моделях различных инфекций, в частности вызванных вирусом простого герпеса. Важной характеристикой данного препарата является способность селективно стимулировать активность факторов естественного иммунитета. Препарат действует только в очаге вирусной инфекции, не активируя весь каскад иммунологических реакций организма.
Дополнительно все пациенты получали стандартную противовирусную терапию: Ацикловир 0,2 г 5 раз в день в течение 7 дней.
В контрольной группе пациентов (n = 30) проводилось лечение только ациклическими нуклеозидами: Ацикловир 0,2 г 5 раз в день в течение 7 дней.
Обследование проводилось до приема препарата (0-й день), на 7-й день от начала приема препарата и через 6 месяцев после окончания приема препарата. Обследование включало общеклиническое, объективное исследование области высыпаний и иммунологическое исследование крови. Перед началом приема препарата собирался подробный анамнез пациента.
При оценке клинической эффективности проведенного лечения использовали 3 основных критерия.
Оценка влияния терапии на иммунопатогенез герпесвирусной инфекции проводилась по следующим критериям:
Метод определения функциональной активности NK-клеток основан на их способности лизировать как чужеродные в антигенном отношении (опухолевые и неопухолевые клетки), так и нормальные клетки человека и животных при нарушении их дифференцировки без предварительной сенсибилизации.
Цитокиновый профиль оценивали методом ОТ-ПЦР (определение активности мРНК цитокинов в мононуклеарах периферической крови методом обратной транскрипции и полимеразной цепной реакции).
Результаты и обсуждение
Основные критерии оценки клинической эффективности стандартной (Ацикловир) и альтернативной (Аллокин-альфа) противовирусной терапии больных простым герпесом отражены в таблице 1. Это частота, длительность и степень тяжести рецидивов.
Все клинические показатели достоверно улучшились только у пациентов, леченных препаратом Аллокин-альфа. Так, частота рецидивов простого герпеса в течение полугода в первой группе сократилась с 6,3 до 2,8 случаев, во второй – с 6,0 до 5,6, при этом длительность рецидивов на фоне терапии Аллокином-альфа уменьшилась практически в 2 раза. Положительные изменения на фоне лечения Ацикловиром оказались статистически незначимыми.
Наше исследование показало, что до терапии ни в одной из групп не наблюдалось корреляционной связи между частотой, длительностью и тяжестью течения рецидивов. У пациентов, получавших комбинацию Аллокина-альфа с Ацикловиром, после лечения была выявлена прямая связь между частотой и длительностью рецидивов, между длительностью и тяжестью течения рецидивов, а также между частотой и тяжестью течения рецидивов. В первой группе отмечено достоверное снижение тяжести рецидивов. У пациентов, которым проведена монотерапия Ацикловиром, аналогичных взаимосвязей не отмечено.
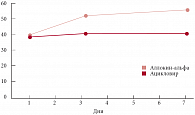
Изучение динамики NK-активности при лечении Аллокином-альфа показало, что на 3-и и 7-е сутки рецидива простого герпеса наблюдался плавный рост NK-активности с 39% до 52% и 57% соответственно (рис. 1). Аналогичных изменений при лечении Ацикловиром отмечено не было.
Выявлена прямая корреляция между изменениями показателей NK-активности до и после лечения Аллокином-альфа и тяжестью течения рецидивов, то есть более глубокий уровень снижения показателей NK-активности во время лечения сопровождался более тяжелым течением рецидива заболевания.
Полученные нами данные сопоставимы с результатами других исследователей [4, 10]. В первой фазе иммунного ответа наблюдается продукция интерферона и активация натуральных киллеров. NK-клетки выполняют роль первого барьера инфекции и вырабатываются в первые 24 часа после антигенной стимуляции до момента образования специфических антител и цитотоксических лимфоцитов. Помимо высокой цитотоксической активности NK-клетки обладают способностью продуцировать лимфокины (интерферон-гамма) и цитокины (фактор некроза опухоли) и таким образом контролировать дифференцировку клеток. У больных с рецидивирующим простым герпесом активность NK-клеток снижается во время рецидива и восстанавливается в период ремиссии. При низкой цитотоксической активности NK-клеток организм более чувствителен к ВПГ [8].
Содержание NK-клеток в периферической крови здоровых людей составляет в среднем 15%. При этом важное значение имеет не только количественное содержание, но и функциональная активность натуральных киллеров. В исследованиях обнаружено снижение цитотоксической активности NK-клеток примерно у 60% больных с манифестными формами простого герпеса и показана тенденция к снижению цитотоксичности в среднем за 7 дней до очередного рецидива и последующее ее повышение в острый период герпетической инфекции [1, 8]. Учитывая многообразие функций противовирусной защиты NK-клеток, мы считаем, что снижение функциональной активности NK-клеток, с одной стороны, является следствием неполноценности клеточного иммунитета, с другой – характеризует недостаточность функций самих лимфоцитов и может служить причиной вторичного иммунодефицита, лежащего в основе реактивации вируса простого герпеса.
Изучению системы интерферонов при герпесвирусной инфекции посвящено большое количество работ, которые показали, что роль интерферонов в формировании противогерпетического иммунитета не ограничивается подавлением репродукции вируса или санацией организма от его активных форм, но и проявляется в регуляции защитных реакций, в частности, усиления цитотоксичности NK-клеток [9, 10, 12]. Определение уровня альфа- и гамма-интерферона дает информацию о потенциальной активности интерфероновой системы.
В нашем исследовании до начала лечения показатели интерферонового статуса у всех больных простым герпесом были снижены, в основном за счет индуцированной альфа- и гамма-фракции интерферона. При этом уровень сывороточного интерферона был повышен, что свидетельствует об активности воспалительного процесса.
После лечения у больных, принимавших Аллокин-альфа, достоверно повысился уровень индуцированного альфа- и гамма-интерферона. Положительная разница показателей составила при лечении Аллокином-альфа 122,7 и 52,3 Ед/мл соответственно. При монотерапии Ацикловиром разница показателей была минимальной и недостоверной – 29,3 и 2,1 Ед/мл соответственно (табл. 2). Полученные данные позволяют считать, что высокая частота рецидивов простого герпеса способствует истощению синтеза эндогенного интерферона. Соответственно, таким пациентам следует рекомендовать прием препаратов, индуцирующих выработку интерферона.
Согласно полученным данным, у больных с синдромом интерферонового дефицита отсутствует индукция противовирусного ответа клеток и достоверно снижен синтез альфа- и гамма-интерферона. У больных с рецидивирующим простым герпесом резко снижена активность NК-клеток и продукция интерферона-гамма, особенно в стадии ремиссии. По всей вероятности, рецидив генитального герпеса связан с истощением выработки интерферона-альфа, что создает благоприятные условия для персистенции вируса. При дефиците интерферона организм не может адекватно контролировать распространение вирусной инфекции. Инверсия синтеза интерферона у больных рецидивирующей ВПГ-инфекцией может быть также связана с наличием антител в сыворотке крови, ингибирующих продукцию интерферона.
Цитокиновый профиль составляет основу специфических иммунных реакций и оказывает непосредственное влияние на механизмы иммунорезистентности при герпесвирусной инфекции [5]. К сожалению, до настоящего времени не существует единого подхода к определению интерлейкинового профиля больных герпесвирусной инфекцией. Именно поэтому все проводимые исследования представляют собой сравнительный анализ изменений уровня цитокинов до и после противовирусного лечения или в период рецидива и ремиссии заболевания.
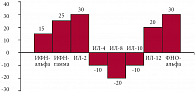
Как показало наше исследование цитокинового профиля, у больных простым герпесом с высокой частотой рецидивов в период обострения до начала противовирусной терапии превалирует экспрессия мРНК интерферона-альфа и ИЛ-18, кроме того, в целом отмечена тенденция к повышению экспрессии мРНК ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10 (рис. 2–3). Все это свидетельствует об активации Тh-2-лимфоцитов.
Наше исследование выявило определенные тенденции к изменению активности мРНК интерлейкинов в зависимости от вида противовирусной терапии. Как видно на рисунке 3, после лечения Аллокином-альфа наблюдалась тенденция к повышению экспрессии мРНК ИФН-α, ИФН-γ, ИЛ-2, ИЛ-12, ФНО-α и понижению ИЛ-4, ИЛ-10 и ИЛ-8, что свидетельствует о переключении цитокинового ответа с Тh-2 на Тh-1. При стандартной терапии ациклическими нуклеозидами, в частности Ацикловиром, аналогичных изменений интерлейкинового профиля не отмечено.
Полученные данные позволяют предположить, что во время лечения Аллокином-альфа происходит активация макрофагально-моноцитарного звена иммунитета. На это указывает наличие ИЛ-1β и ИФН-γ, ИЛ-12 и ФНО-α. Кроме этого, снижение частоты выявляемости ИЛ-4 и ИЛ-6 свидетельствует об угнетении гуморального иммунного ответа. Наличие отрицательного баланса ИЛ-10, с одной стороны, может быть вызвано положительным балансом ФНО-α и ИФН-γ, с другой – эти изменения могут свидетельствовать о завершающем этапе воспалительной реакции (рис. 4).
Известно, что нормальное функционирование иммунной системы обеспечивают Thl- и Тh2-лимфоциты при равноценной продукции их регуляторных цитокинов [10]. Однако некоторые авторы [8] отрицают строгое разделение цитокинов на Thl- и Тh2-типы, так как считают, что один цитокин не способен влиять на степень выраженности иммунологического эффекта. Наряду с функциональным антагонизмом цитокинов существует их ингибирующее влияние друг на друга, обусловленное конкуренцией за связывание клеточных рецепторов.
Суммируя все вышеизложенное, нам хотелось бы выделить ряд ключевых моментов развития герпесвирусной инфекции.
1. Все звенья иммунной системы, так или иначе участвующие в формировании противогерпетического иммунитета, можно разделить на две основные группы. К первой относятся факторы, которые прямо или косвенно активируются только при репликации ВПГ и развитии клинических проявлений заболевания. Они являются основой стадии острого воспаления и фазы специфического иммунного воздействия. Это все факторы гуморального иммунитета, макрофаги, NK-клетки, альфа-интерферон, ИЛ-6, ИЛ-8 и фактор некроза опухоли. Их основной функцией является подавление рецидива герпесвирусной инфекции за счет прямых или опосредованных лизисно-киллерных воздействий непосредственно на вирус или инфицированные им клетки. Важной характеристикой функциональной активности всех вышеуказанных показателей является скорость купирования рецидива.
Ко второй группе относят CD8+-цитотоксические лимфоциты, ИФН-γ, ИЛ-4 и ИЛ-2. Их основная функция – контроль за репродукцией ВПГ и предотвращение его активации, что обеспечивает латентную персистенцию вируса и блокирует его репродукцию в ганглиях. При нарушениях в указанных звеньях иммунной системы ВПГ вновь активируется, что приводит к развитию клинических форм заболевания.
2. При рецидивах герпесвирусной инфекции все факторы иммунитета прямо или опосредованно активируются даже в тех случаях, когда имеется функциональный дефект одного из звеньев иммунитета, поэтому необходимо изучение этих показателей в динамике вирусного процесса.
Все звенья противовирусного иммунитета тесно взаимосвязаны, и нарушения в одном из них приводят к дисбалансу всей иммунной системы по принципу цепной реакции. При рецидивирующем герпесе это осложняет оценку исходных параметров иммунитета в целом и затрудняет выявление нарушений в отдельных звеньях иммунной системы, контролирующих репликацию ВПГ (иммунорегуляторный индекс СD4+/CD8+, количество NK-клеток, их функциональная активность, уровень альфа- и гамма-интерферонов и цитокинов, переключающих иммунный ответ).
Итогом нашего исследования стала разработка алгоритма обследования и лечения больных рецидивирующим простым герпесом.
Для оценки активности вирусного процесса и адекватности противовирусного иммунного ответа мы выбрали наиболее информативный и доступный для широкой клинической практики тест определения уровня специфических антител к вирусу простого герпеса IgM и IgG. Важно отметить особенности интерпретации данного теста. У ряда пациентов без клинических проявлений простого герпеса встречается повышение только специфических IgG. Среди практических врачей распространено мнение, что это свидетельствует о репликации вируса, и для снижения активности инфекционного процесса часто проводится противовирусная и иммуномодулирующая терапия. Мы считаем такую тактику неверной, поскольку следует лечить больного, а не его анализы.
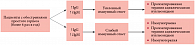
Как видно на рисунке 5, у больных с высокой частотой рецидивов простого герпеса (более 6 раз в год) в период обострения заболевания необходимо оценить показатели гуморального иммунитета (уровень специфических IgM и IgG).
Рассмотрим возможные варианты иммунного ответа.
1. Повышение уровня специфических IgM и IgG более чем в 4 раза у больных с клиническими проявлениями простого герпеса и высокой частотой рецидивов свидетельствует об усиленном иммунном ответе и не требует дальнейшего изучения противовирусного иммунитета. Таким пациентам рекомендуется пролонгированная противовирусная терапия согласно следующим схемам:
Продолжительность лечения строго индивидуальна.
2. При низком уровне специфических IgM и IgG, свидетельствующем о слабо выраженном иммунном ответе, больным с клиническими проявлениями простого герпеса и высокой частотой рецидивов необходимы дополнительные исследования, в частности, иммунограмма с оценкой NK-активности и уровня сывороточного альфа- и гамма- интерферонов. При индексе цитотоксичности ниже 40% и низком уровне индуцированного альфа- и гамма-интерферона показана пролонгированная противовирусная терапия в комбинации с другими противовирусными и иммунотропными препаратами. Приведем пример схемы терапии:
Аллокин-альфа 1 мг подкожно через день, № 3 плюс
NB
Аллокин-альфа – коммерческое название лекарственной формы аллоферона – синтетического линейного олигополипептида, который относится к индукторам синтеза интерферона и активаторам системы натуральных киллеров, обладает противовирусной активностью в экспериментальных моделях различных инфекций, в частности вызванных вирусом простого герпеса. Важной характеристикой данного препарата является способность селективно стимулировать активность факторов естественного иммунитета. Препарат действует только в очаге вирусной инфекции, не активируя весь каскад иммунологических реакций организма.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.