Новообразования полости малого таза в педиатрии. Особенности дифференциальной диагностики
- Аннотация
- Статья
- Ссылки
- English
Актуальность
Диагностические методы, применяемые для уточнения органопринадлежности новообразований в брюшной полости и полости малого таза, крайне важны для постановки диагноза, определения целесообразности и тактики хирургического лечения. Трудности выявления опухолей малого таза в педиатрической практике зачастую связаны с отсутствием характерных жалоб, бессимптомным течением и сложностью гинекологического обследования [1]. Используя только один метод диагностики, не всегда можно получить достоверный результат. Необходим более комплексный подход с последовательным применением инструментальных методов, таких как ультразвуковое исследование (УЗИ), компьютерная томография (КТ) (с контрастом/без контраста), магнитно-резонансная томография (МРТ), иммуногистохимическое (ИГХ) исследование.
Множество клинических случаев «негинекологических» образований в предоперационном диагностическом периоде описаны как «гинекологические» [2–6]. И наоборот, образования, выявленные в брюшной полости, скорее всего будут связаны с гинекологической патологией [7]. Это обусловлено неточностью результатов, полученных в ходе неинвазивных диагностических исследований.
Подобные расхождения наблюдаются, если исследуемое образование в клинической практике встречается достаточно редко. Частота выявления гастроинтестинальных стромальных опухолей (ГИСО) у детей и подростков составляет около 0,4% от общего числа диагностированных ГИСО [8]. По данным Национального института онкологии США, в 2015 г. число выявленных случаев у пациентов в возрасте 8–20 лет составило 1,64% от общего числа ГИСО [9]. Официальной информации о количестве ГИСО, обнаруженных в России в 2022 г., нет [10]. Частота встречаемости ГИСО у детей и подростков женского пола на 70% выше, чем у детей и подростков мужского пола. В то же время у взрослых частота встречаемости данного типа мезенхимальных опухолей одинакова как у мужчин, так и у женщин [9].
Рассмотрим клинический случай выявления у 16-летней пациентки ГИСО тонкой кишки, которая на этапе проведения неинвазивных диагностических исследований была классифицирована как новообразование полости малого таза.
Клинический случай
В онкологическое отделение поступила 16-летняя пациентка с объемным образованием в малом тазу.
Наблюдается гинекологом по поводу нарушения менструального цикла. Диагностирована анемия (уровень гемоглобина – 81 г/л). Назначены препараты железа. На фоне терапии в течение шести месяцев уровень гемоглобина увеличился – 126 г/л, после ее отмены снизился до 96 г/л. Назначена повторная терапия препаратами железа. Через три месяца при плановом УЗИ органов малого таза в полости малого таза справа определялось округлое образование с четкими ровными контурами, умеренным кровотоком по периферии, размером 56,6 × 40,7 × 53,4 мм. Пациентка направлена на консультацию. При контрольном УЗИ убедительных данных о дополнительных объемных образованиях в полости малого таза не получено. Уровень бета-хорионического гонадотропина человека (ХГЧ) – 0 МЕ/л. Пациентка отпущена под наблюдение педиатра по месту жительства. Спустя месяц госпитализирована в гематологическое отделение областной больницы по поводу анемии, где при выполнении МРТ в области дугласова пространства обнаружено объемное образование с четкими неровными контурами, неправильной формы, размером 5,5 × 5,0 × 6,5 см, кистозными включениями. Пациентка повторно направлена на госпитализацию. При дообследовании, по результатам КТ и позитронно-эмиссионной томографии/КТ, определено объемное образование в полости малого таза. Альфа-фетопротеин (АФП) – 2,79 нг/мл. Семейный анамнез: у отца по материнской линии – гемофилия.
Данные УЗИ органов малого таза: в полости малого таза, больше справа, многоузловое кистозно-солидное образование размером около 7,8 × 6,5 × 5,2 см; правый яичник не визуализируется, «перекрытый» данным образованием. Слева в полости малого таза кистозное образование 3,8 × 3,5 см. Свободной жидкости в малом тазу нет. Связи данного образования с мочевым пузырем нет. Печень, почки, поджелудочная железа не изменены. Забрюшинные лимфоузлы не увеличены.
Общий анализ крови без патологических изменений (лейкоциты – 10,87 × 109 Ед/л, эритроциты – 4,52 ×1012/л, гемоглобин – 121 г/л, гематокрит – 37,5%, тромбоциты – 297 × 109/л). С учетом объемного образования в полости малого таза пациентка была госпитализирована в онкологическое отделение для решения вопроса о дальнейшей тактике лечения.
Показано проведение диагностической оценки онкомаркеров – GI19-9Ag – 4,9 Ед/мл, OV125Ag – 31,29 Ед/мл, АФП – 3,17 МЕ/мл, бета-ХГЧ – 0,15 МЕ/л.
На основании данных клинико-лабораторного и инструментального обследований пациентке показано оперативное вмешательство в объеме лапароскопии, удаления/биопсии образования полости малого таза.
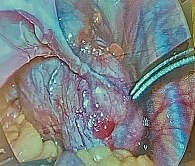
Выполнена диагностическая лапароскопия. Троакары под контролем зрения введены в типичных местах. Инсуффляция углекислым газом. При ревизии: матка, правый и левый яичники без особенностей. В дугласовом пространстве крупное многоузловое неоднородное объемное образование (рис. 1). При дальнейшей ревизии выявлено, что данное образование достаточно подвижное, исходит из стенки тонкой кишки, к поверхности образования подпаяна прядь большого сальника. Принято решение о конверсии. Троакары, газ и оптика удалены из брюшной полости.
Выполнена минисрединная лапаротомия. В лапаротомную рану выведена опухоль, исходящая из стенки кишки на расстоянии 50 см от связки Трейтца. К опухоли подпаяна прядь большого сальника, перевязана, пересечена. Опухоль около 6 см в диаметре, имеет эндо- и экзофитный компонент, при пальпации мягко-эластической консистенции, красно-синего цвета. Радикальное удаление возможно только с участком тонкой кишки. Наложены кишечные жомы на проводящую и отводящую петли кишок на расстоянии 1,5–2 см от опухоли. Кишка пересечена с помощью электрокоагуляции. Опухоль вместе с пораженной частью кишки (около 8 см) удалена радикально без повреждения капсулы. Сформирован тонкокишечный анастомоз «конец в конец» с наложением двурядного шва. Анастомоз проходим. Кишка погружена в брюшную полость. После контроля гемостаза проведена ревизия операционной зоны. Дополнительных инородных предметов не выявлено. В брыжейку тонкой кишки введено 10 мл 0,2%-ного раствора ропивакаина. Малый таз дренирован через лапароскопический доступ в правой подвздошной области. Послойные швы на рану. Внутрикожный шов.
Заключение гистологического исследования новообразования забрюшинного пространства: гастроинтестинальная стромальная опухоль.
После операции назначены инфузионно-корригирующая, антибактериальная, симптоматическая терапия, парентеральное питание, обезболивание, стимуляция кишечника.
Состояние после операции тяжелое, относительно стабильное. Живот не вздут, мягкий, безболезненный. Перистальтика выслушивается. По страховочному дренажу отходит серозно-геморрагическое отделяемое.
В отделении проводилась терапия: цефтриаксон 2 г один раз в день, метронидазол 70 мл три раза в день, этамзилат 2 мл три раза в день, омепразол 20 мг перорально, неостигмина метилсульфат 1 мл три раза в день подкожно, трамадол 1,5 мл внутримышечно при выраженных болях.
В удовлетворительном состоянии пациентка выписана домой на пятые сутки после операции. Рекомендовано наблюдение онколога, гинеколога и хирурга по месту жительства.
Обсуждение
Представленный случай наглядно демонстрирует важность использования разных методов диагностики для установления органопринадлежности новообразования. Несоответствие интраоперационной картины и методов визуализации объясняется тем, что случай достаточно редкий. Преимущественно для однозначной постановки диагноза ГИСО решающим исследованием является диагностическая лапароскопия, поскольку этот вид мезенхимальной опухоли на этапе неинвазивной диагностики сложно дифференцировать с образованиями придатков матки.
Первостепенным является влагалищное пальцевое исследование (в педиатрии ректальное), которое проводится во время осмотра на гинекологическом кресле. По его результатам можно судить о состоянии наружных половых органов, шейки матки, наличии каких-либо образований в области наружного зева, яичников и тела матки. Однако это исследование не является эталонным, поскольку не дает информации о точной локализации образования, его размерах и происхождении.
Исходя из потенциальной природы новообразования, более информативными диагностическими методами считаются УЗИ-диагностика, КТ и МРТ. Например, при диагностике новообразований брюшины (в области малого таза и в брюшной полости) чувствительность УЗИ и WB-DWIBS приблизительно одинакова, но превышает таковую КТ. Если рассматривать диагностику новообразований брюшины отдельно по областям, в полости таза трансвагинальное УЗИ (ректальное УЗИ в педиатрической гинекологии или у пациенток с нарушением развития половых путей) более чувствительно, чем WB-DWIBS с последующей КТ, но в брюшной полости трансабдоминальное УЗИ показывает меньшую специфичность, чем визуализация в поперечном сечении, особенно если исследуется брыжейка тонкой кишки. Для оценки ретроперитонеальных лимфоузлов все методы имеют одинаковую чувствительность [11], а для оценки параорганных и пристеночных узлов малого таза наиболее оптимально трансвагинальное УЗИ. При постановке диагноза ГИСО в педиатрии обязательно следует проверять чистоту лимфоузлов, поскольку в 45% случаев в них могут быть обнаружены метастазы [9].
В настоящее время активно используется метод эндоскопической ультразвуковой диагностики (ЭУД) для дифференцировки ГИСО и лейомиом. Но он также не является эталонным, если не подкреплен другими инструментальными исследованиями. В ряде работ описано применение ЭУД с дальнейшей обработкой данных в сером спектре, в программе «Фотошоп» [12–14]. Результаты показывают достаточно высокий процент дифференцировки новообразований.
Для установления окончательного происхождения образования с гистологической точки зрения стоит проводить прижизненное патологоанатомическое исследование с использованием ИГХ-методов. В представленном случае клетки, полученные после удаления опухоли, были положительны к CD117 (c-KIT) и DOG1. В клинической практике до 95% подтвержденных ГИСО положительны к CD117 [15] и до 98% – к аноктамину-1 (DOG1) [16]. Онкомаркеры CA19-9 и CA125 в рассмотренном случае находились в пределах нормы. CA19-9 считается более специфичным антигеном, чем CA125, в диагностике новообразований яичников [17], особенно выявлении муцинозных опухолей на ранней стадии [18]. Отрицательные значения описанных выше антигенов с большой долей вероятности исключали опухоль яичника еще на дооперативном диагностическом этапе.
Был проведен поиск схожих клинических случаев и обзоров литературы по дифференциальной диагностике новообразований малого таза через систему PubMed по ключевым словам: ГИСО, новообразование придатков, малый таз, диагностика, педиатрия, клинический случай. В результате сочетания ключевых слов было найдено 45 публикаций, из которых отобрано 14. Критериями для отбора стали сроки публикаций за последние десять лет; определяемые новообразования на этапе неинвазивной диагностики были описаны как опухоли матки или придатков, но после диагностического оперативного вмешательства было установлено, что они локализованы в брюшной полости.
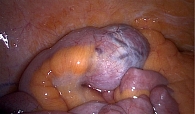
Например, в клинических случаях, описанных S. Higami и соавт. [2], K. Yorita и соавт. [3], N. Karaca и соавт. [4], S.K. Ijeri [6], C.L. Kho и соавт. [7] (рис. 2), все выявленные новообразования на этапе диагностических дооперативных исследований определялись как опухоли полости малого таза.
S. Higami и соавт. [2] описали случай, в котором, по результатам КТ, были выявлены новообразования в области правых и левых придатков. На основании этого был установлен предварительный клинический диагноз: двусторонняя опухоль яичников. Однако после диагностической лапароскопии было выявлено, что образование справа определялось забрюшинно, в области наружной подвздошной вены.
В клиническом случае, описанном K. Yorita и соавт. [3], данные УЗИ показали образование в полости малого таза, прилежащее к задней стенке матки. Были также проведены МРТ, КТ, КТ с контрастом и, исходя из характеристик новообразования, установлен предварительный диагноз субсерозной миомы матки.
При проведении диагностической лапаротомии было выявлено, что петли тонкой и толстой кишок, матка и придатки интактны. Новообразование расположено в нижнем левом квадранте переднебоковой брюшной стенки и куполообразно выступает в брюшную полость.
В клиническом случае, представленном N. Karaca и соавт. [4], пациентка перенесла гистерэктомию. В области левых придатков, по результатам пальцевого исследования и МРТ, определено образование. Данные диагностической лапаротомии показали, что образование берет начало от серозной оболочки подвздошной кишки.
Таким образом, авторы указанных клинических случаев подтверждают тот факт, что неивазивные методы диагностики не всегда позволяют правильно определить органопринадлежность образования. Достоверно ее можно установить в ходе диагностических операций – лапароскопии, лапаротомии.
Заключение
Нами описан достаточно редкий случай ГИСО в педиатрии [8, 9]. Диагностика данного образования многоступенчатая и предполагает использование как неинвазивных, так и инвазивных методов визуализации. При подозрении на опухоль в полости малого таза следует помнить, что описано множество случаев, когда «негинекологические» образования при проведении диагностических исследований выглядят как «гинекологические». Применение разнообразных инструментальных и биохимических методов позволяет получить наиболее полную информацию о новообразовании в предоперационном периоде.
Конфликт интересов.
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов,
связанных с публикацией настоящей статьи.
Источник финансирования.
Отсутствует.
L.V. Adamyan, PhD, Prof., Academician of RAS, Ye.V. Sibirskaya, PhD, Prof., I.V. Karachentsova, PhD, I.N. Skapenkov, D.S. Avetisyan, Ye.I. Krylova, Ye.D. Nakhapetyan
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
V.I. Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology
Russian Children’s Clinical Hospital of N.I. Pirogov Russian National Research Medical University
N.I. Pirogov Russian National Research Medical University
I.M. Sechenov First Moscow State Medical University
Contact person: Irina V. Karachentsova, 5053104@list.ru
The frequency of detection of stromal gastrointestinal tumors in children and adolescents is about 0.4% of the total number of diagnosed GISTs. These tumors can occur throughout the gastrointestinal tract. During the instrumental research, misinterpretation of tumor origin is possible. For this reason, the consistent use of a variety of non-invasive diagnostic methods is extremely important in the preoperative period. We present a case report of a rare GIST detection in pediatrics, which at the stage of noninvasive diagnostic studies was determined as a pelvic tumor. It was possible to accurately determine its origin only after diagnostic laparoscopy. We also provide a description of instrumental and laboratory research methods for the differential diagnosis of the abdominal and pelvic cavities neoplasms.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.