Новые и модифицируемые факторы риска заболеваний молочной железы
- Аннотация
- Статья
- Ссылки
- English
Введение
Молочная железа очень чувствительна к эстрогенам, содержание которых в ее ткани намного превышает содержание в крови. Эстрогены стимулируют пролиферацию эпителия молочной железы, воздействуя на рецепторы и в обход рецепторов, модулируют синтез факторов роста, увеличивают васкуляризацию и гидратацию ткани. Нарушение локального гормонального баланса, который строится на антагонизме эстрогенов (и активных метаболитов эстрогенов) и прогестерона, определяет возникновение доброкачественных и злокачественных заболеваний молочной железы.
Доброкачественные и злокачественные заболевания молочной железы возникают, развиваются и рецидивируют, когда запускается активная эстрогензависимая пролиферация тканей, в которых накоплены ошибки в ДНК. Генетические повреждения обусловлены в том числе токсичными метаболитами эстрогенов. В цикл метаболизма эстрогенов включены специальные защитные механизмы (в частности, метоксилирование), но при воздействии дополнительных факторов риска их оказывается недостаточно. К этим факторам риска относятся, как стало известно из недавних исследований, нарушения сна [1] и агрессивная антибиотикотерапия [2]. Практическому врачу имеет смысл учитывать эти данные в своей работе.
Метаболизм эстрогенов
Фундаментальные исследования показали, что эстрогены и катехоловые метаболиты эстрогенов в некоторых тканях, в том числе в молочной железе, обладают канцерогенной активностью. Она реализуется через геномные, негеномные и митохондриальные эффекты взаимодействия с рецептором, а также через влияние метаболитов на ДНК. В патогенезе рака молочной железы эти два пути дополняют друг друга.
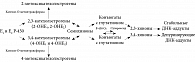
Опишем метаболизм эстрогенов по катехоловому пути. В тканях-мишенях эстрон и эстрадиол под воздействием ферментов цитохрома P450 гидроксилируются в катехолэстрогены (2-OHE1, 2-OHE2, 4-OHE1 и 4-OHE2). Они в свою очередь в присутствии липидных перекисей вовлекаются в процесс образования сначала семихинонов, а потом 2,3- и 3,4-хинонов (рисунок) [4]. Эти хиноны могут связываться с ДНК. 2,3-хиноны образуют с ДНК стабильные аддукты и сохраняются в молекуле вплоть до репарации. Намного опаснее 3,4-хиноны: они образуют депуринирующие аддукты и оставляют после себя беспуриновые участки, которые не восстанавливаются при репарации. Так закрепляется генотоксическое повреждение [3]. Хиноны также могут быть обратно восстановлены до семихинонов и катехолэстрогенов. Для этого они взаимодействуют с молекулярным кислородом, образуя супероксидные радикалы. Эти радикалы восстанавливаются до перекиси водорода. Таким образом, одним из результатов метаболизма эстрогенов становится повышение уровня активных форм кислорода. В итоге ДНК повреждается одновременно за счет ковалентной модификации, связывания с хинонами и прямого воздействия радикалов.
2- и 4-катехолэстрогены обладают высокой (100 и 150%-ной соответственно) аффинностью к рецепторам эстрогена и запускают эстроген-зависимую пролиферацию. Кроме того, для 4-OHE2 описан высокоаффинный цитозольный рецептор, который дает ему возможность действовать в обход рецепторов эстрогена альфа и бета [5]. Следовательно, высокие уровни 4-OHE2 и 4-OHE1 в тканях способствуют активной пролиферации клеток с необратимо поврежденной ДНК. Еще один агонист рецепторов эстрогена и мощный митоген – метаболит 16-альфа-гидроксиэстрон (16-альфа-OHE1). Благодаря низкой аффинности к глобулину, связывающему половые стероиды, он легко проникает в ткани, способствует синтезу ДНК, пролиферации и росту клеток. Показано, что степень его активирующего воздействия сопоставима с таковой 7,12-диметилбензатрацена, известного канцерогена [6].
В тканях-мишенях существуют защитные механизмы инактивации (детоксикации) катехолэстрогенов. Во-первых, конъюгаты хинонов с глутатионом обладают меньшей способностью связываться с рецепторами или ДНК. Затем их катаболизируют в конъюгаты цистеина и N-ацетилцистеина, который к тому же оказывает антиоксидантное и антимутагенное действие [7]. Во-вторых, катехолэстрогены метоксилируются за счет фермента катехол-О-метилтрансферазы, который участвует в распаде катехоламинов (дофамина, адреналина, норадреналина). Интересно, что 2-метоксиэстрадиол, образующийся соответственно из 2-гидроксиэстрадиола (2-OHE2), обладает противоопухолевой активностью [8]. Так, здоровая клетка превращает токсичные метаболиты эстрогенов в защитные молекулы. Отметим, что 2-катехолэстрогены (2-OHE1, 2-OHE2) являются, с одной стороны, наименее токсичными производными гидроксилирования эстрадиола и эстрона, а с другой – предшественниками антионкогенных молекул.
О справедливости этой концепции свидетельствуют результаты крупного эпидемиологического исследования. Авторы получили доступ к пробам крови и мочи женщин, принимавших участие в четырех крупных когортных наблюдательных исследованиях. Из более чем 130 тыс. проб отобрали пробы 1298 женщин, у которых в ходе наблюдения развился рак молочной железы, и 1524 контрольных комплекта. Медиана времени от момента взятия пробы до постановки диагноза составила от 4,4 до 12,7 года. С помощью жидкостной хроматографии и тандемной масс-спектрометрии оценили уровень 15 различных форм эстрогенов и метаболитов эстрогенов в крови и моче. Как и в предыдущих исследованиях, удалось выявить сильную положительную взаимосвязь высокого уровня эстрогенов с риском развития рака молочной железы. Относительное повышение уровней 2-катехолэстрогенов и повышение соотношения 2-метаболитов к 16-метаболитам ассоциировалось со снижением заболеваемости раком. Эта зависимость была максимальной у женщин с наиболее высоким общим уровнем эстрогенов. Авторы пришли к выводу о том, что, смещая метаболизм эстрогенов в пользу 2-OHE2 и 2-OHE1, можно ожидать и снижения риска развития рака молочной железы [9]. Добиться такого смещения можно за счет индукции цитохрома CYP1A1, который гидроксилирует атом углерода в молекуле эстрона во втором положении. Так образуется 2-OHE1, позитивные эффекты которого описаны выше. Эта индукция опосредуется рецептором ариловых углеводородов – арилгидрокарбоновым рецептором (AhR). В природе существует несколько его индукторов.
С клинической точки зрения представляет интерес Мастопол®, гомеопатическое лекарственное средство, комбинация трех растительных и одного минерального компонентов. В клинических исследованиях Мастопол® нормализовал соотношение 2-OHE1/16-OHE1. Так, в проспективном когортном исследовании 137 женщин репродуктивного возраста после различных хирургических вмешательств, в частности тотальной гистеровариоэктомии и химиолучевой супрессии яичников, получали заместительную гормональную терапию и Мастопол®. 2-OHE1 увеличился в 1,5–1,9 раза, а соотношение 2-OHE1/16-OHE1 выросло с 0,7 до 1,5 (p < 0,001). На фоне приема средства Мастопол® также снизилась выраженность болевого синдрома, изменились эхографические показатели состояния молочной железы. Железистый компонент уменьшился с 21,3 ± 2,8 до 10,8 ± 2,6 мм, протоковый компонент – с 1,7 ± 1,0 до 0,8 ± 0,4 мм (p < 0,001) [10]. Мастопол® применяется по одной таблетке три раза в день за полчаса до еды или через час после еды сублингвально. Курс лечения составляет не менее восьми недель, эмпирически установлена оптимальная длительность в 12 недель [11].
Микробиота молочной железы в норме и патологии
В одном исследовании сравнили состав микробиома у женщин с доброкачественными (n = 13) и злокачественными (n= 45) заболеваниями молочной железы, а также у здоровых женщин, которым выполнялись эстетические операции (n = 23). Образцы для анализа брали из зоны вокруг очага заболевания, но не из самой опухолевой ткани. После специальной обработки образцов проводились ПЦР-диагностика и секвенирование бактериального генома. В ткани молочной железы женщин, больных раком, намного шире были представлены бактерии таксонов Staphylococcus и Enterobacteriaceae. В рамках дополнительного эксперимента выяснилось, что продукты деятельности этих бактерий вызывают двунитевые разрывы цепочки ДНК. Это опасный вид дефекта ДНК, поскольку механизм его починки (соединение негомологичных концов) часто срабатывает с ошибкой [12]. В итоге некоторые основания в месте повреждения могут исчезнуть, что при накоплении таких ошибок делает геном менее стабильным и повышает вероятность развития рака, особенно в условиях активной эстрогензависимой пролиферации. Во взятых образцах ткани также широко были представлены бактерии Bacillus. Они не разрушают ДНК, но, в частности, Bacillus cereus метаболизирует прогестерон в 5-альфа-прегнан-3,20-дион. Известно, что уровень этого метаболита в тканях рака молочной железы выше, чем в здоровой ткани. Предполагается, что он оказывает пролиферативный эффект, то есть дополнительно нарушает баланс эстрогенов/прогестерона [13]. Авторы также предположили, что некоторые бактерии и пробиотики обладают протективным эффектом, однако делать выводы еще рано [14].
C. Xuan и соавт. (2014) сравнили микробиоту молочной железы в норме и при раке молочной железы. Оказалось, что в злокачественно перерожденной ткани бактерий существенно меньше, чем в здоровой ткани. Полученные результаты соответствуют результатам других исследований, в которых было показано, что на фоне применения антибиотиков повышается риск возникновения и прогрессирования опухоли. Эффект дозозависимый: чем дольше применяются антибиотики и чем больше их доза, тем выше относительный риск развития рака (1,50, 1,63, 1,71 и 1,79 для четырех квартилей, p-тренд = 0,0001). Видимо, это обусловлено снижением количества бактерий, стимулирующих резидентные иммунные клетки. Само по себе это не вызывает рака, но создает благоприятные условия для онкогенеза. Следовательно, женщин из групп риска по патологии молочной железы необходимо предупреждать о вреде необоснованного приема антибиотиков и тщательно обосновывать их назначение.
Нарушения сна и рак молочной железы
В исследовании типа «случай – контроль» проанализировали 68 422 случая рака и 136 844 сопоставимых контрольных случая. Исследователи изучили распространенность различных нарушений сна и установили, что инсомнии, парасомнии и синдром апноэ сна повышали риск развития рака соответственно до 1,73 (95% ДИ 1,57–1,90), 2,76 (95% ДИ 1,53–5,00) и 2,10 (95% ДИ 1,16–3,80). По мнению авторов, такой эффект связан с иммуносупрессией, часто сопровождающей расстройства сна. Возможны и другие механизмы. В частности, при синдроме обструктивного апноэ сна повторяются эпизоды обструкции верхних дыхательных путей. Возникает удушье, и сначала развивается гипоксия, а потом, когда мозг дает сигнал об активации мышц и дыхание восстанавливается, происходит реоксигенация. Этот мощный стресс для тканей организма сопровождается выбросом свободных радикалов, нарушениями клеточного дыхания и избыточным поступлением в кровь адреналина и норадреналина [15]. Последние, возможно, перегружают метоксилирующие защитные ферменты, необходимые для детоксикации эстрогеновых метаболитов. Следует подчеркнуть, что синдром апноэ сна затрагивает до 12% взрослых женщин, особенно страдающих ожирением, причем риск развития синдрома резко повышается в пери- и постменопаузе. Помимо метаболических последствий, синдром апноэ сна в пять раз повышает риск инфаркта миокарда и инсульта [16]. Практическому врачу полезно обращать внимание на типичные признаки синдрома апноэ сна: ночной храп, дневную сонливость и вялость, ожирение, резистентную к терапии артериальную гипертензию. При подозрении на эти состояния следует отправлять пациентку к профильному специалисту (сомнологу, неврологу, пульмонологу).
Инсомния, как оказалось, тоже является фактором риска развития рака молочной железы. Для инсомнии характерны повторяющиеся нарушения засыпания, ночные и утренние пробуждения. Они возникают, несмотря на достаточное время для сна, и нарушают дневную активность женщины. Оценка распространенности инсомнии зависит от используемых критериев диагностики [17], но даже по самым строгим подсчетам частота инсомнии составляет не меньше 6%. В пери- и постменопаузе инсомния и нарушения сна в составе климактерического синдрома встречаются гораздо чаще. Несмотря на то что нарушения сна относятся к сфере неврологии и психиатрии, акушеру-гинекологу следует обращать на них внимание, особенно если у женщины есть другие факторы риска развития рака молочной железы.
Если женщина уже больна раком молочной железы, она еще больше нуждается в нормальном сне. O. Palesh и соавт. (2014) установили, что продолжительность жизни у больных раком женщин с некачественным и неглубоким сном приблизительно в два раза меньше, чем у больных раком женщин, не имеющих нарушений сна [18].
Таким образом, нарушения сна – один из дополнительных факторов риска развития заболеваний молочной железы, поэтому очень важно нормализовать сон. Базовые рекомендации очень просты: следует ложиться спать примерно в одно и то же время, избегать вечером просмотра телевизора и работы с компьютером, спать в прохладе, а также организовать себе ритуал отхода ко сну. Если же нарушения сна у женщины возникли вследствие острого стресса и, закрепившись, стали хроническими, следует направить женщину к специалисту-сомнологу, который подберет фармакотерапию (каталог сомнологических центров России доступен на сайте rossleep.ru). Однако в любом случае нужно предупредить пациентку, чтобы она не принимала бензодиазепины (клоназепам, феназепам). Эти устаревшие лекарственные средства не подходят для лечения нарушений сна и даже вызывают зависимость.
Заключение
Акушер-гинеколог как специалист не только по репродуктивной функции, но и по женскому здоровью в целом должен обращать внимание на самые разнообразные аспекты самочувствия женщины. Забота о рациональной антибиотикотерапии поможет избежать резистентности и дисбиотических осложнений. Повышение качества сна улучшит прогноз течения заболеваний, стабилизирует работу иммунной и нервной систем. Наконец, внимание к заболеваниям молочной железы (мастодинии, мастопатии) даст возможность своевременно начать профилактику и терапию в щадящем режиме. Все вместе эти действия защитят женщину от рака молочной железы, повысят качество ее жизни.
D.I. Burchakov
I.M. Sechenov First Moscow State Medical University
Contact person: Denis Igorevich Burchakov, dr.burchakov@yandex.ru
In the article it is noted that estrogens and catecholamine metabolites of estrogens in the mammary gland have carcinogenic activity. The cycle of estrogen metabolism includes special protective mechanisms, but when exposed to additional risk factors (aggressive antibiotic therapy and sleep disorders) they are insufficient. In this connection, the necessity of rational antibiotic therapy for avoidance of resistance and dysbiotic complications is stressed as well as the correction of sleep disorders in order to stabilize the immune and nervous system.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.