Современные подходы к антиангиогенной терапии пациентов с диабетическим макулярным отеком
- Аннотация
- Статья
- Ссылки
- English
Введение
Сахарный диабет – опасное хроническое заболевание, негативно влияющее на все структуры глаза. Офтальмологические осложнения сахарного диабета разнообразны и включают в себя повышенный риск возникновения катаракты, гемофтальм, тракционную отслойку сетчатки, неоваскулярную глаукому, диабетическую ретинопатию (ДР) и диабетический макулярный отек (ДМО). Серьезную опасность представляют ДР и ДМО, поскольку являются ведущей причиной потери зрения у трудоспособного населения в мире [1].
Под ДМО понимают утолщение макулярной области сетчатки вследствие накопления жидкости в межклеточном пространстве нейроэпителия в результате разрушения гематоретинального барьера и несоответствия между транссудацией жидкости и ее способностью к реабсорбции [2]. Патофизиология ДМО включает множество биологических путей и механизмов [3]. ДМО возможен на любой стадии ДР.
К основным механизмам ДМО относят:
- нарушение целостности гематоретинального барьера;
- снижение дренажной функции Мюллеровых клеток и ретинального пигментного эпителия. Данные процессы стимулируются факторами воспаления [4].
При развитии ДР у пациентов повышается уровень VEGF в сетчатке и стекловидном теле [5]. VEGF вырабатывается уже на ранней стадии ДР. Доказано, что гипоксия вызывает усиленную выработку VEGF [6].
Определение роли VEGF в патогенезе ДР и ДМО послужило толчком к изучению ангиогенного звена патогенеза диабетического поражения сетчатки [5].
Применяемые в настоящее время в офтальмологии анти-VEGF-препараты по-прежнему не соответствуют всем поставленным целям лечения ДМО, а именно:
- большинство пациентов нуждаются в повторных и частых интравитреальных инъекциях;
- ряд пациентов имеют резистентный ДМО;
- далеко не все пациенты отвечают на лечение (неэффективность лечения);
- затраты здравоохранения весьма значительны из-за часто проводимых инъекций.
Эти нерешенные задачи требуют увеличения доз препаратов, разработки новых лекарственных средств и путей их доставки, изучения других способов лечения [7].
Одной из основных проблем антиангиогенной терапии является нарушение комплаентности, а следовательно, отсутствие эффекта от лечения. Пациенты могут нерегулярно получать интравитреальные инъекции по ряду причин, не всегда полностью контролируемых. Например, у пациентов с сахарным диабетом нарушение режима может возникнуть в результате обострения других сопутствующих заболеваний. Соответственно, таким пациентам необходим препарат, который можно вводить с бóльшим интервалом.
Терапией первой линии при ДМО являются антиангиогенные препараты [7].
Установление роли VEGF в патогенезе ДМО и разработка анти-VEGF-препаратов стали прорывом в офтальмологии, поскольку существующие методы лечения, в частности лазерная коагуляция сетчатки (ЛКС) и витрэктомия, не способствовали улучшению остроты зрения, а лишь останавливали прогрессирование процесса, закрепляя остроту зрения на сниженном уровне. Антиангиогенная терапия улучшает анатомические и функциональные показатели [8].
В ряде исследований продемонстрировано, что результаты анти-VEGF-терапии в реальной клинической практике не соответствуют данным третьей фазы клинических испытаний препаратов [9–14]. Это связано с нерегулярно проводимыми инъекциями.
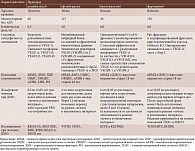
В настоящее время в России зарегистрированы и применяются следующие антиангиогенные препараты: ранибизумаб, афлиберцепт, бролуцизумаб, фарицимаб. Сравнительная характеристика применяемых в офтальмологии анти-VEGF-препаратов при ДМО представлена в табл. 1.
В 2004 г. был одобрен первый анти-VEGF-препарат для применения в офтальмологии – пегаптаниб [8]. Он селективно блокирует VEGF165. Препарат показал некоторую способность поддерживать, но не улучшать остроту зрения, и его вытеснили более эффективные анти-VEGF-препараты.
Анти-VEGF-препараты
Бевацизумаб
Бевацизумаб (Авастин) представляет собой гуманизированное рекомбинантное гиперхимерное моноклональное антитело, которое селективно связывается с VEGF и нейтрализует его. Бевацизумаб ингибирует связывание VEGF с его рецепторами 1-го и 2-го типа на поверхности эндотелиальных клеток, что приводит к снижению васкуляризации [15]. Бевацизумб не был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США и не зарегистрирован для офтальмологического применения.
Ранибизумаб
Это первый анти-VEGF-препарат, зарегистрированный для лечения ДМО. Он был специально создан для интравитреального применения в офтальмологии. В 2006 г. одобрен для лечения пациентов с возрастной макулярной дегенерацией, а в 2012 г. – для лечения пациентов с ДМО. В Российской Федерации препарат был сертифицирован в 2008 г. [16].
Ранибизумаб является фрагментом гуманизированного моноклонального антитела к VEGF-А, избирательно связывается с VEGF-А (VEGF110, VEGF121, VEGF165), предотвращая его взаимодействие с рецептором на поверхности клеток эндотелия (VEGFR-1 и VEGFR-2), приводит к подавлению неоваскуляризации и пролиферации эндотелиальных клеток [17].
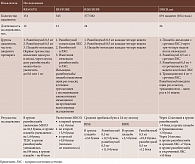
В рандомизированном многоцентровом двойном слепом исследовании RESOLVE оценивали эффективность и безопасность ранибизумаба у 151 пациента с ДМО. В исследовании были сформированы три группы – ранибизумаб 0,3 мг, ранибизумаб 0,5 мг и плацебо-инъекции. Пациенты получили три инъекции с месячным интервалом, затем при необходимости предусматривалось выполнение ЛКС. Эффективность оценивали по динамике максимально корригированной остроты зрения (МКОЗ) и толщине центральной зоны сетчатки (ТЦЗС) по данным оптической когерентной томографии. В результате в группе ранибизумаба МКОЗ увеличилась на 10,3 буквы в среднем, ТЦЗС уменьшилась на 194 мкм. В группе плацебо-инъекций МКОЗ составила 1,4 буквы, ТЦЗС уменьшилась на 48 мкм [5].
Основные исследования эффективности и безопасности ранибизумаба представлены в табл. 2.
При ДМО ранибизумаб применяется у взрослых пациентов в дозе 0,05 мл в виде интравитреальной инъекции, первые три загрузочные дозы вводят ежемесячно, далее в режиме «лечить и увеличивать интервал» либо в режиме PRN «по потребности».
Афлиберцепт
Афлиберцепт – анти-VEGF-препарат, представляющий собой рекомбинантный гибридный белок, состоящий из фрагментов внеклеточных доменов человеческих рецепторов VEGF1 (VEGFR-1) и 2 (VEGFR-2), соединенных с Fc-фрагментом человеческого иммуноглобулина G (IgG1) [18]. Препарат, действуя как растворимый рецептор-ловушка, связывает VEGF-A и PlGF (плацентарный фактор роста) с более высокой аффинностью, чем их естественные рецепторы, и тем самым ингибирует связывание и активацию этих VEGF-рецепторов.
В исследованиях VIVID и VISTA сравнивали эффективность и безопасность интравитреального введения афлиберцепта в разных режимах и ЛКС у пациентов с ДМО на протяжении 148 недель. В группах афлиберцепта проводили пять загрузочных (ежемесячных) инъекций, далее пациенты подгруппы 2q4 получали афлиберцепт в дозе 2 мг каждые четыре недели, пациенты подгруппы 2q8 – каждые восемь недель. В группе ЛКС процедура выполнялась при наличии показаний, но не чаще одного раза в 12 недель [5]. В исследовании VIVID участвовало 404 пациента, в исследовании VISTA – 461 пациент. У каждого пациента исследовался один глаз. В исследовании VISTA значительно больше глаз ранее получали терапию анти-VEGF при ДМО по сравнению с исследованием VIVID – 42,9 против 8,9% соответственно. В целом 82,6% глаз в VISTA и 81,3% глаз в VIVID завершили исследование к 100-й неделе [19].
В исследовании VIVID (аналогичные результаты получены в исследовании VISTA) к концу 148-й недели лечения среднее изменение МКОЗ составило +11,7 буквы в подгруппе афлиберцепта 2q8, +10,3 буквы – в подгруппе афлиберцепта 2q4 и +1,6 буквы – в группе ЛКС (р < 0,0001). Показано, что ЛКС значительно уступает афлиберцепту в динамике функциональных и анатомических показателей, а также в воздействии на степень ДР. Кроме того, анти-VEGF-терапия улучшает зрение пациентов с последующим поддержанием достигнутого эффекта (в отличие от ЛКС) [5].
При ДМО рекомендованная доза афлиберцепта составляет 2 мг. Лечение начинают с пяти ежемесячных интравитреальных инъекций, далее инъекции проводят каждые два месяца. Через 12 месяцев возможны увеличение интервала между инъекциями на основании анатомических и функциональных показателей, а также переход на режим «лечить и увеличивать интервал». В случае активности заболевания интервал между инъекциями сокращается.
Бролуцизумаб
Бролуцизумаб является одним из новых антиангиогенных препаратов в офтальмологии. Он представляет собой одноцепочечный фрагмент гуманизированного антитела (ScFv, single-chain variable fragment). Уникальность бролуцизумаба заключается в его строении: молекулярная масса – 26 кДа, благодаря низкой молекулярной массе при одной интравитреальной инъекции можно ввести 6 мг бролуцизумаба в 0,05 мл раствора [20].
В рандомизированных контролируемых двойных слепых исследованиях KESTREL и KITE бролуцизумаб продемонстрировал эффективность и безопасность у пациентов с ДМО [20]. В эти исследования были включены пациенты старше 18 лет с установленным диагнозом ДМО, препаратом сравнения был афлиберцепт. В исследовании KESTREL все пациенты в соотношении 1:1:1 были рандомизированы на три группы:
- бролуцизумаб 3 мг (n =190);
- бролуцизумаб 6 мг (n = 189);
- афлиберцепт 2 мг (n = 187).
Всего было 566 пациентов, из них завершили исследование на 100-й неделе 464 (82%).
В KITE пациенты были разделены на две группы:
- бролуцизумаб 6 мг (n = 179);
- афлиберцепт 2 мг (n = 181).
Всего было 360 пациентов, из них 299 (83,1%) завершили исследование на 100-й неделе.
В исследовании KESTREL пациенты группы бролуцизумаба получили пять загрузочных доз с шестинедельным интервалом, затем в качестве поддерживающей терапии – по одной дозе с 12-недельным интервалом до 96-й недели исследования с возможностью перехода на восьминедельный интервал, если на контрольном осмотре обнаруживалась активность заболевания (например, снижение остроты зрения, повышение ТЦЗС). Однако в исследовании KESTREL действовало одно ограничение: пациенты, перешедшие на восьминедельный интервал, уже не могли продлить лечение и оставались на таком интервале до конца исследования [21].
В исследовании KITE пациенты группы бролуцизумаба получили пять загрузочных доз с шестинедельным интервалом, далее на этапе поддерживающей терапии предусматривался переход на 12-недельный интервал с возможностью уменьшения интервала до восьми недель при наличии активности заболевания. Но в исследовании KITE разрешалось продлить интервал на втором году, то есть если на 72-й неделе пациенты показывали хорошие результаты переносимости и эффективности препарата, введение препарата могло быть увеличено на четыре недели, например с восьми до 12 недель или с 12 до 16 недель. Если обнаруживалась активность ДМО, интервал уменьшался с 16 или 12 недель до восьми.
В обоих исследованиях афлиберцепт вводили в дозе 2 мг. Пациенты получили пять загрузочных доз с четырехнедельным интервалом, за которым следовали фиксированные инъекции каждые восемь недель.
Среднее количество интравитреальных инъекций к 100-й неделе составило:
- в исследовании KESTREL 10,6 в группе бролуцизумаба 3 мг, 10,6 в группе бролуцизумаба 6 мг, 13 в группе афлиберцепта;
- в исследовании KITE 10,3 в группе бролуцизумаба 6 мг и 13,2 в группе афлиберцепта.
Первичной конечной точкой в исследованиях служило среднее изменение МКОЗ по сравнению с исходным на 52-й неделе исследования, вторичной конечной точкой – изменение показателей по сравнению с исходными на 100-й неделе.
На 52-й неделе в обоих исследованиях среднее изменение МКОЗ на фоне применения бролуцизумаба 6 мг не уступало таковому при использовании афлиберцепта. С 88-й по 100-ю неделю в исследовании KESTREL среднее изменение МКОЗ составило + 8,6 буквы в группе бролуцизумаба 6 мг и +10,6 буквы в группе афлиберцепта, а в исследовании KITE – +10,8 и +8,7 буквы соответственно.
На 100-й неделе в исследовании KESTREL показателя ТЦЗС < 280 мкм достигли 57,9% пациентов группы бролуцизумаба 3 мг, 63,5% – группы бролуцизумаба 6 мг и 51,9% – группы афлиберцепта. В исследовании KITE ТЦЗС < 280 мкм в группе бролуцизумаба 6 мг достигли 62% пациентов, в группе афлиберцепта – 47%.
Общий профиль безопасности бролуцизумаба оставался неизменным в течение второго года исследования. Васкулит сетчатки и окклюзия сосудов сетчатки стали грозными осложнениями на фоне применения препарата бролуцизумаба. В исследовании KESTREL васкулит сетчатки зафиксирован на первом году исследования у 3 (1,6%) пациентов группы бролуцизумаба 3 мг, у 1 (0,5%) – группы бролуцизумаба 6 мг. На втором году исследования не зафиксировано ни одного случая этого осложнения. В исследовании KITE за два года не отмечалось ни одного случая васкулита сетчатки, однако в течение первого года исследования сообщалось об окклюзии сосудов сетчатки у 1 (0,6%) пациента группы бролуцизумаба 6 мг. За второй год исследования не зафиксировано ни одного случая данного осложнения. В исследовании KESTREL на 100-й неделе сообщалось о 3 (1,6%) случаях окклюзии сосудов сетчатки в группе бролуцизумаба 3 мг, 3 (1,6%) – в группе бролуцизумаба 6 мг и 1 (0,6%) – в группе афлиберцепта. Васкулит сетчатки и окклюзия сосудов сетчатки, возникающие при использовании бролуцизумаба, считаются иммуноопосредованными побочными реакциями.
Исследования 3-й фазы KESTREL и KITE – единственные на сегодняшний день исследования, в которых на протяжении 100 недель оценивалась серия нагрузочных инъекций с шестинедельным интервалом у пациентов с ДМО. Бролуцизумаб 6 мг на 100-й неделе (16-недельный интервал) продемонстрировал увеличение МКОЗ по сравнению с афлиберцептом. О возможности сохранить увеличенный интервал между инъекциями говорят следующие результаты. В исследовании KESTREL 32,9% пациентов группы бролуцизумаба 6 мг смогли сохранить 12-недельный интервал между инъекциями до 100-й недели после нагрузочной дозы. В исследовании KITE 47,5% пациентов группы бролуцизумаба 6 мг на 100-й неделе сохраняли интервал между инъекциями ≥ 12 недель, причем у 24,8% пациентов интервал между инъекциями составлял 16 недель.
Препарат бролуцизумаб применяется при лечении ДМО в дозе 0,05 мл раствора (6 мг), первые пять доз (загрузочная доза) вводят с интервалом шесть недель между дозами, далее офтальмолог подбирает индивидуальные режимы для каждого пациента. В отсутствие признаков активности ДМО препарат рекомендуется вводить каждые 12 недель. При активности заболевания интервал между инъекциями сокращается до восьми недель [20].
Фарицимаб
Фарицимаб – новое гуманизированное биспецифическое моноклональное антитело, которое независимо связывает и нейтрализует как Ang-2 (ангиопоэтин 2), так и VEGF-A. Фарицимаб относится к IgG и предназначен для внутриглазного применения с помощью интравитреальных инъекций [22]. Cогласно результатам современных исследований, ангиотензиновый путь играет важную роль в модуляции течения воспалительных процессов и наряду с VEGF-путем участвует в ангиогенезе. Ang-1 (ангиопоэтин 1) и Ang-2, будучи факторами роста, связываются с рецептором Tie-2 с одинаковым сродством, конкурируя друг с другом и оказывая различное влияние на путь Ang – Tie-2 [23]. Ang-1 – сильный агонист рецептора сигнального пути Tie-2, а Ang-2, напротив, действует как антагонист, ингибируя Tie-2. Двойное ингибирование путей Ang-2 и VEGF-A является преимуществом фарицимаба. Согласно доклиническим данным, нейтрализация Ang-2 и VEGF-A восстанавливает барьерную функцию эндотелия. Ang-2 опосредует повышение связывания VEGF с эндотелиальными рецепторами, что приводит к усилению проницаемости капилляров и трассудации. Двойное ингибирование Ang-2/VEGF-A синергически снижает трансмиграцию лейкоцитов. Доклинические данные показали, что двойное ингибирование Ang-2 и VEGF-A синергически снижает воспалительную инфильтрацию сетчатки макрофагами. Двойное ингибирование VEGF-A и Ang-2 значительно снижает ликедж из сосудов по сравнению с ингибированием только Ang-2 или только VEGF [24].
В декабре 2023 г. были опубликованы данные рандомизированных многоцентровых двухлетних исследований YOSEMITE и RHINE о сравнительной эффективности и безопасности фарицимаба и афлиберцепта [3]. В исследованиях участвовал 1891 пациент (940 в YOSEMITE и 951 в RHINE) старше 18 лет с установленным диагнозом ДМО. 78% пациентов ранее не получали анти-VEGF, 22% получали лечение другими анти-VEGF-препаратами.
Пациенты в соотношении 1:1:1 были разделены на три группы:
- фарицимаб 6,0 мг каждые восемь недель;
- фарицимаб 6,0 мг в режиме «лечить и увеличивать интервал»;
- афлиберцепт 2,0 мг каждые восемь недель.
В исследовании YOSEMITE были зарегистрированы следующие осложнения: в группе фарицимаба 6 мг каждые восемь недель – один случай тяжелого витреита, в группе фарицимаба 6 мг в режиме «лечить и увеличивать интервал» – три случая тяжелого увеита.
Согласно объединенным результатам исследований YOSEMITE и RHINE, в среднем за два года прирост МКОЗ составил:
- в группе фарицимаба 6 мг каждые восемь недель – 10,8 буквы ETDRS;
- группе фарицимаба 6 мг в режиме «лечить и увеличивать интервал» – 10,4 буквы ETDRS;
- группе афлиберцепта 2 мг каждые восемь недель – 0,5 буквы ETDRS.
Среднее снижение ТЦЗС в течение двух лет составило в группах фарицимаба 6 мг каждые восемь недель 209,4 мкм, фарицимаба 6 мг в режиме «лечить и увеличивать интервал» – 201,0 мкм, афлиберцепта 2 мг каждые восемь недель – 190,9 мкм.
К 100-й неделе исследования пациентов без ДМО в группе фарицимаба 6 мг каждые восемь недель насчитывалось 88–92%, в группе фарицимаба в режиме «лечить и увеличивать интервал» – 81–86%, в группе афлиберцепта 2 мг каждые восемь недель – 79–83%. Важным результатом двухлетних исследований стало отсутствие интраретинальной жидкости у пациентов, получавших фарицимаб, по сравнению с группой афлиберцепта.
Среднее количество интравитреальных инъекций за период исследования составило:
- в группе фарицимаба каждые восемь недель – 13,6 в исследовании YOSEMITE и 13,5 – в исследовании RHINE;
- группе фарицимаба в режиме «лечить и увеличивать интервал» – 10 и 11 соответственно;
- группе афлиберцепта каждые восемь недель – 13,3 и 13,4 соответственно.
В группах афлиберцепта не зафиксировано ни одного случая внутриглазного воспаления ни в одном из исследований. В целом на протяжении двухлетнего периода переносимость препарата пациентами была хорошей, сопоставимой с таковой афлиберцепта. Не зарегистрировано ни одного случая васкулита сетчатки и окклюзии сосудов сетчатки [3].
Согласно данным исследований, фарицимаб 6 мг в режиме «лечить и увеличивать интервал» показал хорошие анатомические и функциональные результаты: в течение двух лет сохранялся устойчивый прирост МКОЗ, улучшались анатомические результаты, а также стало возможно увеличение интервала между интравитреальными инъекциями без потери эффективности.
Первые четыре загрузочные дозы вводят интравитреально один раз в четыре недели. Доза препарата для однократного введения – 0,05 мл (6 мг). По завершении загрузочной фазы можно использовать режим «лечить и увеличивать интервал» (treat and extend). Интервал между введениями может меняться с четырех до 16 недель с шагом в четыре недели. При выявлении активности заболевания (увеличение ТЦЗС > 20%) интервал между введениями препарата сокращается на четыре или восемь недель. До достижения ТЦЗС < 325 мкм интравитреальное введение препарата происходит один раз в четыре недели [25].
Применение препарата с двойным ингибированием, безусловно, является значимым достижением в лечении ДМО. Тем не менее открытыми остаются вопросы: каким пациентам назначать анти-VEGF в качестве терапии первой линии, а каким – сразу биспецифическое антитело? возможно ли переключение с анти-VEGF на биспецифическое антитело?
Ожидается, что в результате дальнейших исследований ответы на эти вопросы будут получены.
Заключение
VEGF – ключевой медиатор в патогенезе ДМО. Появление анти-VEGF-терапии стало прорывом в лечении множества заболеваний сетчатки, в том числе ДМО. Интравитреальный способ введения анти-VEGF-препаратов обеспечивает оптимальную биодоступность лекарственного вещества в ткани-мишени для достижения максимального терапевтического эффекта при минимизации потенциальных побочных эффектов анти-VEGF-терапии.
В Российской Федерации зарегистрировано много анти-VEGF-препаратов. Они различаются молекулярным строением, относительным количеством молекул на инъекцию, клинической дозировкой, кратностью введения. Поводом для совершенствования указанных лекарственных молекул становится отсутствие достижения целей применения, таких как повышение остроты зрения, снижение количества интравитреальных инъекций, сохранение большого количества резистентных макулярных отеков.
В настоящее время наряду с широко и давно известными, хорошо зарекомендовавшими себя препаратами, например ранибизумабом и афлиберцептом, в лечении пациентов с ДМО применяют новые анти-VEGF-агенты – бролуцизумаб и фарицимаб.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов: отсутствует.
R.N. Amirkulieva, Ye.N. Khomyakova, PhD, I.A. Loskutov, PhD, M.B. Agammedov, PhD
M.F. Vladimirsky Moscow Regional Scientific Research Institute
Contact person: Regina N. Amirkulieva, regina-amirkulieva@yandex.ru
This review presents current literature data on antiangiogenic therapy of diabetic macular edema.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.