Новые возможности объективной диагностики острого риносинусита
- Аннотация
- Статья
- Ссылки
- English
Цель. Определить диагностическую и прогностическую значимость измерения уровня назальной фракции оксида азота (nasal fractional exhaled nitric oxide, nFeNO) при ОРС.
Материал и методы. Проведено проспективное сравнительное исследование с участием 44 пациентов с ОРС (средний возраст – 43,9 ± 13,8 года). Методология включала стандартный оториноларингологический осмотр, эндоскопию полости носа с оценкой по модифицированной шкале Lund – Kennedy, компьютерную томографию околоносовых пазух с оценкой по шкале Lund – Mackay и измерение уровня nFeNO с использованием газоанализатора NOBreath.
Результаты. Полученные данные продемонстрировали статистически значимое снижение уровня nFeNO у пациентов с ОРС по сравнению с контрольной группой (условно здоровые добровольцы). Отмечено двустороннее снижение показателя даже при одностороннем воспалительном процессе, что может свидетельствовать о системном характере мукозальной дисфункции. Установлена статистически достоверная отрицательная корреляция динамики уровня nFeNO с изменениями по шкалам Lund – Mackay и Lund – Kennedy. На основании результатов исследования разработана шкала оценки эффективности лечения, основанная на показателях nFeNO.
Заключение. Полученные результаты позволяют рассматривать измерение уровня nFeNO как потенциальную объективную альтернативу традиционным методам исследования, включая лучевую диагностику. Применение в клинической практике шкалы, основанной на показателях nFeNO, может повысить точность диагностики, объективизировать оценку динамики состояния слизистой оболочки и снизить частоту необоснованного назначения медикаментозной терапии и лучевых методов обследования.
Цель. Определить диагностическую и прогностическую значимость измерения уровня назальной фракции оксида азота (nasal fractional exhaled nitric oxide, nFeNO) при ОРС.
Материал и методы. Проведено проспективное сравнительное исследование с участием 44 пациентов с ОРС (средний возраст – 43,9 ± 13,8 года). Методология включала стандартный оториноларингологический осмотр, эндоскопию полости носа с оценкой по модифицированной шкале Lund – Kennedy, компьютерную томографию околоносовых пазух с оценкой по шкале Lund – Mackay и измерение уровня nFeNO с использованием газоанализатора NOBreath.
Результаты. Полученные данные продемонстрировали статистически значимое снижение уровня nFeNO у пациентов с ОРС по сравнению с контрольной группой (условно здоровые добровольцы). Отмечено двустороннее снижение показателя даже при одностороннем воспалительном процессе, что может свидетельствовать о системном характере мукозальной дисфункции. Установлена статистически достоверная отрицательная корреляция динамики уровня nFeNO с изменениями по шкалам Lund – Mackay и Lund – Kennedy. На основании результатов исследования разработана шкала оценки эффективности лечения, основанная на показателях nFeNO.
Заключение. Полученные результаты позволяют рассматривать измерение уровня nFeNO как потенциальную объективную альтернативу традиционным методам исследования, включая лучевую диагностику. Применение в клинической практике шкалы, основанной на показателях nFeNO, может повысить точность диагностики, объективизировать оценку динамики состояния слизистой оболочки и снизить частоту необоснованного назначения медикаментозной терапии и лучевых методов обследования.

Введение
Распространенность острого риносинусита (ОРС) среди взрослого населения составляет 10–15%, что позволяет отнести его к числу наиболее частых заболеваний верхних дыхательных путей [1, 2]. Несмотря на наличие утвержденных диагностических критериев, основанных на длительности и характере симптомов, рутинная клиническая диагностика остается преимущественно субъективной [3]. Золотым стандартом визуализации воспалительных изменений в околоносовых пазухах (ОНП) служит компьютерная томография (КТ). Однако, согласно международным и национальным клиническим рекомендациям, ее применение оправданно преимущественно при тяжелом течении ОРС, наличии осложнений или неэффективности терапии [3, 4]. Это существенно ограничивает возможности объективного мониторинга воспаления и оценки эффективности лечения.
Таким образом, в клинической практике сохраняется потребность в неинвазивных, безопасных и количественно воспроизводимых методах, позволяющих объективно оценивать состояние слизистой оболочки полости носа и ОНП. Значительный интерес вызывает оксид азота (NO), играющий важную роль в регуляции мукоцилиарного клиренса, местного кровотока и воспалительного ответа. Диагностическая значимость уровня фракции оксида азота (FeNO) при заболеваниях нижних дыхательных путей хорошо изучена [5], тогда как данные о назальной фракции оксида азота (nasal fractional exhaled nitric oxide, nFeNO) при ОРС остаются ограниченными и противоречивыми [6, 7].
В современной литературе различают два показателя: назальный NO – наибольший уровень NO в полости носа, измеряемый методом аспирации, и назальный FeNO (nFeNO) – уровень NO в выдыхаемом через нос воздухе, определяемый при стандартизированном выдохе. В настоящем исследовании был изучен уровень nFeNO как наиболее воспроизводимый в клинической практике параметр.
Нерешенными остаются вопросы стандартизации методики измерения уровня nFeNO, определения его референсных значений при ОРС, оценки его диагностической и прогностической значимости, а также возможной роли в прогнозировании эффективности лечения.
Цель исследования состояла в оценке диагностической ценности nFeNO у пациентов с ОРС.
Материал и методы
В рамках проспективного сравнительного исследования было обследовано 77 пациентов, среди которых 44 больных ОРС составили основную группу (ОГ), а 33 условно здоровых добровольца – контрольную группу (КГ). Для расширения сравнительного анализа лекарственной и лучевой нагрузки на пациентов дополнительно проведен ретроспективный анализ 30 историй болезни пациентов с ОРС, вошедших в группу сравнения (ГС). Средний возраст обследованных – 43,9 ± 13,8 года. Диагноз у пациентов ОГ устанавливали в соответствии с клиническими рекомендациями Министерства здравоохранения Российской Федерации 2024 г. Включение в исследование предполагало обязательное вовлечение верхнечелюстной пазухи в патологический процесс. Критериями исключения являлись одонтогенный РС (как заболевание с иным этиопатогенезом), прием препаратов, способных влиять на метаболизм NO, а также наличие тяжелой сопутствующей патологии в стадии декомпенсации.
Были проведены: стандартный оториноларингологический осмотр всех участников проспективной части исследования, эндоскопическое исследование пазух носа с оценкой состояния слизистой оболочки по адаптированной шкале Lund – Kennedy [8], а также заполнение опросника SNOT-22 (Sino-Nasal Outcome Test) [9]. Ключевым специализированным методом являлось измерение концентрации nFeNO с использованием портативного газоанализатора NOBreath (Bedfont Scientific Ltd., Великобритания). Для обеспечения герметичности при проведении процедуры применяли оригинальный силиконовый конусообразный переходник (патент РФ № 233705), что позволило стандартизировать методику отбора пробы.
У пациентов ОГ измерение nFeNO проводилось трижды: в день обращения до начала терапии, на седьмые – десятые сутки для промежуточной оценки функционального состояния ОНП и на 30–35-е сутки для определения итогового ответа на лечение. У участников КГ исследование выполнялось двукратно – на первом визите и через 30–35 дней.
Результаты
Сравнительный анализ исходных клинико-анамнестических характеристик не выявил статистически значимых различий между ОГ и КГ по возрасту и полу (p > 0,05), что подтверждает их сопоставимость. Однако исходный уровень nFeNO в ОГ (медиана 41,0 (28,0–63,0) ppb) был достоверно ниже, чем в КГ (88,0 (74,0–105,5) ppb; p < 0,0001). При одностороннем воспалительном процессе значимое снижение nFeNO было отмечено не только на ипсилатеральной, но и на контралатеральной стороне (62,0 (47,0–73,0) ppb, p < 0,0001), что может свидетельствовать о системном характере воспаления.
На фоне лечения интраназальными глюкокортикоидами, ирригационной и антибактериальной терапии (АБТ) по показаниям к 30–35-му дню наблюдения уровень nFeNO у пациентов ОГ достигал значений, сопоставимых со значениями КГ. Поскольку измерения проводили не ежедневно, точный день достижения в ОГ уровня nFeNO, равного таковому в КГ, не установлен. Важно, что во всех контрольных точках уровень nFeNO достоверно коррелировал с данными эндоскопической шкалы Lund – Kennedy.
Влияние инвазивных вмешательств на уровень nFeNO мы оценивали отдельно. Лечебно-диагностическая пункция верхнечелюстной пазухи была выполнена 33 участникам исследования (75%). У восьми (18,2%) пациентов измерение nFeNO непосредственно после процедуры оказалось невозможным из-за технических сложностей, связанных с анестезией слизистой оболочки. У остальных 25 (56,8%) пациентов было отмечено транзиторное снижение уровня nFeNO с последующим восстановлением в течение 2–24 часов.
Корреляционный анализ не выявил статистически значимой связи уровня nFeNO с искривлением перегородки носа, гипертрофическим ринитом, бронхиальной астмой и аллергическими заболеваниями. Однако была обнаружена сильная обратная корреляция между возрастом пациентов и уровнем nFeNO после пункции (r = -0,95; p < 0,01), а также между уровнем nFeNO и суммарным баллом опросника SNOT-22 (r = -0,88; p < 0,05), что подтверждает его роль как потенциального маркера тяжести субъективной симптоматики.
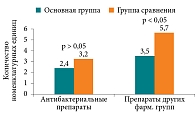
Анализ частоты назначения АБТ не выявил значимых различий между ОГ и ГС, поскольку в исследовании превалировала доля стационарных больных. Однако методом телефонного опроса был проведен катамнез, в ходе которого была проанализирована частота назначения препаратов других фармакологических групп в течение первого месяца заболевания. В результате было установлено статистически значимо более частое применение АБТ для лечения ОРС в ГС по сравнению с ОГ, что можно объяснить включением методологии и объективизации состояния ОНП (рис. 1).
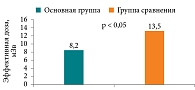
Кроме того, было установлено статистически достоверное снижение суммарной лучевой нагрузки и частоты рентгенологических исследований в ОГ по сравнению с ретроспективной ГС, где тактика основывалась лишь на клинической оценке (рис. 2). При этом статистически значимых различий в общем спектре применявшихся лучевых методов между группами выявлено не было, однако их распределение различалось: в ОГ в большинстве случаев (54,4%) использовали низкодозную конусно-лучевую компьютерную томографию, тогда как в ГС доминировала стандартная мультиспиральная компьютерная томография (42,9%).
Следует подчеркнуть, что решения о сокращении лучевой диагностики и оптимизации АБТ принимали не на основании единственного параметра nFeNO, а в рамках комплексного алгоритма, где nFeNO выступал важным дополнительным объективным критерием. Это позволяет рассматривать предложенную методологию как обоснованную попытку персонализации и оптимизации ведения пациентов с РС, соответствующую современным тенденциям в медицине и фундаментальным этическим принципам.
В ходе исследования была разработана интегративная прогностическая шкала эффективности лечения у пациентов с ОРС методом дискриминантного анализа. Шкала основана на трех значимых предикторах, ассоциированных с исходом по шкале Lund – Kennedy: наличие коморбидной бронхолегочной или аллергической патологии в стадии компенсации или субкомпенсации, факт приема системной АБТ и динамика уровня nFeNO между первым и вторым измерением (ΔnFeNO) (таблица). Применение шкалы позволяет оценить эффективность лечения на 7–10-й и 30–35-й дни наблюдения, что соответствует срокам проведения контрольных измерений в исследовании.
D₀(x) = 0,3839 × A + 3,5101 × B – 0,0238 × C – 1,5521;
D₁(x) = 2,6571 × A + 0,9995 × B + 0,0508 × C – 1,6513,
где:
A – общая коморбидность (1 – да, 0 – нет);
B – прием АБТ (1 – да, 0 – нет);
C – ΔnFeNO1–2 (прирост показателя в ppb).
Прогноз эффективности лечения определяется при выполнении условия D₁(x) – D₀(x) > 0. Точность модели составила 88,6% (чувствительность – 92,3%, специфичность – 60,0%).
В зависимости от результата пациента относят к группе с эффективным или неэффективным лечением. В случае неэффективности требуется пересмотр медикаментозной терапии и назначение лучевой диагностики. Такой исход повышает риск хронизации процесса и может служить показанием к рассмотрению хирургического лечения.
Обсуждение
Результаты проведенного исследования подтверждают, что уровень nFeNO является перспективным объективным маркером функционального состояния слизистой оболочки полости носа и ОНП при остром воспалении. Снижение этого уровня можно объяснить сочетанием ключевых патогенетических факторов РС: отеком слизистой оболочки и обструкцией остиомеатального комплекса, нарушающими диффузию NO из пазух, а также прямым повреждением NO-синтезирующего эпителия под влиянием провоспалительных медиаторов [7, 10].
Особое значение имеет выявленный феномен двустороннего снижения уровня nFeNO при одностороннем ОРС, что может указывать на системный характер воспалительного процесса.
Ключевым практическим результатом стала разработка прогностической модели, основанной на оценке уровня nFeNO на 7–10-е и 30–35-е сутки терапии. Использование модели позволяет врачу на раннем этапе объективно оценить эффективность стартовой консервативной терапии. При росте уровня nFeNO можно с высокой уверенностью продолжать выбранную тактику, тогда как отсутствие роста или снижение уровня nFeNO служит сигналом для своевременного пересмотра терапии, включая рассмотрение вопроса о лучевой диагностике.
Несмотря на обнадеживающие результаты, настоящее исследование и предложенная методика имеют ряд ограничений. Разработанная модель обладает прогностической ценностью, однако ее точные показатели чувствительности и специфичности нуждаются в подтверждении на более масштабных и многоцентровых когортах. Важным методическим ограничением является отсутствие установленных референсных значений nFeNO в оториноларингологической практике. Портативный газоанализатор NOBreath, используемый в данном исследовании, изначально сертифицирован для измерения NO в выдыхаемом воздухе нижних дыхательных путей. Адаптация для верхних дыхательных путей требует использования специальных переходников или насадок, доступность которых может ограничивать широкое внедрение методики.
В рамках дизайна настоящего исследования измерения проводили строго в определенные контрольные точки (7–10-е и 30–35-е сутки), поэтому алгоритм интерпретации для ежедневного мониторинга отсутствует.
Таким образом, представленная работа является одним из первых шагов по интеграции мониторинга nFeNO в клинические алгоритмы ведения пациентов с ОРС в оториноларингологии. К общим ограничениям следует отнести одноцентровый характер исследования, недостаточность выборки и необходимость ежедневного мониторинга. Для внедрения данного подхода в клиническую практику требуется дальнейшая работа: стандартизация методики измерения, валидация алгоритма на независимых когортах и оценка его клинико-экономической эффективности.
Заключение
В проведенном исследовании продемонстрирована клиническая значимость nFeNO как объективного биомаркера при ОРС. Было установлено статистически значимое снижение уровня nFeNO у пациентов основной группы по сравнению с контрольной, а его динамика в процессе лечения коррелирует с изменениями по шкалам Lund – Mackay и Lund – Kennedy. Одним из результатов стало выявление двустороннего снижения nFeNO при одностороннем процессе, что указывает на системный характер воспаления при ОРС.
Основным практическим результатом работы является разработка прогностической модели на основе изменения уровня nFeNO. Использование данной модели в клинической практике наряду со стандартными диагностическими процедурами создает предпосылки для персонализации лечения, способствуя оптимизации лекарственной нагрузки и сокращению числа необоснованных лучевых исследований.
Полученные данные свидетельствуют о перспективности использования уровня nFeNO в качестве нового инструмента для объективного мониторинга и прогнозирования течения ОРС.
Финансирование. Исследование выполнено в рамках НИР ФГБОУ ВО «Российский университет медицины» Минздрава России.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
A.Yu. Ovchinnikov, PhD, Prof., M.A. Edge, PhD, Prof., T.Yu. Sokaeva
Russian University of Medicine, Moscow
Contact person: Tamara Yu. Sokaeva, sokaeva.lor@gmail.com
Acute rhinosinusitis (ARS) remains one of the most common diseases of the upper respiratory tract, with a prevalence reaching 10–15% in the adult population. The diagnosis of ARS in routine practice is primarily based on clinical assessment, while objective instrumental methods, primarily radiological imaging, are used restrictively due to radiation exposure and require strict indications.
Aim. To determine of the diagnostic and prognostic significance decrease measuring levels of nasal fractional exhaled nitric oxide (nFeNO) in ARS.
Material and methods. The prospective comparative study was conducted involving 44 patients with ARS (mean age 43.9 ± 13.8 years). The methodology included a standard otorhinolaryngological examination, nasal cavity endoscopy assessed using the modified Lund – Kennedy score, computed tomography of the paranasal sinuses assessed using the Lund – Mackay score, and nFeNO measurement using the NOBreath gas analyzer.
Results. The obtained data demonstrated a statistically significant decrease in nFeNO levels in ARS patients compared to the control group (conditionally healthy volunteers). A bilateral decrease in the indicator was noted even in cases of unilateral inflammatory processes, which may indicate a systemic nature of mucosal dysfunction. A statistically significant negative correlation was established between the dynamics of nFeNO levels and changes according to the Lund – Mackay and Lund – Kennedy scores. Based on the study results, a treatment efficacy assessment scale utilizing nFeNO parameters was developed.
Conclusion. This results obtained allow considering the measurement of nFeNO levels as a potential objective alternative to traditional diagnostic methods, including radiological imaging. The application of scale utilizing nFeNO parameters in clinical practice may increase diagnostic accuracy, objectify the assessment of mucosal status dynamics, and reduce the frequency of unjustified prescriptions of pharmacological therapy and radiological examination methods.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.