Об особенностях выбора медикаментозной терапии при обструктивных заболеваниях нижних мочевыводящих путей
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проанализированы результаты трех исследований, проведенных в клинике урологии Первого МГМУ им. И.М. Сеченова. В первом исследовании обработаны истории болезни 270 пациентов с различными обструктивными заболеваниями НМП. Во втором исследовании изучено функциональное состояние НМП у 37 пациентов с острой задержкой мочи. В третьем исследовании оценено состояние 80 больных доброкачественной гиперплазией предстательной железы (ДГПЖ) с преобладанием ирритативной симптоматики.
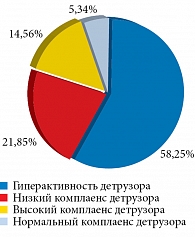
Результаты. В первом исследовании у 120 (58,25%) больных с обструктивными заболеваниями НМП выявлена гиперактивность детрузора, у 45 (21,85%) – низкий комплаенс детрузора, у 30 (14,56%) – высокий комплаенс детрузора, у 11 (5,34%) пациентов – нормальный комплаенс детрузора. Был выполнен анализ 64 уродинамических исследований у пациентов после трансуретральной операции по поводу обструктивных заболеваний НМП с осложненным послеоперационным периодом в виде задержки мочи или большим количеством остаточной мочи. У 30 (46,9%) пациентов функциональное состояние НМП выражалось в виде гиперактивности детрузора, у 19 (29,7%) – повышения комплаенса детрузора, у 15 (23,4%) – снижения комплаенса детрузора. После операции динамический компонент инфравезикальной обструкции сохранился у 12,5% больных.
Во втором исследовании у всех больных во время ишурии наблюдалось выраженное повышение комплаенса детрузора. Детрузорное давление составляло 1–3 (в среднем 2,6) см вод. ст., в то время как в мочевом пузыре находилось от 500 до 1870 мл мочи. Повышенное давление в простатическом отделе мочеиспускательного канала имело вид плато длиной от 2,6 до 3,8 см и составляло от 63 до 166 см вод. ст.
В третьем исследовании у больных ДГПЖ с симптомами гиперактивного мочевого пузыря после проведения оперативного лечения симптомы наполнения сохранялись достоверно реже при предоперационной терапии М-холиноблокатором, чем при лечении альфа-1-адреноблокатором – 12,5 против 27,5%.
Выводы. Подтверждена функциональная классификация инфравезикальной обструкции, отражающая не только степень нарушения функции мочевого пузыря, но и степень изменения уродинамики верхних мочевыводящих путей и функциональной способности почек. Спастическое сокращение гладкой мускулатуры простатического отдела уретры и снижение детрузорного давления лежат в основе развития острой задержки мочи. Точная диагностика особенностей и причин нарушения функции НМП у таких больных помогает в выборе адекватной лечебной тактики. Своевременное выявление уродинамических нарушений, в первую очередь инфравезикальной обструкции и гиперактивности детрузора, у больных ДГПЖ имеет важное практическое значение, так как без учета этого фактора существенно ухудшаются функциональные результаты хирургического лечения.
Материал и методы. Проанализированы результаты трех исследований, проведенных в клинике урологии Первого МГМУ им. И.М. Сеченова. В первом исследовании обработаны истории болезни 270 пациентов с различными обструктивными заболеваниями НМП. Во втором исследовании изучено функциональное состояние НМП у 37 пациентов с острой задержкой мочи. В третьем исследовании оценено состояние 80 больных доброкачественной гиперплазией предстательной железы (ДГПЖ) с преобладанием ирритативной симптоматики.
Результаты. В первом исследовании у 120 (58,25%) больных с обструктивными заболеваниями НМП выявлена гиперактивность детрузора, у 45 (21,85%) – низкий комплаенс детрузора, у 30 (14,56%) – высокий комплаенс детрузора, у 11 (5,34%) пациентов – нормальный комплаенс детрузора. Был выполнен анализ 64 уродинамических исследований у пациентов после трансуретральной операции по поводу обструктивных заболеваний НМП с осложненным послеоперационным периодом в виде задержки мочи или большим количеством остаточной мочи. У 30 (46,9%) пациентов функциональное состояние НМП выражалось в виде гиперактивности детрузора, у 19 (29,7%) – повышения комплаенса детрузора, у 15 (23,4%) – снижения комплаенса детрузора. После операции динамический компонент инфравезикальной обструкции сохранился у 12,5% больных.
Во втором исследовании у всех больных во время ишурии наблюдалось выраженное повышение комплаенса детрузора. Детрузорное давление составляло 1–3 (в среднем 2,6) см вод. ст., в то время как в мочевом пузыре находилось от 500 до 1870 мл мочи. Повышенное давление в простатическом отделе мочеиспускательного канала имело вид плато длиной от 2,6 до 3,8 см и составляло от 63 до 166 см вод. ст.
В третьем исследовании у больных ДГПЖ с симптомами гиперактивного мочевого пузыря после проведения оперативного лечения симптомы наполнения сохранялись достоверно реже при предоперационной терапии М-холиноблокатором, чем при лечении альфа-1-адреноблокатором – 12,5 против 27,5%.
Выводы. Подтверждена функциональная классификация инфравезикальной обструкции, отражающая не только степень нарушения функции мочевого пузыря, но и степень изменения уродинамики верхних мочевыводящих путей и функциональной способности почек. Спастическое сокращение гладкой мускулатуры простатического отдела уретры и снижение детрузорного давления лежат в основе развития острой задержки мочи. Точная диагностика особенностей и причин нарушения функции НМП у таких больных помогает в выборе адекватной лечебной тактики. Своевременное выявление уродинамических нарушений, в первую очередь инфравезикальной обструкции и гиперактивности детрузора, у больных ДГПЖ имеет важное практическое значение, так как без учета этого фактора существенно ухудшаются функциональные результаты хирургического лечения.
![Таблица 1. Избирательность действия М-холиноблокаторов в отношении мочевого пузыря [15]*](/upload/resize_cache/iblock/fd8/195_350_1/vesomni1.jpg)
![Таблица 2. Аффинность мирабегрона к адренорецепторам человека [32]](/upload/resize_cache/iblock/1ca/195_350_1/vesomni2.jpg)
Введение
Частота различных расстройств функций нижних мочевыводящих путей (НМП), особенно гиперактивного мочевого пузыря (ГМП), значительно увеличивается с возрастом [1, 2]. Сложность и многообразие первичных и вторичных симптомов при функциональных расстройствах НМП создают значительные трудности в диагностике, поскольку необходимо не только установить формальный диагноз дисфункции, но и расшифровать патогенез, выявить сопутствующие изменения в других органах и системах, дать полную оценку состояния мочевыводящих путей. В соответствии с классификацией, предложенной Международным обществом по проблемам удержания мочи (International Continence Society), выделяют следующие группы симптомов нарушения функции НМП: симптомы накопления, опорожнения и после опорожнения [3].
Симптомы нижних мочевыводящих путей (СНМП) у мужчин чаще всего вызваны механической обструкцией. Крайнее проявление СНМП – острая задержка мочи, риск развития которой увеличивается с возрастом. Еще одна причина расстройств мочеиспускания – гиперактивность гладкомышечных клеток в стенке мочевого пузыря, которая приводит к постоянному или периодическому их гипертонусу. Если механическая обструкция вызывает главным образом симптомы опорожнения, то гиперактивность детрузора проявляется симптомами накопления.
У большинства пациентов расстройства мочеиспускания обусловлены как механическим, так и функциональным фактором, поэтому у 49% мужчин имеют место симптомы и опорожнения, и накопления [4]. Результаты опроса EpiLUTS, проведенного в США, Великобритании и Швеции, также показали, что СНМП, связанные с накоплением мочи, опорожнением мочевого пузыря и возникающие после мочеиспускания, у пациентов часто наблюдаются одновременно [5].
Хотя инфравезикальная обструкция (ИВО) вследствие доброкачественной гиперплазии предстательной железы (ДГПЖ) считается наиболее частой причиной расстройств мочеиспускания у пожилых мужчин, СНМП могут наблюдаться и при других заболеваниях. Более того, достаточно выраженные СНМП могут встречаться и без существенной механической обструкции. Нейрогенные нарушения, ятрогенные факторы и вмешательства на предстательной железе могут также стать причиной развития симптомов наполнения и/или опорожнения. До 80% пациентов с выраженной формой ИВО в два раза чаще, чем пациенты без ИВО, имеют гиперактивность детрузора [4]. ГМП отмечается у 52–80% мужчин с ИВО вследствие ДГПЖ, а у 38% мужчин с ИВО вследствие ДГПЖ симптомы ГМП сохраняются после оперативного устранения обструкции [6, 7].
Фармакотерапия
Лечение дисфункций мочевого пузыря продолжает оставаться сложной и во многом еще нерешенной задачей. Болезнь затрагивает сложнейшие механизмы взаимоотношений детрузорно-сфинктерных систем, нарушает все три функции пузыря – накопление, удержание и изгнание мочи. Благодаря новым фармакологическим препаратам сегодня появилась возможность осуществлять консервативное лечение урологической патологии в тех случаях, которые еще десять лет назад неизменно ассоциировались с хирургическим вмешательством. Однако это обстоятельство потребовало более глубоких знаний физиологии и патофизиологии мочевыводящих путей.
Согласно общепринятым рекомендациям, методом выбора является медикаментозная фармакотерапия, затем следует поведенческая терапия, физиотерапия и остальные виды лечения. Преимущества фармакотерапии заключаются в том, что она доступна, дает быстрый эффект, экономит время врача. Для пациентов медикаментозная терапия привлекательна тем, что не требует от них значительных усилий. Кроме того, медикаментозную терапию можно проводить длительно и персонифицированно, индивидуально подбирая дозу и режим.
Патогенетическая фармакотерапия ГМП должна быть ориентирована на возможные миогенный и нейрогенный механизмы развития. Ее целью является устранение ведущих симптомов, что непосредственно связано с улучшением уродинамических показателей: снижением активности детрузора, увеличением функциональной емкости мочевого пузыря. Мишени фармакотерапии могут быть условно разделены на центральные и периферические. К центральным относят зоны контроля мочеиспускания в спинном и головном мозге, а к периферическим – мочевой пузырь, уретру, предстательную железу, периферические нервы и ганглии.
Препараты для фармакологической коррекции ГМП должны отвечать следующим требованиям: быть селективными в отношении рецепторов мочевого пузыря, хорошо переноситься, чтобы обеспечить возможность длительной терапии, эффективно воздействовать на основные симптомы ГМП, в том числе на недержание мочи. Идеальный препарат для лечения ГМП обеспечивает оптимальный баланс эффективности и переносимости, позволяет добиться приверженности к лечению и продлить терапию. К сожалению, количество пациентов, получающих адекватную терапию ГМП, в России в 17 раз меньше, чем в Великобритании, и в 15 раз меньше, чем в Германии.
Альфа-1-адреноблокаторы
Наиболее часто в урологической практике применяются такие оригинальные альфа-1-адреноблокаторы, как тамсулозин (Омник®, Омник Окас®), теразозин (Сетегис), доксазозин (Кардура), альфузозин (Дальфаз) и силодозин (Урорек) [8, 9]. С одной стороны, многие непрямые сравнения (по результатам плацебоконтролируемых исследований), так же как и не столь многочисленные прямые сравнительные исследования, продемонстрировали сопоставимую эффективность двух высокоселективных альфа-1-адреноблокаторов тамсулозина и силодозина при использовании в адекватных дозировках [10]. С другой стороны, альфа-1-адреноблокаторы отличаются переносимостью: селективный альфа-1-адреноблокатор тамсулозин пациенты переносят лучше, чем другие альфа-1-адреноблокаторы без подтиповой селективности, например доксазозин или теразозин [11]. При наличии селективности в отношении альфа-1A-адренорецепторов препарат будет вызывать меньше побочных эффектов со стороны сердечно-сосудистой системы по сравнению с неселективным препаратом [12]. Селективная блокада альфа-1A-адренорецепторов может обеспечить эффективное лечение СНМП/ДГПЖ [13].
М-холиноблокаторы
В настоящий момент в лечении ГМП, как правило, применяются препараты, воздействующие на мускариновые рецепторы мочевого пузыря. Доказано, что опосредованная ацетилхолином стимуляция М-рецепторов детрузора играет ведущую роль как при нормальных, так и при «нестабильных» сокращениях детрузора [14]. Большинство из них вызывают неизбежные нежелательные явления, что обусловливает необходимость соблюдения баланса между преимуществами и недостатками лечения. Антимускариновое действие обычно сопровождается сухостью во рту, запорами, трудностями аккомодации, сонливостью. Препараты не должны назначаться пациентам с нарушенным оттоком мочи из мочевого пузыря (обструктивной уропатией), обструкцией кишечника, язвенным колитом, глаукомой или миастенией.
В настоящее время в России используются следующие М-холиноблокаторы: солифенацин (Везикар), оксибутинин (Дриптан), троспия хлорид (Спазмекс), толтеродин (Детрузитол, Уротол). Наиболее селективным в отношении мочевого пузыря является солифенацин (табл. 1) [15].
Хорошая переносимость солифенацина (Везикара) определяет выбор данного препарата в лечении ургентных расстройств мочеиспускания у пациентов старшей возрастной группы. Они, как правило, имеют сопутствующие заболевания и вынуждены принимать несколько лекарств. В этой связи пожилым пациентам следует с осторожностью назначать препараты, прием которых с большой вероятностью будет сопровождаться нежелательными явлениями.
На сегодняшний день подтверждено положительное влияние возможности увеличения дозировки солифенацина в лечении основных симптомов ГМП и актуализирована необходимость применения 10 мг препарата на старте терапии:
- Везикар 10 мг эффективно устраняет все симптомы ГМП [16];
- Везикар 5/10 мг снижает ургентность на 89% [17];
- Везикар 5/10 мг эффективнее толтеродина в снижении ургентности и ургентного недержания мочи [18];
- увеличение дозы Везикара до 10 мг позволяет добиться лучших результатов в лечении больных ГМП [19];
- эффективность 10 мг Везикара сопровождается благоприятным профилем безопасности и переносимости [19];
- Везикар 10 мг не оказывает значимого влияния на когнитивную функцию у пожилых пациентов в отличие от оксибутинина [20];
- Везикар 10 мг благодаря оптимальному балансу эффективности и безопасности характеризуется большей приверженностью к лечению среди имеющихся М-холинолитиков [21].
М-холиноблокаторы в комбинации с альфа-1-адреноблокаторами
Согласно рекомендациям Европейской ассоциации урологов (European Association of Urology), комбинированная терапия М-холиноблокаторами в комбинации с альфа-1-адреноблокаторами может быть использована в лечении пациентов с умеренными или выраженными СНМП, если при монотерапии выраженность терапевтического эффекта была недостаточной [22].
Комбинированная терапия показана мужчинам с ИВО и персистирующими симптомами ГМП, а также с низким риском возникновения острой задержки мочи [23]:
- клинически выраженная ИВО (максимальная скорость потока мочи 5–15 мл/с);
- частота мочеиспусканий ≥ 8 за 24 часа;
- ургентные позывы ≥ 1 за 24 часа, с ургентным недержанием мочи или без него;
- ноктурия;
- суммарный балл по Международной шкале оценки симптомов заболеваний предстательной железы (International Prostate Symptom Score) ≥ 12;
- качество жизни (Quality of Life) ≥ 3 баллов;
- объем остаточной мочи < 200 мл;
- отсутствие острой задержки мочи в анамнезе.
Комбинированная терапия альфа-1-адреноблокатором и М-холиноблокатором высокоэффективна у пациентов с ДГПЖ в сочетании с ГМП [24]. На фоне подобного лечения не выявлено существенного увеличения объема остаточной мочи, равно как и развития эпизодов острой задержки мочи [25–30].
Положительные результаты комбинированной терапии альфа-1-адреноблокатором и М-холиноблокатором легли в основу разработки препарата Везомни для лечения комплекса симптомов наполнения (ургентные позывы и учащенное мочеиспускание) и опорожнения у мужчин с ДГПЖ. Каждая двухслойная таблетка Везомни содержит один слой антимускаринового препарата солифенацина сукцината (6 мг), что соответствует 4,5 мг солифенацина, и один слой альфа-1-адреноблокатора тамсулозина гидрохлорида (0,4 мг) в лекарственной форме ОКАС®, что соответствует 0,37 мг тамсулозина. Солифенацин подавляет гиперактивность детрузора и уменьшает симптомы, связанные с накоплением мочи. Тамсулозин ОКАС® расслабляет гладкую мускулатуру предстательной железы, капсулы, простатической части мочеиспускательного канала и шейки мочевого пузыря и уменьшает в большей степени выраженность симптомов опорожнения и в меньшей – симптомов наполнения.
Бета-3-адреномиметик
Следует отметить некоторые «реалии жизни», которые становятся причинами прекращения антимускариновой терапии ГМП: у 46% больных нет ожидаемого эффекта, 25% пациентов перешли на новый препарат, 23% научились обходиться без лекарств, 21% пациентов вынуждены отказаться от приема М-холиноблокаторов из-за невыносимых побочных эффектов [31].
Из-за выраженных нежелательных явлений и низкой приверженности пациентов к лечению были предприняты попытки разработать новые препараты. К новому фармакологическому классу препаратов для лечения ГМП, а именно к группе бета-3-адреномиметиков, относится недавно зарегистрированный в России препарат Мирабегрон. Мирабегрон производится в форме ОКАС® и доступен в виде таблеток в дозировке 50 мг для приема один раз в день.
Мирабегрон высокоселективен в отношении бета-3-адренорецепторов: его сродство к бета-3-адренорецепторам в 105 и 33 раза выше, чем к бета-1- и бета-2-адренорецепторам соответственно (табл. 2) [32]. Активация бета-3-адренорецепторов с помощью мирабегрона стимулирует расслабление детрузора и способствует удержанию мочи, приводя к увеличению накопительной емкости мочевого пузыря и интервала между мочеиспусканиями [33]. Мирабегрон не оказывает влияния на парасимпатическую стимуляцию сокращения детрузора и опорожнения мочевого пузыря и поэтому, в отличие от антимускариновых препаратов, может снизить риск острой задержки мочи [34–36].
Концепция лечения ГМП мирабегроном была подтверждена в исследовании BLOSSOM, которое было опубликовано С. Chapple и соавт. в 2008 г. [37]. В данном исследовании принимали участие клинические центры из шести европейских стран и в общей сложности 260 пациентов. Больные ГМП были случайным образом распределены в четыре группы и принимали соответственно плацебо, мирабегрон 100 мг два раза в день, мирабегрон 150 мг два раза в день или толтеродин замедленного высвобождения 4 мг один раз в день на протяжении четырех недель. Были выявлены значительные преимущества обеих доз мирабегрона по сравнению с плацебо и толтеродином в лечении поллакиурии, а также несомненное преимущество мирабегрона перед плацебо в лечении ургентных позывов, недержания мочи и ноктурии. Частота возникновения побочных реакций составляла для мирабегрона 39,2%, плацебо – 36,4%, толтеродина – 48,4%.
Под руководством С. Chapple было проведено европейское исследование DRAGON по поиску оптимальной дозы мирабегрона [38]. 919 больных были распределены в пять групп: плацебо, мирабегрон 25, 50, 100 и 200 мг. Лечение проводилось на протяжении 12 недель. Эффективность доз 50, 100 и 200 мг отличалась незначительно. Именно на основании этого исследования была определена стандартная доза препарата в 50 мг. Частота побочных реакций для мирабегрона не превышала таковую для толтеродина, а частота возникновения сухости во рту была существенно ниже по сравнению с М-холинолитиками.
Еще одно большое исследование по изучению эффективности мирабегрона ARIES проводилось в США и Канаде [39]. Был выполнен двойной слепой сравнительный анализ эффективности мирабегрона 50 и 100 мг по сравнению с плацебо. 1328 больных ГМП были распределены в три соответствующие группы. По истечении 12 недель во всех группах снизилось число эпизодов недержания мочи (-1,13, -1,47 и -1,63 для плацебо, 50 и 100 мг мирабегрона соответственно) и частого мочеиспускания (-1,05, -1,66 и -1,75, p < 0,05).
В исследовании SCORPIO в качестве сравнения эффективности мирабегрона V. Khullar выбрал толтеродин с медленным высвобождением [40]. В это одно из самых крупных исследований было включено 1978 пациентов с ГМП из Европы и Австралии. Больные были распределены на четыре группы: плацебо (n = 494), мирабегрон 50 мг (n = 493), 100 мг (n = 496), толтеродин медленного высвобождения 4 мг (n = 495). Дизайн исследования предполагал лечение в течение 12 недель. Несмотря на значительное улучшение состояния больных по всем симптомам ГМП, преимущества мирабегрона не достигли статистической значимости по сравнению с толтеродином медленного высвобождения. Однако мирабегрон оказался весьма эффективным у больных, ранее получавших холинолитики и прекративших их прием по причине недостаточного действия или выраженных побочных реакций. На фоне приема препарата не было отмечено случаев задержки мочи, регистрировалось существенно меньшее количество эпизодов сухости во рту, запоров и других нежелательных явлений со стороны желудочно-кишечного тракта.
Интересны результаты многоцентрового исследования TAURUS, включившего 2444 пациента из Северной Америки, Европы и других стран [41]. Больные были распределены по четырем группам: плацебо, мирабегрон 50 и 100 мг, толтеродин замедленного высвобождения 4 мг. Прием препаратов продолжался в течение 12 месяцев. Именно длительный срок лечения обусловливает ценность полученных данных. Пациенты обследовались через один, три и 12 месяцев после начала приема препаратов. На протяжении года приема мирабегрона наблюдалось стойкое снижение количества эпизодов недержания мочи и мочеиспусканий. И мирабегрон, и холинолитики с одинаковой частотой вызывали такие нежелательные явления, как гипертензия, запоры и головная боль. Исключение составила лишь сухость во рту, которая намного чаще возникала у больных, получавших М-холинолитик. Удлинение QT-интервала на электрокардиограмме при длительном приеме мирабегрона не наблюдалось.
Мирабегрон не противопоказан пациентам с глаукомой и сопоставим с плацебо по воздействию на внутриглазное давление. Частота наличия побочных эффектов со стороны центральной нервной системы в клинических испытаниях сравнима с плацебо: препарат не влияет на когнитивные свойства [42–44]. Таким образом, мирабегрон можно без опасений назначать пожилым пациентам.
На сегодняшний день мирабегрон – первый зарегистрированный препарат альтернативной фармакологической группы, который прошел многочисленные клинические исследования и доказал высокую эффективность в устранении ургентных позывов к мочеиспусканию и недержания мочи, связанного с императивными позывами.
Материал
В клинике урологии Первого МГМУ им. И.М. Сеченова было выполнено несколько научных работ, посвященных диагностике и лечению различных СНМП у мужчин [45–47].
В первой работе были обработаны истории болезни 270 пациентов с различными обструктивными заболеваниями НМП [45]. 206 пациентам при поступлении в клинику выполнялось комбинированное уродинамическое исследование с целью выяснения функционального состояния НМП. У 128 пациентов выявлена ДГПЖ, у 26 – рак простаты, у 41 – стриктура уретры, у 11 пациентов – деформация шейки мочевого пузыря. Обработаны 64 уродинамических исследования у пациентов после трансуретральной операции по поводу обструктивных заболеваний НМП с осложненным послеоперационным периодом в виде задержки мочи или большим количеством остаточной мочи [45].
Во второй работе для изучения функционального состояния НМП при острой ишурии были обследованы 37 пациентов, которые поступили с острой задержкой мочи. Возраст пациентов варьировал от 52 до 73 лет (в среднем 68,4 года) [46]. Время, прошедшее с момента возникновения ишурии, составляло от трех до семи часов. У 18 пациентов пусковым моментом для возникновения острой ишурии послужила погрешность в диете (злоупотребление алкоголем, острой пищей), у девяти – оперативное вмешательство на различных органах, у трех – длительно текущая хроническая задержка мочи (объем остаточной мочи более 300 мл), у одного – инфаркт миокарда, у шести пациентов причина острого возникновения ишурии неизвестна. При обследовании в клинике у 35 была выявлена ДГПЖ, у двух – рак простаты. Интересно, что у пяти пациентов ишурия явилась первым симптомом заболевания, так как до этого больные не предъявляли жалоб на расстройства мочеиспускания. Кроме того, 19 больным ранее проводилась консервативная терапия по поводу ДГПЖ (Трианол, Пермиксон, Тыквеол и др.). Однако в последнее перед возникновением ишурии время все пациенты по разным причинам прием препаратов прекратили. Для определения функционального состояния мочевого пузыря при ишурии до опорожнения мочевого пузыря выполнялась цистометрия. Для оценки функционального состояния уретры 19 пациентам была выполнена профилометрия уретры. Регистрация внутрипузырного давления осуществлялась по уретральному катетеру либо по цистостомическому дренажу. При возможности осуществления мочеиспускания выполнялось исследование «давление – поток» (pressure flow study).
В третьей работе из 300 больных ДГПЖ, которые проходили лечение в клинике с 2001 по 2011 г., было выбрано 138 пациентов, у которых преобладала ирритативная симптоматика [47]. По данным комплексного уродинамического исследования у 89 (64,5%) из них было подтверждено наличие ГМП. Девять пациентов, которые получали медикаментозное лечение менее трех месяцев или воздержались от последующего выполнения трансуретральной резекции простаты, не вошли в исследование. Таким образом, в исследование было включено 80 мужчин с ДГПЖ и преобладанием ирритативной симптоматики ГМП. Возраст больных варьировал от 53 до 84 лет (медиана 68 лет). Им проводилась медикаментозная терапия в течение трех месяцев с последующим выполнением трансуретральной резекции предстательной железы. Пациенты были исходно разделены на две группы по 40 человек: первая группа получала М-холиноблокатор, вторая – альфа-1-адреноблокатор.
Методы
Результаты цистометрических исследований в указанных выше научных работах анализировали на основании следующих показателей:
- физиологическая емкость мочевого пузыря – объем наполнения пузыря, при котором возникал первый позыв к мочеиспусканию;
- максимальная емкость мочевого пузыря – объем наполнения пузыря, при котором возникал крайне выраженный позыв к мочеиспусканию;
- податливость стенки мочевого пузыря (комплаенс) – отношение изменения объема наполнения мочевого пузыря к изменению внутрипузырного давления;
- величина внутрипузырного, внутрибрюшного и детрузорного давлений; гиперактивность детрузора – непроизвольные колебания детрузорного давления с амплитудой выше 15 см вод. ст.
Эвакуаторную функцию мочевого пузыря и мочеиспускательного канала оценивали на основании показателей внутрипузырного, внутрибрюшного и детрузорного давления при максимальной скорости потока мочи по данным урофлоуметрии. При этом по значению детрузорного давления при максимальной скорости потока мочи определяли сократительную способность детрузора. Для характеристики давления в мочевом пузыре использовалась величина детрузорного давления.
Результаты
В первой работе у большинства больных – 120 (58,25%) – была выявлена гиперактивность детрузора (рис. 1) [45]. Средняя длительность жалоб у пациентов с гиперактивностью детрузора составила 5,34 года, низким комплаенсом детрузора – 6,16 года, высоким комплаенсом детрузора – 4,34 года. Максимальный цистометрический объем мочевого пузыря у пациентов с ГМП составил 183,59 мл, а среднее колебание детрузорного давления – 73,44 см вод. ст.
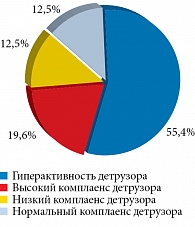
У 56 (27,2%) пациентов был обнаружен уретерогидронефроз: у 37 – двусторонний, у 19 – односторонний. Основной причиной уретерогидронефроза у 31 (55,4%) пациента могла стать выявленная гиперактивность детрузора (рис. 2). Средняя длительность заболевания у пациентов с уретерогидронефрозом – 6,6 года.
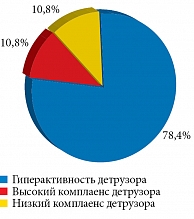
Пузырно-мочеточниковый рефлюкс при антеградной цистографии диагностирован у 37 (17,9%) пациентов, хронической почечной недостаточности – у 19 (9,2%). Пузырно-мочеточниковый рефлюкс у 29 (78,4%) пациентов мог стать следствием выраженного нарушения уродинамики мочевого пузыря по типу гиперактивности детрузора (рис. 3). У пациентов с пузырно-мочеточниковым рефлюксом средняя длительность заболевания составила 4,57 года, среднее колебание детрузорного давления – 51,18 см вод. ст. У 15 пациентов пузырно-мочеточниковый рефлюкс сочетался с расширением верхних мочевыводящих путей. В этой группе больных в ходе уродинамического исследования у восьми была выявлена гиперактивность детрузора, у четырех – повышение комплаенса мочевого пузыря, у трех – снижение комплаенса детрузора.
Таким образом, с увеличением длительности ИВО, снижением комплаенса детрузора, его гиперактивностью, увеличением амплитуды сокращений детрузора в момент некоординированного сокращения усугубляется и состояние верхних мочевыводящих путей (от пузырно-мочеточникового рефлюкса до уретерогидронефроза и хронической почечной недостаточности).
Наиболее часто при уродинамическом исследовании выявлялась гиперактивность детрузора (58,25%), которая, возможно, развилась вследствие ИВО и последующей ишемии мочевого пузыря. Эта дисфункция мочевого пузыря могла быть основным ведущим звеном в развитии осложнений ИВО, а именно пузырно-мочеточникового рефлюкса, уретерогидронефроза и, как следствие, выраженного нарушения уродинамики верхних мочевыводящих путей – хронической почечной недостаточности [45]. Таким образом, полученные данные подтверждают функциональную классификацию ИВО, отражающую не только степень нарушения функции мочевого пузыря, но и степени изменения уродинамики верхних мочевыводящих путей и функциональной способности почек [48].
В первом исследовании были обработаны 64 уродинамических исследования у пациентов после трансуретральной операции по поводу обструктивных заболеваний НМП с осложненным послеоперационным периодом в виде задержки мочи или большим количеством остаточной мочи [45]. У 30 (46,9%) пациентов функциональное состояние НМП выражалось в виде гиперактивности детрузора, у 19 (29,7%) в виде повышения комплаенса детрузора, у 15 (23,4%) – снижения комплаенса детрузора. У 13 (20%) пациентов выявлена ИВО, потому им была выполнена диагностическая уретроцистоскопия. Пяти больным потребовалось удаление некротизированной ткани простаты после трансуретральных пособий, у восьми механическая обструкция выявлена не была. Скорее всего, в данном случае проявился динамический компонент ИВО за счет активности альфа-1-адренорецепторов шейки мочевого пузыря и уретры. После операции динамический компонент инфравезикальной обструкции сохранился у 12,5% больных.
Разногласие относительно причин, приводящих к такому осложнению, как ишурия, и в то же время схожесть клинической картины у разных больных заставили обратить внимание на состояние мочевого пузыря и мочеиспускательного канала у пациентов во время ишурии во втором исследовании [46].
У всех больных во время ишурии наблюдалось выраженное повышение комплаенса детрузора. Детрузорное давление составляло 1–3 (в среднем 2,6) см вод. ст., в то время как в мочевом пузыре находилось от 500 до 1870 мл мочи (количество определялось после опорожнения мочевого пузыря). У больных при профилометрии уретры также были отмечены общие признаки. Повышенное давление в простатическом отделе мочеиспускательного канала имело вид плато длиной от 2,6 до 3,8 см и составляло от 63 до 166 см вод. ст. Таким образом, были выделены две особенности, характерные для пациентов, страдающих ишурией: повышение внутриуретрального давления в простатическом отделе уретры и значительное повышение комплаенса детрузора.
Всем больным осуществлялось дренирование мочевого пузыря постоянным катетером на фоне приема альфа-1-адреноблокаторов. Через три – семь дней пациентам были повторно выполнены цистометрия и профилометрия уретры. При определении профиля отмечалось снижение уретрального давления в простатическом отделе до 42–50 см вод. ст., а участок максимального давления смещался дистальнее.
Однако данные цистометрии были неоднородны. У 14 (37,9%) пациентов имели место нормальная или повышенная чувствительность и нормальный комплаенс либо незначительное повышение комплаенса мочевого пузыря. У этих пациентов после удаления катетера восстановилось мочеиспускание. У остальных 23 пациентов наблюдались снижение чувствительности и повышение комплаенса мочевого пузыря. Этим пациентам к терапии был добавлен антихолинэстеразный препарат (Убретид), в результате чего у 12 больных спустя различное время (2–24 суток) мочеиспускание восстановилось. Были пациенты, у которых после длительного дренирования мочевого пузыря на основании данных комплексного уродинамического обследования выполнялась трансуретральная резекция. У 11 (29,7%) пациентов нормализовать комплаенс мочевого пузыря в короткие сроки не удалось, несмотря на проводимую антибактериальную и противовоспалительную терапию, возник острый уретрит (простатит), данным пациентам была выполнена цистостомия. Однако дальнейшее лечение альфа-1-адреноблокаторами и антихолинэстеразным препаратом (Убретидом) под контролем цистометрии позволило впоследствии восстановить комплаенс мочевого пузыря, что обеспечило успешный результат аденомэктомии. Таким образом, исследование функционального состояния НМП у больных с ишурией явилось основополагающим в выборе тактики лечения [46].
Сочетание спастического сокращения гладкой мускулатуры простатического отдела уретры и повышенного комплаенса детрузора лежит в основе развития острой задержки мочи. Выявленное у больных с ишурией повышение давления в этой области препятствует поступлению первой порции мочи в заднюю уретру, а следовательно, рефлекторному открытию сфинктера мочеиспускательного канала, вследствие чего мочеиспускание становится невозможным. Можно утверждать, что повышение давления в простатическом отделе мочеиспускательного канала связано со стимуляцией альфа-1-адренорецепторов. Применительно к послеоперационной ишурии патогенез выглядит следующим образом. Хирургическое вмешательство, будучи стрессом, приводит к повышению тонуса симпатической нервной системы, увеличению выброса катехоламинов, вследствие чего возрастает стимуляция альфа-1-адренорецепторов задней уретры и предстательной железы. Это может стать причиной возникновения послеоперационной ишурии в сочетании с еще одним фактором патогенеза, наблюдаемым в исследованиях у всех пациентов, – повышением комплаенса детрузора. Следствием высокого комплаенса детрузора становится невозможность сокращения последнего.
Различия в исходном состоянии детрузора являются причиной разнообразных исходов ишурии: от восстановления мочеиспускания после однократной катетеризации до необходимости выполнения цистостомии. Так, у больных, которым выполнялась цистостомия и впоследствии аденомэктомия и биопсия стенки мочевого пузыря, была выявлена гипертрофия гладкой мускулатуры детрузора, в межмышечных пространствах признаки хронического воспаления и фиброза. Пациенты с исходно высоким комплаенсом детрузора и сниженной возбудимостью мочевого пузыря, признаками воспаления и фиброзом в межмышечных пространствах гипертрофированного детрузора при возникновении острой ишурии имеют неблагоприятный прогноз на восстановление мочеиспускания после однократной катетеризации.
Терапия альфа-1-адреноблокаторами в предоперационном периоде снижала частоту развития острой задержки мочи. Так, во второй работе ишурия была зарегистрирована у 2,6% пациентов, получавших альфа-1-адреноблокатор перед оперативным вмешательством и сразу после, и у 19,2% пациентов, не получавших альфа-1-адреноблокатор [46].
В третьем исследовании у больных ДГПЖ с симптомами ГМП после проведения оперативного лечения симптомы наполнения сохраняются достоверно реже при предоперационной терапии М-холиноблокатором, чем при лечении альфа-1-адреноблокатором – 12,5 против 27,5% [47, 49]. Сопоставление двух групп больных по степени снижения выраженности симптомов на основании данных дневника мочеиспусканий показало, что при применении М-холиноблокатора наблюдается уменьшение проявлений симптомов ГМП в большей степени, чем при терапии альфа-1-адреноблокатором. При этом статистически значимый характер носили отличия по показателям частоты недержания мочи и объема мочи при ургентных позывах (р < 0,05). Что касается такого осложнения, как острая задержка мочи, то в обеих сравниваемых группах не было ни одного наблюдения острой задержки мочи в ходе лечения [47].
Выводы
Подтверждена функциональная классификация инфравезикальной обструкции, отражающая не только степень нарушения функции мочевого пузыря, но и степень изменения уродинамики верхних мочевыводящих путей и функциональной способности почек. Сочетание спастического сокращения гладкой мускулатуры простатического отдела уретры и снижения детрузорного давления лежит в основе развития острой задержки мочи.
Для установления окончательного диагноза все пациенты с СНМП, в том числе после оперативного лечения по поводу обструктивных заболеваний НМП, должны пройти тщательное обследование. Точная диагностика особенностей и причин нарушения функции НМП у таких больных помогает в выборе адекватной лечебной тактики. Своевременное выявление уродинамических нарушений, в первую очередь ИВО и гиперактивности детрузора, у больных ДГПЖ имеет важное практическое значение, так как без учета этого фактора существенно ухудшаются функциональные результаты хирургического лечения.
Z.K. Gadzhieva, Yu.G. Alyaev, A.Z. Vinarov
I.M. Sechenov First Moscow State Medical University
Contact person: Zaida Kamaludinovna Gadzhieva, zgadzhieva@ooorou.ru
Introduction. In the majority of patients, impaired urination is caused by mechanical and functional factors. Whereas mechanical obstruction mainly results in obstruction-related symptoms, detrusor overactivity elicits storage symptoms.
Material and Methods. Several research studies performed at the Department of Urology I.M. Sechenov First Moscow State Medical University, were aimed at diagnostics and treatment of various disorders of the lower urinary tract (LUT) in males. In the study 1, there were analyzed medical records from 270 patients with various obstructive LUT diseases. In the study 2, there were examined 37 patients with acute ischuria to investigate LUT functional state during acute ischuria. In the study 3, condition of 80 patients with benign prostatic hyperplasia (BPH) with dominant irritative symptoms were assessed.
Results. In the study 1, it was found that 120 (58.25%) patients with obstructive LUT diseases had detrusor overactivity, 45 (21.85%) – low detrusor compliance, 30 (14.56%) – high detrusor compliance, and 11 (5.34%) – normal detrusor compliance. 64 urodynamics examinations were analyzed in patients after performing transurethral surgery due to obstructive LUT diseases with complicated post-operative period manifested by urine retention or large amount of residual urine. It was found that LUT functional state in 30 (46.9%) patients displayed detrusor overactivity, 19 (29.7%) – increased detrusor compliance, 15 (23.4%) – decreased detrusor compliance. After surgery, functional component of bladder outlet obstruction was remained in 12.5% patients.
In the study 2, all patients were found to have increased detrusor compliance during ischuria. Detrusor pressure was 1–3 (mean 2.6) cm H2O, when bladder contained 500–1870 ml urine. Elevated pressure in the prostatic urethra had a 2.6–3.8 cm plateau shape that ranged from 63 to 166 cm H2O.
In the study 3, patients with BPH having symptoms of overactive bladder received surgical treatment so that storage symptoms remained at significantly lower rate during pre-operative therapy with M-cholinoblocker vs. alpha-1-blockers (12.5 vs. 27.5%).
Conclusions. During the study, functional classification of bladder outlet obstruction reflecting both degree of impaired bladder functioning as well as degree of altered urodynamics in the upper urinary tract and kidney functional capacity was confirmed. Spastic contraction of smooth muscle in prostatic urethra combined with the lowered detrusor pressure underlies developing acute ischuria. Precise diagnostics of specifics and causes of impaired LUT functioning in such patients aids in choosing proper therapeutic strategy. Timely detection of urodynamics disorders primarily bladder outlet obstruction and detrusor overactivity in patients with BPH are of high practical importance, as functional results of surgical treatment may substantially deteriorate without taking this parameter into consideration.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.