количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Омализумаб в терапии тяжелой бронхиальной астмы
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Пульмонология и оториноларингология" № 2 (29)
- Аннотация
- Статья
- Ссылки
- English
В настоящее время применение анти-IgE-терапии (омализумаба) является единственным фенотипспецифическим лечением тяжелой IgE-обусловленной аллергической бронхиальной астмы (БА). В статье проанализированы механизм действия и результаты клинических исследований эффективности и безопасности омализумаба у больных БА. Рассмотрены показания к назначению препарата, его место в современной ступенчатой терапии БА и перспективы применения.

Таблица 1. Определение тяжелой БА для пациентов ≥ 6 лет (согласно рекомендациям ERS/ATS, 2014)
![Таблица 2. Ступенчатая терапия БА по GINA [1]](/upload/resize_cache/iblock/f7e/195_350_1/f7e9d9ae029cbda7f870ae373c314b19.jpg)
Таблица 2. Ступенчатая терапия БА по GINA [1]

Таблица 3. Фенотипы тяжелой БА
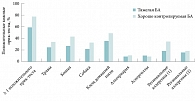
Рис. 1. Распространенность положительных кожных проб с аллергенами у больных тяжелой и легкой/среднетяжелой хорошо контролируемой БА, по результатам исследования ENFUMOSA
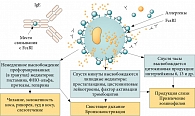
Рис. 2. IgE-обусловленное высвобождение медиаторов из тучной клетки при аллергической реакции
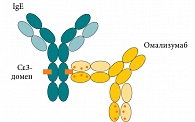
Рис. 3. Омализумаб селективно связывается со свободными молекулами IgE
![Рис. 4. Механизм действия омализумаба при аллергической БА [16]](/upload/resize_cache/iblock/1f4/195_350_1/1f4e8af5d06086f0a44a7fe93d00cf63.jpg)
Рис. 4. Механизм действия омализумаба при аллергической БА [16]
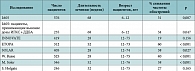
Таблица 4. Результаты систематического обзора восьми рандомизированных плацебоконтролируемых клинических исследований эффективности омализумаба в терапии БА (рандомизировано 3264 пациента, включено в анализ данных 1835 – омализумаб и 1429 – плацебо)
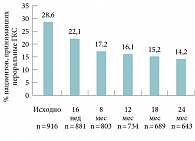
Рис. 5. Изменение пропорции больных БА, получавших терапию системными (пероральными) ГКС, на фоне лечения омализумабом в течение двух лет (n – общее число больных)
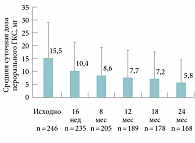
Рис. 6. Динамика снижения средней суточной дозы перорального ГКС (в мг по преднизолону) у пациентов с БА в результате терапии омализумабом на протяжении двух лет (n – число больных, получавших пероральные ГКС)
Современное определение понятия
Распространенность бронхиальной астмы (БА) высока среди всех возрастных групп. По данным эпидемиологических исследований, заболевание встречается у 1–18% лиц в зависимости от региона мира [1].
Большинство пациентов, страдающих БА, хорошо отвечают на традиционную терапию и при соблюдении оптимальной приверженности и правильной техники ингаляции достигают и поддерживают контроль заболевания. Однако у 5–10% больных [2] отмечается тяжелая БА. Как правило, такие пациенты рефрактерны к традиционной терапии, у них высокая частота обострений, незапланированных визитов к врачу, число обращений за неотложной медицинской помощью и госпитализаций. Именно тяжелая, так называемая трудная, БА поглощает 50% всех экономических затрат, предназначенных для заболевания в целом.
Совсем недавно были опубликованы международные рекомендации, разработанные совместно экспертами ERS (European Respiratory Society – Европейское респираторное общество) и ATS (American Thoracic Society – Американское торакальное общество) и посвященные определению, диагностике и лечению тяжелой БА [3]. Эти рекомендации составлены экспертами с позиции GRADE (Grading of Recommendations Assessment, Development and Evaluation [4]) – качества доказательств и силы рекомендаций. Определение тяжелой БА, предлагаемое в указанных рекомендациях, представлено в табл. 1. Как видим, данное определение во многом основывается на предыдущих определениях ATS, ERS, Всемирной организации здравоохранения, но отличается, в частности, тем, что из него исключена «нелеченая тяжелая БА», а также конкретизированы и упрощены критерии отсутствия контроля.
Таким образом, тяжелой считается астма, контроль которой достигается только на максимально высоком уровне терапии, то есть на 4-й или 5-й ступени терапии БА по GINA (табл. 2), или не достигается, несмотря на максимально возможный уровень терапии. Эксперты подчеркивают, что важным условием верификации тяжелой БА является исключение альтернативных диагнозов, низкой приверженности назначенной терапии и неправильной техники ингаляции.
Фенотипы
Тяжелая БА, как, впрочем, и любая БА, неоднородна. Среди пациентов с тяжелой БА можно выделить больных:
- с частыми, остро развивающимися обострениями;
- с фиксированной персистирующей обструкцией бронхов (объем форсированного выдоха за первую секунду (ОФВ₁) < 75% после максимальной бронходилатации), несмотря на традиционную противоастматическую терапию;
- резистентных к глюкокортикостероидам (ГКС).
Анализ неинвазивных маркеров воспаления (клеточный состав индуцированной мокроты, уровень оксида азота в выдыхаемом воздухе (NOex)) у этой категории больных позволяет говорить о различных биологических фенотипах тяжелой БА: эозинофильном, нейтрофильном и малогранулоцитарном. Фенотипы, определяемые типом воспаления, выявляются на основании процентного содержания клеток в индуцированной мокроте: при эозинофильном фенотипе – более 3% эозинофилов, при нейтрофильном – более 61% нейтрофилов, при малогранулоцитарном фенотипе эозинофилы и нейтрофилы обнаруживаются в нормальном процентном соотношении [5].
Идентификация фенотипов БА с помощью кластерного анализа, проведенная в ряде последних исследований, также позволяет выделить несколько фенотипов тяжелой БА [6–8], например:
- раннюю атопическую, характеризующуюся тяжелым течением изначально;
- позднюю с выраженным эозинофильным воспалением и высоким риском развития тяжелых обострений;
- позднюю, ассоциированную с ожирением (табл. 3).
Пациенты с фенотипом тяжелой атопической БА составляют от 40 до 50% всех больных тяжелой БА [6]. По данным анализа W.C. Moore и соавт., проведенного в ходе программы по изучению тяжелой БА в США [9], этот фенотип может развиваться из легкой и среднетяжелой атопической БА. У пациентов с таким фенотипом тяжелой БА широкий спектр сенсибилизации к аллергенам и положительных кожных проб (рис. 1), что было отмечено в ходе Европейской программы по изучению тяжелой БА [7], высокий уровень иммуноглобулина Е (IgE) в крови и отягощенный семейный анамнез в отношении БА. Сегодня именно эта БА является целевым фенотипом для анти-IgE-терапии.
Роль IgE в патогенезе бронхиальной астмы
Антитела класса IgE играют ключевую роль в формировании аллергических реакций, в том числе обусловливают аллергическое воспаление в дыхательных путях при БА. Наследственная предрасположенность к атопии (участие более 50 генов) и воздействие факторов внешней среды (аллергенов, аэрополлютантов, вирусов) приводят к девиации иммунного ответа в сторону преобладания Тh₂-ответа и гиперпродукции IgE-антител против известных и, возможно, неизвестных аэроаллергенов. Аллергенспецифические IgE-антитела фиксируются на высокоаффинных (FcεRI) к ним рецепторах, расположенных на тучных клетках слизистой оболочки дыхательных путей, приводя к сенсибилизации. В результате последующего контакта и перекрестного связывания двух фиксированных на клетке молекул IgE с аллергеном запускается аллергическая реакция. Она характеризуется ранней (секреция гистамина, триптазы, кининов, образование и высвобождение простагландинов и лейкотриенов) и поздней (привлечение в зону воспаления эозинофилов, лимфоцитов, нейтрофилов) фазой ответа, обусловливающей в конечном итоге всю гамму воспалительных изменений в нижних дыхательных путях и приводящей к формированию бронхиальной гиперреактивности (рис. 2).
IgE-антитела не только запускают и поддерживают воспаление в слизистой оболочке дыхательных путей, но и участвуют в ремоделировании бронхиальной стенки при БА. IgE дозозависимо повышает депозицию экстрацеллюлярного матрикса (ЭЦМ) и общего коллагена, особенно I и III типа, что было продемонстрировано на гладкомышечных клетках, выделенных из биопсийного материала стенки бронхов больных БА (по сравнению со здоровыми лицами группы контроля) [8]. При этом предварительная (30 минут) обработка клеток анти-IgE-антителами (омализумаб) предотвращала депозицию ЭЦМ и коллагена.
IgE имеет самый короткий период полувыведения (в свободном состоянии около 2,5 дня) и самое низкое содержание в крови. Пределы концентраций IgE в сыворотке крови здоровых лиц – от 1 до 180 кЕД/л. Однако, связываясь с высокоаффинными рецепторами на тучных клетках, базофилах, клетках Лангерганса, он может персистировать в течение нескольких месяцев. IgE регулирует экспрессию FcεRI на клетках: высокий уровень IgE в сыворотке крови способствует высокой экспрессии рецепторов и активации клеток в ответ на небольшой антигенный стимул, но даже при низкой свободной концентрации IgE в сыворотке крови его биологическая активность в ответ на специфический аллерген может быть очень высокой.
Причинно-следственная связь между IgE и БА подтверждается результатами эпидемиологических исследований, в которых отмечена корреляция между уровнем IgE в крови и частотой развития астмы [10].
Несмотря на разнообразие фенотипов БА, на аллергическую IgE-обусловленную БА приходится более 80% случаев БА у детей и более 50% случаев у взрослых. В формировании БА участвует множество аллергенов, в частности пыльцевые и эпидермальные, клещи домашней пыли, споры плесневых грибов. Клинически значимая сенсибилизация к некоторым аллергенам связана с тяжелой аллергической БА. Например, частота сенсибилизации к плесневым грибам (Cladosporium и/или Alternaria) достоверно возрастает с увеличением тяжести БА. Сенсибилизация к клещам Dermatophagoides pteronyssinus также связана с тяжестью БА [11].
В последние годы появились исследования, посвященные изучению роли IgE при эндогенной БА. В работе J. Mouthuy и соавт. [12] отмечена локальная IgЕ-продукция у больных эндогенной БА (IgE определяли в индуцированной мокроте). При этом часть IgЕ распознает антигены Der p (клеща домашней пыли). Однако эта IgЕ-реактивность не транслируется в клинический ответ при экспозиции с Der p, несмотря на специфичность к главным аллергенам Der p и функциональную активность по отношению к клеткам in vitro. Авторы исследования утверждают, что вторичный сигнал, который запускает IgЕ-обусловленный астматический ответ через FcεRI, отсутствует у больных эндогенной БА.
В недавно опубликованном метаанализе, посвященном связи специфических IgE к энтеротоксину Staphylococcus aureus и БА, было отмечено, что частота сенсибилизации к энтеротоксинам S. aureus (sIgE) у больных БА значимо выше (отношение шансов 2,95 [2,28–3,82]), чем у пациентов группы контроля, и несколько увеличивается с возрастом больных и тяжестью БА [13].
Таким образом, результаты эпидемиологических, экспериментальных и клинических исследований свидетельствуют о центральной роли IgE в формировании и персистенции астматических симптомов в ответ на воздействие аллергенов, что обусловливает целесообразность и эффективность стратегий терапии астмы, направленных на модуляцию IgE-ответа (элиминация аллергена, иммунотерапии аллергенами и анти-IgE-терапии с помощью моноклональных антител (омализумаб)).
Эффективность омализумаба
Механизм действия
Препарат омализумаб (Ксолар®) представляет собой гуманизированные моноклональные антитела к FcεRI(Сε3)-связывающему домену человеческих IgE (рис. 3) [14]. Селективно связываясь со свободными молекулами IgE, омализумаб препятствует их связи со специфическими рецепторами и прежде всего с высокоаффинными рецепторами (FcεRI) на тучных клетках и базофильных лейкоцитах. Это приводит к снижению экспрессии указанных рецепторов на клетках и в конечном итоге к уменьшению секреции медиаторов аллергического воспаления и редукции самого воспаления (рис. 4) [15, 16]. Однако омализумаб не связывается с IgE, уже фиксированными на клетках. В ранних исследованиях омализумаба продемонстрировано подавление ранней и поздней фаз аллергической реакции при незначительном снижении (менее чем на 5%) свободного IgE в сыворотке [17]. Омализумаб способен подавлять синтез новых молекул IgE-антител. Предотвращая связывание IgE с высокоаффинными рецепторами на дендритных клетках, омализумаб угнетает презентацию антигена Т-лимфоцитам [18]. Важным эффектом препарата является способность угнетать эозинофильное воспаление.
Анализ пяти рандомизированных контролируемых исследований (2236 пациентов со среднетяжелой и тяжелой аллергической БА, получавших средние и высокие дозы ингаляционных ГКС (ИГКС)) продемонстрировал, что клинический эффект терапии омализумабом коррелировал со снижением эозинофилии периферической крови и, напротив, клиническое ухудшение коррелировало с нарастанием эозинофилии крови [19]. Сокращение числа эозинофилов, IgE-несущих клеток, а также CD3+, CD4+, CD8+ Т-лимфоцитов в биопсии слизистой оболочки бронхов больных БА, получавших терапию омализумабом, было отмечено в плацебоконтролируемом исследовании [20].
Возможным механизмом уменьшения числа эозинофилов в слизистой оболочке дыхательных путей и периферической крови служат снижение секреции эозинофильных хемотаксических факторов из тучных клеток и базофилов и, возможно, индукция апоптоза эозинофилов. Кроме того, омализумаб уменьшает экспрессию и низкоаффинных рецепторов к IgE (FcεRII), расположенных на эпителиальных клетках и гладкомышечных клетках бронхов, что приводит к снижению секреции такого хемоаттрактанта, как эотаксин [21].
Показано влияние омализумаба на ремоделирование бронхиальной стенки при астме. Выше уже обсуждался in vitro эффект анти-IgE-антител по уменьшению депозиции коллагена и ЭЦМ в гладкомышечных клетках, полученных в результате бронхиальной биопсии больных БА [8]. В 16-недельном исследовании у 30 пациентов с тяжелой персистирующей БА использовали компьютерную томографию для оценки дыхательных путей. Лечение омализумабом (по сравнению с традиционной фармакотерапией) позволило снизить показатели толщины стенки дыхательных путей. Этот эффект сопровождался улучшением легочной функции и уменьшением числа эозинофилов в мокроте [22].
Омализумаб подавляет аллергическое воспаление, уменьшая экспрессию высокоаффинных рецепторов на воспалительных клетках и число эозинофилов в слизистой оболочке дыхательных путей. Продолжительное лечение омализумабом, вероятно, способно редуцировать ремоделирование бронхиальной стенки у больных БА.
Клиническая эффективность
Убедительные свидетельства эффективности омализумаба в лечении пациентов с аллергической БА объединены в двух систематических обзорах [23, 24].
Кохрейновский обзор, опубликованный в 2006 г., включал 14 рандомизированных клинических исследований, проведенных у 3143 детей и взрослых с различной степенью тяжести аллергической БА (легкой, средней и тяжелой). В обзоре показано, что терапия омализумабом снижает частоту обострений БА и увеличивает пропорцию больных, которые смогли снизить дозу ИГКС или отменить их [23].
Систематический обзор, опубликованный в 2011 г., включал восемь клинических исследований (табл. 4) с участием 3429 пациентов (детей и взрослых) со среднетяжелой и тяжелой аллергической БА, принимавших ИГКС [24]. Как видно из табл. 4, в большинстве исследований продемонстрировано значимое снижение частоты обострений БА у больных, получавших омализумаб, по сравнению с пациентами, принимавшими плацебо. Кроме того, терапия омализумабом приводила к увеличению числа больных, которым можно было снизить или отменить ИГКС. Последующий анализ этих исследований показал, что позитивный эффект терапии омализумабом не зависит от возраста пациентов, продолжительности лечения или тяжести заболевания [24].
В исследовании INNOVATE [25] показано существенное повышение качества жизни больных БА, получавших омализумаб, по сравнению с пациентами, принимавшими плацебо. Кроме того, продемонстрировано уменьшение частоты обострений и обращений за медицинской помощью по поводу БА. Причем если cнижение всех клинически значимых обострений по сравнению с группой плацебо составило 26,2%, то частота тяжелых обострений уменьшилась на 50%.
Следует отметить, что доля пациентов, ответивших на лечение омализумабом в ходе исследования INNOVATE, хотя и была достаточно высокой, однако составила менее 100%. Многофакторный анализ результатов этого исследования позволил установить, что единственным предиктором ответа на лечение у пациентов служил высокий исходный уровень IgE. И наоборот, более низкий уровень IgE соответствовал менее выраженной пользе от лечения. Такие параметры, как продолжительность курсов пероральных ГКС, возраст и функция дыхания, не влияли на эффективность лечения. Но даже у больных, не ответивших на терапию, наблюдалась тенденция к снижению частоты клинически значимых обострений астмы. Причем частота обострений на фоне применения омализумаба снижалась независимо от функциональных показателей. Препарат оказался эффективен у пациентов с малообратимой обструкцией бронхов и низкой функцией легких (ОФВ₁ < 50%).
Относительно недавно опубликованное исследование эффективности добавления омализумаба к терапии (высокие дозы ИГКС в комбинации с бета-2-агонистами длительного действия (ДДБА)) тяжелой аллергической БА у 850 подростков и взрослых продемонстрировало снижение частоты обострений БА на 25%, потребности в бронхолитических препаратах, симптомов БА и повышение качества жизни больных, получавших омализумаб на протяжении 48 недель (по сравнению с группой плацебо) [26].
Многообещающие результаты получены при изучении эффективности омализумаба у больных астмой, получавших пероральные ГКС. В исследованиях у подростков, взрослых и детей продемонстрированы спарринговый эффект препарата с ГКС и возможность снижения дозы пероральных ГКС или даже их полной отмены у ряда пациентов [27, 28]. Более наглядно этот эффект продемонстрирован в только что опубликованном анализе исследования eXpeRience [29]. eXpeRience – международный регистр, созданный для оценки результатов лечения омализумабом персистирующей неконтролируемой аллергической БА в реальной клинической практике. В ходе исследования изучали реальные результаты лечения пациентов с неконтролируемой аллергической БА, получавших омализумаб. В частности, оценивали эффект лечения омализумабом с использованием пероральных ГКС в течение двух лет. В исследовании участвовали 943 пациента из 14 стран Европы, Америки и Азии, которые начали лечение омализумабом в течение 15 предшествовавших исследованию недель и продолжали его два года. Пациентов обследовали в начале включения в исследование, через 16 недель, 8, 12, 18 и 24 месяца от начала терапии омализумабом. 263 пациента получали системные (пероральные) ГКС на момент включения в исследование. На рисунке 5 показано, как изменялась пропорция больных, получавших системную терапию пероральными ГКС, на протяжении двух лет лечения омализумабом. На рисунке 6 представлена динамика снижения средней суточной дозы пероральных ГКС у пациентов. Как видно из представленных гистограмм, пропорция больных, которым требовалась поддерживающая терапия системными ГКС, снизилась в два раза к концу второго года лечения омализумабом. Причем существенное снижение числа таких пациентов произошло уже через восемь месяцев терапии. Сокращение средней суточной дозы пероральных ГКС стало возможным через 16 недель лечения, а к концу второго года средняя доза была уменьшена в три раза. В этом исследовании 64,2% больных были расценены врачами как ответившие на лечение омализумабом, то есть проявившие отличный или хороший эффект, 30,7% – как не ответившие, то есть проявившие умеренный или плохой (ухудшение) эффект (5,1% больных не были оценены).
Результаты этого анализа свидетельствуют о том, что значительная часть пациентов, получавших терапию омализумабом, была классифицирована согласно оценке врачей как ответившая на терапию к 16-й неделе лечения, что соответствует результатам рандомизированных исследований.
Ответ на терапию омализумабом может потребовать и более продолжительного периода и проявиться к 32-й неделе, что было продемонстрировано в исследовании J. Bousquet и соавт. [30]. В исследовании убедительно показано, что оценка эффективности омализумаба, проведенная врачом через 16 недель терапии, служит эффективным предиктором дальнейшей эффективности препарата у больного. Вместе с тем 27 из 71 пациента, расцененные как не ответившие на терапию к 16-й неделе, были оценены как ответившие к 32-й неделе. Ответившие (171 пациент) и не ответившие (44 пациента) на лечение омализумабом имели одинаковые характеристики. Некоторое отличие заключалось в уровне IgE, среднее значение которого было ниже у неответивших: 160,7 [33,2–595,5] и 196,4 [30,7–695,0] соответственно.
Исследований эффективности омализумаба, проведенных в условиях реальной клинической практики, много. Они были выполнены в разных странах мира, в том числе в России [31]. Во всех исследованиях отмечено, что омализумаб (Ксолар®) является эффективным препаратом в терапии тяжелой и среднетяжелой (IgE-обусловленной) БА, не контролируемой высокими дозами ИГКС в комбинации с ДДБА или другими препаратами (антилейкотриеновыми препаратами, теофиллинами), у детей (с шести лет), подростков и взрослых. Омализумаб значимо снижает частоту обострений БА, редуцирует симптомы, потребность в бета-2-агонистах короткого действия, системных (пероральных) ГКС, улучшает контроль БА и повышает качество жизни больных.
Безопасность
В настоящее время существует множество исследований и обзоров, посвященных изучению безопасности омализумаба [15, 23, 24, 26, 31–33]. Анализ более 7500 пациентов, включенных в клинические исследования, и 57 300 пациентов, включенных в постмаркетинговый мониторинг безопасности омализумаба, показал достаточно благоприятный профиль безопасности препарата [32]. Наиболее тревожный побочный эффект, связанный с применением омализумаба, – анафилаксия. Частота ее встречаемости в клинических исследованиях достигала 0,14% среди пациентов, принимавших омализумаб, 0,07% – среди пациентов контрольной группы, 0,2% – среди больных, получавших омализумаб, по данным постмаркетинговых наблюдений [32]. Около 60% эпизодов анафилаксии развиваются в первые два часа после инъекции омализумаба, 39% – после первой дозы препарата, 19% – после второй и 10% – после третьей. 24% больных имели анафилактические реакции в анамнезе [34]. В связи с этим рекомендуется информировать пациента о возможном развитии анафилаксии, ее симптомах и получать информированное согласие пациента на лечение омализумабом. Кроме того, целесообразно наблюдать за пациентом в течение двух часов после первых трех инъекций и в течение 30 минут после последующих. Процедурный кабинет, в котором выполняется инъекция препарата, должен быть оснащен противошоковым набором [35, 36].
В процессе клинических исследований омализумаба частота случаев злокачественных новообразований у подростков и взрослых сопоставима с частотой в популяции в целом. Это было продемонстрировано в объединенном анализе 32 рандомизированных плацебоконтролируемых исследований, включавшем 11 459 пациентов, 7789 из которых получали омализумаб [33]. Злокачественные новообразования идентифицированы у 25 пациентов: у 14 из 4254 больных, получавших омализумаб, и у 11 из 3178 больных, получавших плацебо. Первичные злокачественные опухоли характеризовались разнообразием пораженных органов и систем, а также гистологически. Случаев злокачественных новообразований в процессе клинических исследований омализумаба у детей не выявлено. Эти данные позволяют сделать вывод об отсутствии связи между терапией омализумабом и риском развития злокачественных новообразований.
Как известно, антитела класса IgE участвуют в формировании иммунной защиты против гельминтов. Плацебоконтролируемое исследование выявило незначительное численное повышение уровня заболеваемости гельминтозами у пациентов с постоянным высоким риском гельминтных инвазий на фоне приема омализумаба, что не было статистически значимо [37]. Однако пациентам с высоким риском гельминтной инфекции необходимо соблюдать осторожность, особенно при посещении регионов, где распространены эндемичные гельминтные инфекции. В случае развития гельминтоза и отсутствия адекватного ответа на назначенное антигельминтное лечение следует рассмотреть вопрос об отмене омализумаба.
Частота нежелательных побочных эффектов, возникающих на фоне терапии омализумабом, не увеличивается у пожилых пациентов по сравнению с больными молодого возраста [38].
Омализумаб относится к категории В по безопасности у беременных, что означает отсутствие демонстрации риска для плода в исследованиях у животных [39]. Наступление беременности у 27 женщин, получавших омализумаб в процессе клинических исследований, не выявило влияния на наступление преждевременных родов или развитие аномалий у новорожденных [39]. Вместе с тем омализумаб не следует использовать при беременности без явной необходимости, то есть когда польза от его применения очевидно превышает возможный риск. Кроме того, женщина в период приема препарата должна отказаться от грудного вскармливания, поскольку неизвестно, выделяется ли препарат с грудным молоком. Пока омализумаб не рекомендован в терапии астмы у детей младше шести лет.
Показания, режим применения и место в терапии астмы
Омализумаб показан в качестве дополнительной терапии больных (детей с шести лет, подростков и взрослых) тяжелой IgE-обусловленной БА, не контролируемой высокими дозами ИГКС в комбинации с ДДБА. Эти пациенты отмечают частые дневные и ночные симптомы, многократные тяжелые обострения БА. IgE-обусловленная природа астмы должна быть доказана положительными кожными тестами с аллергенами и/или наличием специфических IgE-антител к аллергенам. Кроме того, уровень общего IgE у пациентов должен быть в пределах 30–1500 МЕ/мл. Доза омализумаба (мг) и частота инъекций определяются уровнем IgE (МЕ/мл) и весом пациента (20–200 кг). В инструкции к препарату представлена таблица для расчета его дозы и частоты применения [36]. Омализумаб назначается в дозе 150–375 мг подкожно один раз в две – четыре недели. Согласно ступенчатой терапии БА этот вид лечения рекомендуется на 5-й ступени (табл. 2).
Оценка ответа на терапию омализумабом должна быть сделана врачом через 16 недель лечения, хотя положительный эффект препарата проявляется у некоторых пациентов уже через четыре недели. Комплексная оценка симптомов, контроля по вопросникам (АСТ, АСQ), функциональных показателей легких, частоты обострений БА и качества жизни больных позволяет оценить эффект и принять решение о продолжении или прекращении терапии омализумабом. В настоящее время не выявлены клинические или иммунологические предикторы лучшего ответа на омализумаб у больных аллергической IgE-обусловленной БА. Неизвестна и оптимальная продолжительность лечения омализумабом. Тем не менее снижение дозы через шесть месяцев успешного лечения приводило к возврату симптомов БА [40].
Как показывают результаты ряда исследований, терапия омализумабом может продолжаться несколько лет [41, 42]. Недавно опубликованное исследование продемонстрировало эффективность и безопасность трехлетней терапии омализумабом у 26 взрослых больных тяжелой аллергической БА [43]. Вместе с тем моделирование с учетом обратной связи показало, что выработка IgE с течением времени снижается (примерно на 54% в год) [44].
Согласно прогнозам после отмены препарата выработка IgE будет медленно увеличиваться, возможно, в течение 15 лет. Это позволяет предположить, что терапия омализумабом не обязательно должна быть постоянной.
Перспективы применения омализумаба
Пилотные исследования эффективности омализумаба у больных неатопической БА демонстрируют обнадеживающие результаты: снижается частота обострений и улучшается контроль заболевания. Эти эффекты практически не отличаются от положительных эффектов омализумаба, наблюдаемых у больных атопической БА [45].
Взрослые пациенты, страдающие БА в сочетании с полипозом носа, – еще одна целевая группа для изучения эффективности омализумаба. Выраженное эозинофильное воспаление Тh₂-профиля, локальная IgE-продукция характеризуют этот фенотип БА. В плацебоконтролируемом исследовании эффективности омализумаба (16 недель лечения) с участием 24 пациентов с аллергической и неаллергической БА в сочетании с полипозом носа показано сокращение полипов, подтвержденное эндоскопически и с помощью компьютерной томографии, улучшение симптомов со стороны верхних и нижних дыхательных путей и качества жизни больных [46]. Причем эти эффекты терапии омализумабом проявлялись независимо от наличия аллергии у пациентов, косвенно подтверждая гипотезу локальной продукции IgE.
Заключение
Почти в половине всех случаев тяжелой БА имеет место аллергическая IgE-обусловленная астма, терапия которой на 5-й ступени может быть дополнена омализумабом. Омализумаб (Ксолар®) представляет собой рекомбинантные гуманизированные моноклональные антитела против IgE. Связываясь с свободным IgE, уменьшая экспрессию высокоаффинных рецепторов на воспалительных клетках и снижая число эозинофилов в слизистой оболочке дыхательных путей, омализумаб оказывает выраженный противовоспалительный эффект.
Терапия омализумабом показана больным тяжелой аллергической IgE-обусловленной БА, не контролируемой высокими дозами ИГКС в комбинации с ДДБА или другими препаратами, у детей с шести лет, подростков и взрослых. Омализумаб значимо снижает частоту обострений БА, редуцирует симптомы, потребность в бета-2-агонистах короткого действия, системных (пероральных) ГКС, улучшает контроль БА и повышает качество жизни больных.
1. www.ginasthma.org.
2. Bousquet J., Mantzouranis E., Cruz A.A. et al. Uniform definition of asthma severity, control, and exacerbations: document presented for the World Health Organization Consultation on Severe Asthma // J. Allergy Clin. Immunol. 2010. Vol. 126. № 5. P. 926–938.
3. Chung K.F., Wenzel S.E., Brozek J.L. et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma // Eur. Respir. J. 2014. Vol. 43. № 2. P. 343–373.
4. www.gradeworkinggroup.org.
5. Simpson J.L., Scott R., Boyle M.J., Gibson P.G. Inflammatory subtypes in asthma: assessment and identification using induced sputum // Respirology. 2006. Vol. 11. № 1. P. 54–61.
6. Chung K.F., Bel E.H., Wenzel S.E. Difficult-to-Treat Severe Asthma European Respiratory Society Monograph. 2011. Vol. 51.
7. The ENFUMOSA cross-sectional European multicentre study of the clinical phenotype of chronic severe asthma. European Network for Understanding Mechanisms of Severe Asthma // Eur. Respir. J. 2003. Vol. 22. № 3. P. 470–477.
8. Roth M., Zhong J., Zumkeller C. et al. The role of IgE-receptors in IgE-dependent airway smooth muscle cell remodeling // PLoS One. 2013. Vol. 8. № 2.
9. Moore W.C., Meyers D.A., Wenzel S.E. et al. Identification of asthma phenotypes using cluster analysis in the Severe Asthma Research Program // Am. J. Respir. Crit. Care Med. 2010. Vol. 181. № 4. P. 315–323.
10. Burrows B., Martinez F.D., Halonen M. et al. Association of asthma with serum IgE levels and skin-test reactivity to allergens // N. Engl. J. Med. 1989. Vol. 320. № 5. P. 271–277.
11. Zureik M., Neukirch C., Leynaert B. et al. Sensitisation to airborne moulds and severity of asthma: cross sectional study from European Community respiratory health survey // BMJ. 2002. Vol. 325. № 7361. P. 411–414.
12. Mouthuy J., Detry B., Sohy C. et al. Presence in sputum of functional dust mite-specific IgE antibodies in intrinsic asthma // Am. J. Respir. Crit. Care Med. 2011. Vol. 184. № 2. P. 206–214.
13. Song W.J., Jo E.J., Lee J.W. et al. Staphylococcal enterotoxin specific IgE and asthma: a systematic review and meta-analysis // Asia Pac. Allergy. 2013. Vol. 3. № 2. P. 120–126.
14. Owen C.E. Immunoglobulin E: role in asthma and allergic disease: lessons from the clinic // Pharmacol. Ther. 2007. Vol. 113. № 1. P. 121–133.
15. Thomson N.C., Chaudhuri R. Omalizumab: clinical use for the management of asthma // Clin. Med. Insights Circ. Respir. Pulm. Med. 2012. Vol. 6. P. 27–40.
16. Holgate S.T., Polosa R. Treatment strategies for allergy and asthma // Nat. Rev. Immunol. 2008. Vol. 8. № 3. P. 218–230.
17. Fox H. Anti-IgE in severe persistent allergic asthma // Respirology. 2007. Vol. 12. Suppl. 3. P. S22–28.
18. Novak N., Tepel C., Koch S. et al. Evidence for a differential expression of the FcepsilonRIgamma chain in dendritic cells of atopic and nonatopic donors // J. Clin. Invest. 2003. Vol. 111. № 7. P. 1047–1056.
19. Massanari M., Holgate S.T., Busse W.W. et al. Effect of omalizumab on peripheral blood eosinophilia in allergic asthma // Respir. Med. 2010. Vol. 104. № 2. P. 188–196.
20. Djukanovic R., Wilson S.J., Kraft M. et al. Effects of treatment with anti-immunoglobulin E antibody omalizumab on airway inflammation in allergic asthma // Am. J. Respir. Crit. Care Med. 2004. Vol. 170. № 6. P. 583–593.
21. Fahy J.V. Anti-IgE: lessons learned from effects on airway inflammation and asthma exacerbation // J. Allergy Clin. Immunol. 2006. Vol. 117. № 6. P. 1230–1232.
22. Hoshino M., Ohtawa J. Effects of adding omalizumab, an anti-immunoglobulin E antibody, on airway wall thickening in asthma // Respiration. 2012. Vol. 83. № 6. P. 520–528.
23. Walker S., Monteil M., Phelan K. et al. Anti-IgE for chronic asthma in adults and children // Cochrane Database Syst. Rev. 2006. Vol. 19. № 2. CD003559.
24. Rodrigo G.J., Neffen H., Castro-Rodriguez J.A. Efficacy and safety of subcutaneous omalizumab vs placebo as add-on therapy to corticosteroids for children and adults with asthma: a systematic review // Chest. 2011. Vol. 139. № 1. P. 28–35.
25. Bousquet J., Rabe K., Humbert M. et al. Predicting and evaluating response to omalizumab in patients with severe allergic asthma // Respir. Med. 2007. Vol. 101. № 7. P. 1483–1492.
26. Hanania N.A., Alpan O., Hamilos D.L. et al. Omalizumab in severe allergic asthma inadequately controlled with standard therapy: a randomized trial // Ann. Intern. Med. 2011. Vol. 154. № 9. P. 573–582.
27. Siergiejko Z., Świebocka E., Smith N. et al. Oral corticosteroid sparing with omalizumab in severe allergic (IgE-mediated) asthma patients // Curr. Med. Res. Opin. 2011. Vol. 27. № 11. P. 2223–2228.
28. Brodlie M., McKean M.C., Moss S., Spencer D.A. The oral corticosteroid-sparing effect of omalizumab in children with severe asthma // Arch. Dis. Child. 2012. Vol. 97. № 7. P. 604–609.
29. Braunstahl G.J., Chlumský J., Peachey G., Chen C.W. Reduction in oral corticosteroid use in patients receiving omalizumab for allergic asthma in the real-world setting // Allergy Asthma Clin. Immunol. 2013. Vol. 9. № 1.
30. Bousquet J., Siergiejko Z., Swiebocka E. et al. Persistency of response to omalizumab therapy in severe allergic (IgE-mediated) asthma // Allergy. 2011. Vol. 66. № 5. P. 671–678.
31. Чучалин А.Г., Пашкова Т.Л., Осипова Г.Л., Сучкова Ю.Б. Оценка эффективности и безопасности омализумаба в комплексной терапии больных с тяжелой неконтролируемой атопической бронхиальной астмой в течение 12 месяцев наблюдения // Пульмонология. 2009. № 3. С. 75–80.
32. Corren J., Casale T.B., Lanier B. et al. Safety and tolerability of omalizumab // Clin. Exp. Allergy. 2009. Vol. 39. № 6. P. 788–797.
33. Busse W., Buhl R., Fernandez Vidaurre C. et al. Omalizumab and the risk of malignancy: results from a pooled analysis // J. Allergy Clin. Immunol. 2012. Vol. 129. № 4. P. 983–989.
34. Tan R.A., Corren J. Safety of omalizumab in asthma // Expert Opin. Drug. Saf. 2011. Vol. 10. № 3. P. 463–471.
35. Cox L., Platts-Mills T.A., Finegold I. et al. American Academy of Allergy, Asthma & Immunology/American College of Allergy, Asthma and Immunology Joint Task Force Report on omalizumab-associated anaphylaxis // J. Allergy Clin. Immunol. 2007. Vol. 120. № 6. P. 1373–1377.
36. Инструкция по применению препарата Ксолар.
37. Cruz A.A., Lima F., Sarinho E. et al. Safety of anti-immunoglobulin E therapy with omalizumab in allergic patients at risk of geohelminth infection // Clin. Exp. Allergy. 2007. Vol. 37. № 2. P. 197–207.
38. Korn S., Schumann C., Kropf C. et al. Effectiveness of omalizumab in patients 50 years and older with severe persistent allergic asthma // Ann. Allergy Asthma Immunol. 2010. Vol. 105. № 4. P. 313–319.
39. US Food and Drug Administration. Omalizumab approval history. 2011.
40. Slavin R.G., Ferioli C., Tannenbaum S.J. et al. Asthma symptom re-emergence after omalizumab withdrawal correlates well with increasing IgE and decreasing pharmacokinetic concentrations // J. Allergy Clin. Immunol. 2009. Vol. 123. № 1. P. 107–113.
41. Nopp A., Johansson S.G., Adedoyin J. et al. After 6 years with Xolair; a 3-year withdrawal follow-up // Allergy. 2010. Vol. 65. № 1. P. 56–60.
42. Storms W., Bowdish M.S., Farrar J.R. Omalizumab and asthma control in patients with moderate-to-severe allergic asthma: a 6-year pragmatic data review // Allergy Asthma Proc. 2012. Vol. 33. № 2. P. 172–177.
43. Ozgur E.S., Ozge C., Ilvan A., Naycı S.A. Assessment of long-term omalizumab treatment in patients with severe allergic asthma long-term omalizumab treatment in severe asthma // J. Asthma. 2013. Vol. 50. № 6. P. 687–694.
44. Lowe P.J., Renard D. Omalizumab decreases IgE production in patients with allergic (IgE-mediated) asthma; PKPD analysis of a biomarker, total IgE // Br. J. Clin. Pharmacol. 2011. Vol. 72. № 2. P. 306–320.
45. De Llano L.P., Vennera Mdel C., Alvarez F.J. et al. Effects of omalizumab in non-atopic asthma: results from a Spanish multicenter registry // J. Asthma. 2013. Vol. 50. № 3. P. 296–301.
46. Gevaert P., Calus L., Van Zele T. et al. Omalizumab is effective in allergic and nonallergic patients with nasal polyps and asthma // J. Allergy Clin. Immunol. 2013. Vol. 131. № 1. P. 110–116.
Omalizumab in therapy of severe bronchial asthma
N.M. Nenasheva
Russian medical academy of postgraduate education
Contact person: Natalya Mikhaylovna Nenasheva, 1444031@gmail.com
Nowadays, use of anti-IgE antibodies (omalizumab) represents the only existing phenotype-specific therapy of severe IgE-mediated allergic bronchial asthma (BA). Here, a mechanism of action and results of clinical studies on safety and efficacy of omalizumab in patients with BA are analyzed. Indications for administration of omalizumab, its importance in modern step therapy of BA as well as future perspectives are examined.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.