количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Практика
Оптимизация лечения больных хроническим простатитом
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №4
- Аннотация
- Статья
- Ссылки
В клинике урологии им. Р.М. Фронштейна Первого МГМУ им. И.М. Сеченова было проведено исследование по оценке клинической эффективности применения в лечении хронического бактериального простатита препарата Полиоксидоний, который обладает иммуномодулирующим, детоксицирующим, антиоксидантным и мембраностабилизирующим свойствами.
Результаты показали, что наибольшая эффективность лечения больных хроническим простатитом была достигнута при использовании антибактериальных препаратов в сочетании с Полиоксидонием.
Одним из путей повышения эффективности антибактериальной и противовоспалительной терапии при инфекционно-воспалительных заболеваниях, в том числе и при хроническом простатите, является иммуномодулирующая терапия.
В клинике урологии им. Р.М. Фронштейна Первого МГМУ им. И.М. Сеченова было проведено исследование по оценке клинической эффективности применения в лечении хронического бактериального простатита препарата Полиоксидоний, который обладает иммуномодулирующим, детоксицирующим, антиоксидантным и мембраностабилизирующим свойствами.
Результаты показали, что наибольшая эффективность лечения больных хроническим простатитом была достигнута при использовании антибактериальных препаратов в сочетании с Полиоксидонием.

Таблица 1. Классификация синдрома простатита, разработанная Национальным институтом здоровья
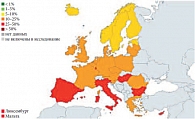
Рис. 1. E. coli: резистентность к фторхинолонам в странах Европы
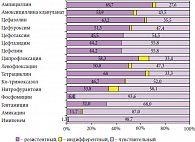
Рис. 2. Pезистентность возбудителей ИМП к антимикробным препаратам

Рис. 3. Свойства фагоцитирующих клеток у больных хроническим простатитом (n = 70)
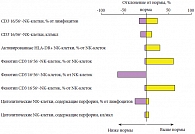
Рис. 4. Свойства NK-клеток у больных хроническим простатитом (n = 70)
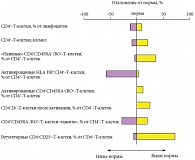
Рис. 5. Свойства CD4+-Т-клеток у больных хроническим простатитом (n = 70)

Рис. 6. Свойства CD8+-T-клеток у больных хроническим простатитом (n = 70)

Таблица 2. Динамика субъективной симптоматики и результаты микробиологического обследования у больных хроническим простатитом после лечения
Хронический простатит и синдром хронический тазовой боли являются серьезной медикосоциальной проблемой, так как эти заболевания приводят к значительному снижению качества жизни мужчин. По мнению ряда авторов, качество жизни пациентов с хроническим простатитом иногда сопоставимо с качеством жизни пациентов с такими заболеваниями, как инфаркт миокарда, стенокардия и болезнь Крона [4]. На сегодняшний день для лечения простатита применяется огромное количество препаратов, включая биологически активные добавки, что отражает низкую эффективность стандартных схем терапии, а также приводит к полипрагмазии. Среди причин неэффективности традиционных схем лечения больных хроническим простатитом можно выделить следующие:
- изменение спектра возбудителей хронического простатита;
- выбор антибактериального или противомикробного препарата, плохо проникающего в предстательную железу, или препарата с низкой антибактериальной активностью;
- короткий курс лечения (менее 4 недель);
- полирезистентная флора. Наиболее распространенными возбудителями хронического простатита были и остаются грамотрицательные бактерии, которые попадают из желудочно-кишечного тракта:
- Escherichia сoli;
- Enterococcus faecium, Еnterococcus faecalis;
- Enterobacter (Еnterobacter aerogenes, Еnterobacter amnigenus, Еnterobacter agglomerans, Enterobacter cloacae);
- Proteus mirabilis, Рroteus vulgaris и Рroteus penneri;
- Klebsiella pneumoniae;
- Pseudomonas aeruginosa;
- Staphylococcus saprophyticus, Staphylococcus aureus;
- Staphylococcus epidermidis.
При длительном анамнезе хронического простатита в план обследования пациента необходимо обязательно включать бактериологическое исследование секрета простаты или спермы с определением антибактериальной чувствительности, что позволит правильно выбрать антимикробный препарат [4]. Одним из путей повышения эффективности антибактериальной и противовоспалительной терапии при инфекционно-воспалительных заболеваниях, в том числе и при хроническом простатите, является иммуномодулирующая терапия. Различные варианты иммунотерапии весьма популярны
среди отечественных специалистов. В настоящее время иммунотропные препараты принято делить на три большие группы: иммуномодуляторы – средства, обладающие иммунотропной активностью, в терапевтических дозах восстанавливающие функции иммунной системы (эффективную иммунную защиту); иммуностимуляторы и иммунодепрессанты – соответственно стимулирующие и подавляющие функции иммунной системы [6].
В комплексной терапии инфекционных заболеваний наиболее целесообразным является применение иммуномодуляторов, которые воздействуют только на измененные параметры, нормализуя показатели иммунной системы. Возможными причинами возникновения иммунных нарушений при хронических инфекционно-воспалительных заболеваниях, таких как простатит, являются, с одной стороны, прямое воздействие токсинов длительно персистирующих микроорганизмов на костный мозг, вилочковую железу, Т- и В-лимфоциты, с другой - длительная антибиотикотерапия, угнетающая иммунную систему. Кроме того, хроническое персистирование инфекционных агентов (в частности, хламидий, уреаплазм, микоплазм) в клеточных структурах урогенитального тракта приводит к изменению структуры эпителия, активации иммунокомпетентных клеток и развитию аутоиммунного воспаления [7].
Многочисленные исследования, посвященные оценке иммунного статуса при инфекционновоспалительных заболеваниях урогенитального тракта, свидетельствуют об изменении иммунологических показателей [8–10]. Полученные данные говорят об отсутствии значимых количественных нарушений иммунитета, а выявляемые функциональные отклонения не всегда являются патологией. В то же время многие авторы отмечают положительное влияние ряда иммунотропных препаратов на общую эффективность лечения данной группы заболеваний. В связи с этим необходимо систематизировать иммунотерапевтические подходы, выработать показания к назначению иммуномодуляторов, а также оценить эффективность иммуномодулирующей терапии.
В клинике урологии им. Р.М. Фронштейна Первого МГМУ им. И.М. Сеченова на протяжении более 10 лет проводятся исследования иммунного статуса при различных заболеваниях. Методика исследования иммунного статуса включает определение более 80 показателей:
- определение субпопуляций лимфоцитов методом проточной цитофлуорометрии с использованием моноклональных антител к различным маркерам лимфоцитов;
- определение функциональной активности Т- и В-лимфоцитов в ответ на активацию фитогемагглютинином (ФГА) и липополисахаридом (ЛПС) в реакции бласттрансформации;
- определение активности естественных киллеров (NK-клеток);
- оценка фагоцитарной способности нейтрофилов;
- определение спонтанной и индуцированной зимозаном и форболмиристатацетатом (ФМА) хемилюминесцентной активности фагоцитов крови;
- определение иммуноглобулинов (IgG, IgM, IgA, IgE) и циркулирующих иммунных комплексов (ЦИК) фотометрическим турбодиметрическим методом.
NK-клетки (или натуральные киллеры) способны лизировать клетки, инфицированные возбудителем, или собственные измененные клетки. Известно 3 фенотипа NK-клеток, различающихся наличием на клеточной поверхности рецепторов к Fc-фрагменту IgG (CD16) и молекул клеточной адгезии NCAM (CD56). Отмечено, что общее число NK-клеток и их цитолитические свойства (которые оценивались по содержанию внутриклеточного перфорина) изменены не были. Однако наблюдалось нарушение соотношения между фенотипами в популяции NK-клеток. Количество NK-клеток с низкой и высокой цитолитической активностью (CD16+56--NK и CD16-56+-NK) оказалось значительно выше верхней границы нормы у 61 и 64% больных соответственно, в то время как число NK-клеток с умеренной цитолитической активностью (CD16+56+-NK), которые составляют большую часть естественных киллеров, было снижено у 64% больных (рис. 4).
Возможно, данные изменения свидетельствуют о нарушении клеточного звена иммунной защиты при хроническом воспалительном процессе нижних мочевых путей. При анализе популяционного состава лимфоцитов не было выявлено количественных изменений, однако имелись изменения функциональных показателей Т-клеток. У 58% обследованных количество активированных CD4+HLA-DR+-Т-лимфоцитов было снижено, что может свидетельствовать о недостаточной антигенной стимуляции Т-клеток. Таким образом, можно предположить, что при длительных вялотекущих инфекциях иммунная система не всегда распознает возбудителя в качестве антигена, вследствие чего возникает недостаточность Т-клеточного звена иммунитета (рис. 5).
Отдельного внимания заслуживают CD4+25+-Т-клетки, популяция которых была увеличена у 73% обследованных нами больных. Эти клетки являются естественными регуляторами или супрессорами активности других Т-клеток, а повышение их количества и активности свидетельствует о наличии у больного интенсивной или продолжительной иммунной реакции, то есть длительного воспалительного процесса. Что касается CD8+-Т-клеток (цитолитические клетки/супрессоры), то у 52% больных регистрировались признаки их активации, что выражалось в повышении количества CD8+CD25+-Т-клеток. При этом дифференцировка CD8+-Т-клеток была замедленной: на фоне повышения количества «наивных» CD8+45RA+-Т-клеток (у 50% больных) количество CD8+28--Т-клеток, «стареющих» после реакции на антиген, было снижено у 48% больных (рис. 6). Данные изменения указывают на наличие длительной иммунной реакции, отражающей хронический воспалительный процесс, и недостаточность Т-клеточного звена иммунитета. Существенных изменений состояния гуморального иммунитета у наших больных выявлено не было. Подводя итог, отметим, что у пациентов с хроническим простатитом отсутствуют значимые количественные нарушения иммунитета. Выявлены функциональные отклонения фагоцитов крови, NK-клеток и Т-лимфоцитов.
В настоящее время на фармацевтическом рынке представлено большое количество различных иммунных препаратов. Многие из них малоэффективны и вызывают ряд побочных явлений, которые затрагивают не только иммунную систему и систему кроветворения, но и оказывают системный токсический эффект [11–14]. В первую очередь это касается бактериальных липополисахаридов и протеогликанов. Несмотря на то что интерфероны тормозят развитие инфекционного процесса, их эффективность в лечении хронического воспаления весьма ограничена. По сути, лечение интерферонами – это заместительная терапия, поэтому интерфероновые препараты приходится применять длительно. Кроме того, индукторы интерферона, в частности циклоферон, приводят к активации выработки интерферона далеко не у всех людей. Около 50% больных реагируют на них очень слабо или вовсе не реагируют [11–14]. Именно поэтому в настоящее время представляется интересным и перспективным изучение новых отечественных синтетических и природных препаратов, разработанных и внедренных в клиническую практику в последнее десятилетие. Одним из таких препаратов является Полиоксидоний.
Положительное действие Полиоксидония проявляется в основных его эффектах – иммуномодулирующем, детоксицирующем, антиоксидантном и мембраностабилизирующем [15]. Иммуномодулирующий эффект Полиоксидония связан с его способностью воздействовать на факторы естественной резистентности: моноциты/макрофаги, нейтрофилы и естественные киллеры, а также на факторы приобретенного иммунитета – гуморального и клеточного. Антиоксидантный эффект Полиоксидония реализуется через удаление из организма различных кислородных радикалов, что уменьшает повреждающее воздействие на ткани и снижает остроту воспалительного процесса [15]. В клинике урологии им. Р.М. Фронштейна Первого МГМУ им. И.М. Сеченова было проведено исследование по оценке клинической эффективности применения Полиоксидония в лечении хронического бактериального простатита.
В это исследование были включены 140 пациентов с хроническим простатитом. Для оценки эффективности иммуномодулирующей терапии Полиоксидонием все больные были разделены на 2 сопоставимые группы в зависимости от применяемых методов терапии. Лечение пациентов простатитом первой – основной – группы (n = 70) проводилось антибактериальным препаратом в течение 28 дней и иммунномодулятором Полиоксидонием, который назначали по 6 мг внутримышечно 1 раз в сутки, первые три инъекции ежедневно, затем через день (всего 10 инъекций). Вторая – контрольная – группа (n = 70) получала только антибактериальные препараты в течение 28 дней. При анализе субъективной и объективной симптоматики определялась заметная положительная динамика в группе больных, получавших Полиоксидоний в сочетании с антибактериальным препаратом. После лечения жалобы полностью отсутствовали у 66 (94,3%) пациентов (табл. 2), у 4 (5,7%) отмечалось уменьшение клинической симптоматики. При монотерапии антибактериальными препаратами у 14 (20%) больных хроническим простатитом в той или иной степени сохранялась субъективная симптоматика. По результатам контрольных обследований были получены следующие итоговые показатели эффективности лечения: в 1-й группе возбудителей не обнаружено у 62 из 70 (88,6%), во 2-й группе – у 51 из 70 пациентов (72,9%). Больным, у которых при контрольном обследовании выявлены инфекции, проводился повторный курс антибактериальной терапии.
Таким образом, наибольшая эффективность лечения больных хроническим простатитом была достигнута в первой группе при использовании антибиотиков в сочетании с иммуномодулятором Полиоксидоний. При исследовании иммунного статуса у больных хроническим простатитом отмечены следующие изменения:
- нормализация количества активированных CD4+25+-T-лимфоцитов (у 62,5% больных);
- увеличение числа больных с нормальным содержанием перфорина в NK-клетках (с 70% до 87,5%) и с нормальным количеством NK-клеток с умеренной цитолитической активностью (с 36% до 75%);
- повышение индекса пролиферации Т-лимфоцитов в ответ на активацию ФГА (нормальное значение было отмечено у 39% больных исходно и 50% больных после лечения);
- повышение фагоцитарного индекса.
1. Nickel J.C. Prostatitis: Evolving management strategies // Urologic Clinics of North America. 1999. Vol. 26. № 4. P. 737–751.
2. Ткачук В.Н., Горбачев А.Г., Агулянский Л.Н. Хронический простатит. Л., 1989.
3. Лопаткин Н.А., Сивков А.В., Аполихин О.И. и др. Хронический простатит: монография на CD-ROM. М.: НИИ урологии МЗ РФ, 2004.
4. Степенский А.Б., Попов С.В., Муфагед М.Л. Диагностика и лечение хронического простатита // Consilium medicum. 2003. Т. 5. № 7. С. 396–401.
5. Лопаткин Н.А., Перепанова Т.С. и др. Рациональная фармакотерапия в урологии. М.: Литтерра, 2006.
6. Хаитов Р.М., Пинегин Б.В. Вторичные иммунодефициты: клиника, диагностика, лечение // Иммунология. 1999. № 1. С. 14–17.
7. Бакулев А.Л., Рубин В.И., Суворов А.П., Слесаренко Н.А. Болезнь Рейтера. Саратов: Изд. Саратовского мед. университета, 1999. С. 44–56.
8. Разумов С.В., Медведев А.А., Чирун Н.В. и др. Роль цитокинов в диагностике хронического простатита // Урология. 2003. № 6. С. 25–28.
9. Алленов С.Н., Иванов О.Л. Иммунологические аспекты применения Полиоксидония в комплексной терапии осложненного урогенитального хламидиоза // Рос. журн. кож. и вен. болезней. 2002. № 2. С. 58–61.
10. Дубенский В.В. Болезнь Рейтера (обзор литературы) // Рос. журн. кож. и вен. болезней. 1999. № 5. С. 26–29.
11. Новиков Д.К., Новикова В.И., Сергеев Ю.В. Иммунотерапия, иммунокоррекция и иммуномодуляция // Иммунопатология. Аллергология. Иммунология. 2002. № 3. С. 7–18.
12. Новиков Д.К., Сергеев Ю.В., Новикова В.И. Характеристика иммунофармакотерапевтических препаратов // Иммунопатология. Аллергология. Иммунология. 2002. № 4. С. 7–27.
13. Манько В.М., Петров Р.В., Хаитов Р.М. Иммуномодуляция: история, тенденции развития, современное состояние и перспективы // Иммунология. 2002. Т. 23. № 3. С. 132–137.
14. Хаитов Р.М., Пинегин Б.В. Основные представления об иммунотропных лекарственных средствах // Иммунология. 1996. № 6. С. 4–9.
15. Петров Р.В., Хаитов Р.М., Некрасов А.В. и др. Полиоксидоний – иммуномодулятор последнего поколения: итоги трехлетнего клинического применения // Аллергия, астма и клиническая иммунология. 1999. № 3. С. 3–6.
Новости на тему
17.02.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.