Оптимизация лечения хронической обструктивной болезни легких у мужчин с андрогенным дефицитом
- Аннотация
- Статья
- Ссылки
- English
Согласно рекомендациям большинства современных консенсусов хроническая обструктивная болезнь легких (ХОБЛ) рассматривается как системное заболевание с различными внелегочными эффектами [1, 2]. Возникающая на фоне ХОБЛ системная гипоксемическая гипоксия способна приводить к анатомо-функциональным нарушениям практически во всех органах и системах.
Современные клинико-эпидемиологические исследования рассматривают легочные проявления ХОБЛ как компонент коморбидной патологии наряду с другими хроническими соматическими заболеваниями (сердечно-сосудистые заболевания, сахарный диабет, остеопороз, саркопения, депрессия, кахексия и пр.), развитие и прогрессирование которых происходят на фоне нарастающей системной гипоксии при ХОБЛ [3–7].
Имеющиеся литературные данные свидетельствуют о более высокой распространенности ХОБЛ среди мужчин по сравнению с женской популяцией (соотношение больных ХОБЛ мужчин и женщин на 1000 населения составляет 9,3 : 7,3). При этом частота ХОБЛ в структуре обращаемости за амбулаторной медицинской помощью составляет 5,3% для мужчин и 1,4% для женщин. Это позволяет характеризовать ХОБЛ как гендерспецифическое заболевание, связанное с ключевыми механизмами, обеспечивающими половые различия, а именно с видом и уровнем половых гормонов [8, 9].
Основными половыми гормонами у мужчин являются андрогены (прежде всего тестостерон, который на 95% синтезируется в клетках Лейдига яичек). Тестикулярная функция у мужчин является высокочувствительной к любой гипоксии, из чего следует, что одной из клинических «масок» ХОБЛ у мужчин можно считать нарушения синтеза и секреции тестикулярного тестостерона. При этом клиническая манифестация андрогенного дефицита, вероятно, может отражать течение ХОБЛ и развиваться по определенному патогенетическому «порочному кругу» [10, 11].
Имеются также патогенетические взаимоотношения ХОБЛ и андрогенного дефицита у мужчин, связанные с частым и иногда бесконтрольным применением глюкокортикостероидов, которые приходится назначать большинству пациентов с тяжелым течением ХОБЛ или с обострениями заболевания. Терапия системными или ингаляционными глюкокортикостероидами в дозе более 1000 мкг/сут усугубляет все проявления андрогенного дефицита у пациентов с ХОБЛ [12–15]. Более того, по данным A. Kamischke и соавт. [16], у всех пациентов, постоянно получающих системные глюкокортикостероиды, уровень тестостерона значимо снижается, тогда как у пациентов с ХОБЛ, не получающих такой терапии, это происходит только в половине случаев.
Формирование ятрогенного гипогонадизма у мужчин способствует более быстрому и выраженному прогрессированию как ХОБЛ, так и практически всей сопутствующей коморбидной патологии [12, 17–21].
Таким образом, у мужчин с ХОБЛ андрогенный дефицит является важнейшим фактором патогенеза заболевания и его соматических и метаболических последствий, что требует оптимизации существующих подходов к диагностике и лечению данной социально значимой патологии [8, 9, 22].
В ряде исследований последних лет установлено, что заместительная гормональная терапия андрогенами у пациентов с ХОБЛ обладает направленным анаболическим локальным и системным действием: восстанавливает массу и силу мышц, способность к выполнению физической нагрузки, а также улучшает функцию внешнего дыхания и стабилизирует течение болезни. Коррекция дефицита андрогенов у мужчин с ХОБЛ улучшает выживаемость больных ХОБЛ и рассматривается как вариант дополнительной патогенетической терапии больных ХОБЛ, особенно на фоне метаболических нарушений и применения глюкокортикостероидов [8, 16, 23–25].
Цель исследования
Целью настоящего исследования явилась оптимизация патогенетической фармакотерапии ХОБЛ у мужчин с андрогенным дефицитом.
Материал и методы
Нами выполнено обследование 776 мужчин в возрасте от 27 до 76 лет (средний возраст 52,8 ± 2,1 лет), поступивших в терапевтические отделения нескольких стационаров с ранее установленным диагнозом ХОБЛ (согласно критериям Глобальной инициативы по диагностике и лечению хронической обструктивной болезни легких (Global Initative for Chronic Obstructive Lung Disease – GOLD) от 2006 и 2008 гг.). Длительность течения заболевания составляла от двух до 15 лет (в среднем 7,6 ± 3,2 лет). Обследование и лечение пациентов с ХОБЛ осуществлялись по разработанной единой схеме (рис. 1).
136 мужчин с ХОБЛ и андрогенным дефицитом (67 пациентов с ожирением и 69 пациентов с дефицитом массы тела) для коррекции андрогенного дефицита получали тестостерона ундеканоат – препарат-депо с замедленным высвобождением действующего вещества. Интервал между первой и второй инъекциями составлял шесть недель, между последующими инъекциями – 12 недель, однократно вводимая доза – 1000 мг.
Эффект препарата оценивали по динамике уровней общего и свободного тестостерона крови, параметрам функции внешнего дыхания, уровню гематокрита, степени остеопороза, мышечной силе и психическому статусу в начале лечения и после года терапии. В течение года лечения тестостерона ундеканоатом также оценивали стабильность течения (по числу обращений за медицинской помощью) и динамику тяжести ХОБЛ (по данным функции внешнего дыхания), а также анализировали за время лечения динамику суточной потребности больных в бронхолитиках и ингаляционных стероидах и толерантность к физической нагрузке.
Скрининг на андрогенный дефицит проводили по стандартной международной анкете – опроснику для определения возрастных симптомов андрогенного дефицита у мужчин (Aging Male Screening – AMS), результаты которого регистрируются в баллах от 17 до 85. Результат 17–26 баллов говорит об отсутствии дефицита андрогенов, 27–36 баллов – о слабовыраженном дефиците, 37–49 баллов – о дефиците, выраженном в средней степени, сумма баллов более 50 – о сильно выраженном андрогенном дефиците.
Андрогенный статус у мужчин с ХОБЛ исследовали лабораторно с использованием радиоиммунных методов: в сыворотке крови определяли уровни общего тестостерона, лютеинизирующего гормона, фолликулостимулирующего гормона, глобулина, связывающего половые стероиды.
Изучали наличие и выраженность состояний, ассоциированных с андрогенным дефицитом и ХОБЛ (остеопороз/остеопения, саркопения, ожирение как компонент метаболического синдрома), а также психологическое состояние и половую (эректильную) функцию пациентов. Психологический статус мужчин с ХОБЛ оценивали в баллах при помощи шкалы депрессии Бека (Beck Depression Inventory – BDI). Для оценки эректильной функции использовался Международный индекс эректильной функции-5 (International Index of Erectile Function-5).
Статистическую обработку результатов осуществляли в программах Microsoft Excel и Statistica (v. 6.0). Использовали вычисление среднего значения, стандартного отклонения, расчет достоверности и критерия Стьюдента. Различия между группами считали достоверно значимыми при p < 0,05.
Результаты
136 мужчин с ХОБЛ и андрогенным дефицитом (67 пациентов с ожирением и 69 пациентов с дефицитом массы тела) для коррекции андрогенного дефицита получали тестостерона ундеканоат согласно схеме исследования.
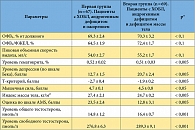
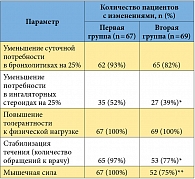
На фоне дополнительного к базовой терапии назначения заместительной андрогенной терапии в первой группе (пациенты с ХОБЛ, андрогенным дефицитом и ожирением) достоверно снизились степень остеопороза и уровень депрессивных расстройств, уменьшился индекс массы тела (р < 0,005). Эти позитивные метаболические процессы происходили на фоне полной нормализации показателей андрогенного статуса (табл. 1). Кроме того, достоверно увеличилась мышечная сила (р < 0,005). Снижение массы тела у пациентов первой группы обусловлено ликвидацией гиперинсулинемии, уменьшением продукции кортизола на фоне стабилизации психоэмоционального статуса, нормализацией липидного обмена в печени, снижением продукции лептина.
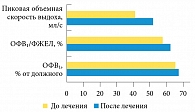
У пациентов первой группы достоверно улучшились показатели функции внешнего дыхания, возросли объем форсированного выдоха за одну секунду (ОФВ₁), соотношение ОФВ₁/форсированная жизненная емкость легких (ФЖЕЛ) (р < 0,005), а также пиковая объемная скорость выдоха (р < 0,001). Улучшение функции внешнего дыхания привело к повышению толерантности к физической нагрузке на фоне снижения массы тела, увеличения общей мышечной массы и силы, а также физической активности пациентов (рис. 2).
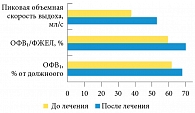
У пациентов с ХОБЛ, андрогенным дефицитом и дефицитом массы тела (вторая группа) также достоверно улучшились показатели функции внешнего дыхания, возросли ОФВ₁ и ОФВ₁/ФЖЕЛ, а также пиковая объемная скорость выдоха (р < 0,005) (рис. 3). Достоверно снизились степень остеопороза и уровень депрессивных расстройств, вырос индекс массы тела. Нормализовались показатели андрогенного статуса. Кроме того, достоверно и более выраженно по сравнению с пациентами первой группы увеличилась мышечная сила (р < 0,005). Это объясняется тем, что андрогены стимулируют миогенез и способствуют наращиванию мышечной массы.
Уровень гематокрита у пациентов обеих группы достоверно не изменился по сравнению с исходными данными. Прирост уровня общего простатического специфического антигена крови за 42 недели андрогенной заместительной терапии в первой группе составил 0,3 нг/мл, а во второй – 0,35 нг/мл, его среднее значение не превысило 4 нг/мл в обеих группах, что является допустимым и отражает высокую безопасность терапии тестостероном для предстательной железы.
В течение всего периода заместительной гормональной терапии в обеих группах пациентов отмечалась выраженная стабилизация клинического течения как основного заболевания – ХОБЛ, так и всей изучаемой коморбидной патологии (табл. 2).
Таким образом, у пациентов с ХОБЛ, получающих заместительную гормональную терапию тестостерона ундеканоатом, через 42 недели от начала лечения снизилась суточная потребность в брохолитиках и ингаляционных глюкокортикостероидах, причем более существенно – у больных с ожирением. У пациентов с ХОБЛ и ожирением коррекция андрогенного дефицита также была более эффективной в отношении увеличения мышечной массы и общей стабилизации течения ХОБЛ.
Терапия тестостероном не приводила к значимому увеличению титров простатического специфического антигена и гематокрита, то есть характеризовалась высокой степенью гематологической и простатической безопасности независимо от метаболических особенностей пациентов с ХОБЛ.
Выводы
Заместительная терапия андрогенного дефицита тестостерона ундеканоатом вне зависимости от исходной массы тела приводит к коррекции дефицита андрогенов, нормализации массы тела, улучшению настроения, увеличению плотности костной ткани и мышечной силы, к улучшению показателей функции внешнего дыхания и пикфлоуметрии. Это сопровождается стабилизацией течения ХОБЛ, увеличением толерантности к физической нагрузке, снижением потребности в бронхолитиках и ингаляционных стероидах.
Полученные результаты доказывают безопасность и эффективность заместительной терапии депо-препаратом тестостерона у пациентов с ХОБЛ и андрогенным дефицитом, что является патогенетическим обоснованием необходимости ранней диагностики и коррекции гипогонадизма у пациентов с ХОБЛ.
Optimal management of chronic obstructive pulmonary disease in male patients with androgen deficiency
A.L. Vertkin1, Kh.A. Shakhmanayev2
1 Moscow state university of medicine and dentistry named after A.I. Evdokimov
2 Karabudakhkent central district hospital, Republic of Dagestan
Contact person: Arkady Lvovich Vertkin, kafedrakf@mail.ru
The study was aimed at the optimization of pathogenetical drug treatment of chronic obstructive pulmonary disease (COPD) in male patients with concomitant androgen deficiency. In androgen deficiency, replacement therapy with testosterone undecanoate resulted in the correction of androgen deficiency, increased bone mineral density and muscular strength, improved mood, spirometry and peak expiratory flow values irrespectively of the baseline patients’ body mass. Those changes were associated with more stable COPD flow, improved exercise tolerance, decreased need for bronchodilators and inhaled corticosteroids. The authors emphasize that androgen deficit may be regarded as a distinct systemic pathogenetical mechanism of COPD progression contributing to worsening of symptoms and negatively influencing the prognosis of COPD and concomitant diseases. Thus, in COPD patients, early diagnosis and treatment of hypogonadism is recommended. Tailored management of COPD should be prescribed with due regard for androgen status of the patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.