Оптимизация ведения пациенток с инфекционно-воспалительными и диспластическими заболеваниями шейки матки перед протоколами вспомогательных репродуктивных технологий
- Аннотация
- Статья
- Ссылки
- English








Введение
Несмотря на широкие возможности репродуктологии и современные достижения эмбриологии, результативность вспомогательных репродуктивных технологий (ВРТ) стабильно сохраняется на определенном уровне. Так, по данным Российской ассоциации репродукции человека 2012 г., частота наступления беременности в циклах ВРТ за последние пять лет практически не изменилась, сохранившись на уровне 30–33% на цикл [1].
Неудачи ВРТ могут быть обусловлены различными причинами. Ситуация усугубляется тем, что к первой беременности, тем более планируемой с помощью ВРТ, женщина приходит, как правило, в возрасте 30–36 лет, зачастую имея целый спектр заболеваний, в том числе гинекологических.
Именно поэтому такое внимание уделяется подготовке и обследованию женщин перед процедурами ВРТ. Задача повышения эффективности проводимых протоколов и достижения беременности в более короткие сроки актуальна и для самой женщины, и для медицинского учреждения, и в целом для государства, поскольку ВРТ относятся к финансово-затратной высокотехнологичной медицинской помощи. Решить поставленную задачу можно путем оптимизации обследования женщин перед проведением ВРТ, в том числе путем своевременного выявления заболеваний шейки матки. Следует отметить, что распространенность заболеваний шейки матки в России очень высока [2]. Например, на осложненную форму эктопии (сочетающуюся с воспалительными заболеваниями шейки матки, эктропионом, различными другими фоновыми процессами) приходится до 82,3% от всех заболеваний шейки матки [2, 3].
На сегодняшний день четкие критерии допуска в программы ВРТ женщин с заболеваниями шейки матки отсутствуют, а кольпоскопия и анализ на вирус папилломы человека (ВПЧ) и вовсе не входят в перечень необходимых обследований. Между тем современные руководства по ведению бесплодных пар предусматривают обязательное прохождение кольпоскопии наряду с цитологическим исследованием соскобов шейки матки [4]. Считается, что шеечный фактор составляет не менее 5% в структуре женского бесплодия [5]. Однако при этом практически нет убедительных данных о связи между заболеваниями шейки матки и положительными исходами протоколов ВРТ, равно как и данных о наступлении беременности в ВРТ-протоколах после того или иного лечения патологии шейки матки.
Любая патология шейки матки, связанная с хроническими воспалительными изменениями, персистенцией вирусов, в частности ВПЧ, условно-патогенных бактерий, может стать причиной изменения количества и качества цервикальной слизи, ее рH, образования антиспермальных антител и в конечном итоге формирования цервикального бесплодия. При проведении ЭКО, интрацитоплазматической инъекции сперматозоида (ИКСИ) и внутриматочной инсеминации успешно минуется такой мощный иммунологический барьер, как цервикальный канал. Однако, по данным некоторых исследователей, вероятность положительного результата ВРТ снижается при обнаружении антиспермальных антител в цервикальной слизи [2].
Роль ВПЧ в развитии субклинических форм поражения шейки матки, дисплазии, рака шейки матки давно доказана и не вызывает сомнений. К тому же имеются сообщения о возможности персистенции ВПЧ в эндометрии, его прямой и/или опосредованной роли в изменении эндометрия, невынашивании беременности, а значит, и его потенциальном влиянии на исход ВРТ.
Все вышеизложенное свидетельствует об актуальности и практической ценности научно-исследовательской работы, направленной на изучение влияния цервикального фактора на результативность программ ВРТ и оптимизацию ведения женщин с инфекционно-воспалительными, ВПЧ-ассоциированными и диспластическими заболеваниями шейки матки перед протоколами ВРТ.
Материал и методы
В исследование было включено 159 пациенток в возрасте 24–44 лет (средний возраст 32,1 ± 4,1 года). Все пациентки непосредственно перед протоколом ВРТ помимо стандартного обследования в обязательном порядке прошли цитологический (мазок из эндо- и экзоцервикса), кольпоскопический (простая и расширенная кольпоскопия), инфекционный скрининг (обследование микробиоценоза влагалища, анализ на скрытые инфекции и ВПЧ методом полимеразной цепной реакции (ПЦР), бактериологический посев на условно-патогенную флору). По результатам обследования были сформированы контрольная группа и группы сравнения А и В (рис. 1).
В контрольную группу (n = 47) были включены пациентки без патологии шейки матки и инфекционно-воспалительных заболеваний генитального тракта, что было подтверждено цитологически, кольпоскопически и лабораторно.
Группу А (n = 74) составили пациентки с инфекционно-воспалительными заболеваниями шейки матки, но не инфицированные ВПЧ. Важно отметить, что в группу сравнения А также были включены пациентки с кольпоскопическими и/или цитологическими изменениями шейки матки, характерными для ВПЧ, но без лабораторного подтверждения наличия ВПЧ в эндоцервикальном мазке.
В группе сравнения А пациентки были разделены на три подгруппы:
1) пациентки, не получавшие никакого лечения перед протоколом ВРТ (n = 40);
2) пациентки, получавшие только консервативное лечение выявленной патологии шейки матки, дисбиоза влагалища, инфекций, передаваемых половым путем, перед протоколом ВРТ (n = 10);
3) пациентки, получавшие консервативную терапию и хирургическое деструктивное лечение патологии шейки матки перед протоколом ВРТ (n = 24).
В группу B (n = 38) вошли пациентки с патологией шейки матки, инфекционно-воспалительными заболеваниями и ВПЧ, лабораторно подтвержденным методом ПЦР. В группе сравнения В пациентки также были разделены на подгруппы:
1) пациентки, не получавшие никакого лечения перед протоколом ВРТ (n = 16);
2) пациентки, получавшие только консервативную терапию, в том числе длительный курс инозином пранобексом в качестве монотерапии выявленного ВПЧ и ВПЧ-ассоциированных заболеваний шейки матки (n = 12);
3) пациентки, получавшие длительный курс терапии инозином пранобексом, на фоне приема которого выполнялось деструктивное лечение патологии шейки матки (n = 10).
Как в контрольной группе, так и в группах А и В проводился сравнительный анализ исходов ВРТ. Положительным результатом считалась визуализация плодного яйца в полости матки. Биохимическая беременность – положительный результат ХГЧ без последующего нарастания его значений и визуализации плодного яйца в полости матки – расценивалась как отрицательный результат. Вне зависимости от удачной или неудачной попытки ВРТ пациентки, которые получали консервативное или консервативное и хирургическое лечение, длительно находились под наблюдением (кольпоскопический, цитологический, лабораторный контроль, в том числе обследование на ВПЧ) (табл. 1).
Статистическая обработка результатов исследования проведена в стандартном приложении Microsoft Office Excel. Основные статистические показатели вычислены при помощи пакета прикладных программ Statistica 8.0. Применялся метод описательной статистики с определением среднего арифметического, среднего квадратического отклонения, средней ошибки, дисперсии и вычисления 95%-ного доверительного интервала. Проверка гипотез о равенстве двух средних производилась с помощью t-критерия Стьюдента, критерия согласия хи-квадрат.
Результаты
За период наблюдения 159 пациенткам было выполнено 172 протокола ВРТ: 74 цикла ЭКО, 58 циклов ИКСИ/ИМСИ, 17 циклов криопереноса, 23 цикла искусственной инсеминации спермой мужа/донора. Всего в исследовании в результате протоколов ВРТ наступило 72 (41,9%) беременности.
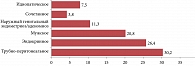
Стаж бесплодия составил 1–18 лет (в среднем 5,6 ± 3,5 года). Структура причин бесплодия выглядела таким образом: бесплодие, обусловленное наружным генитальным эндометриозом/аденомиозом (n = 18, 11,3%), трубно-перитонеальное (n = 48, 30,2%), мужское (n = 33, 20,8%), эндокринное (n = 42, 26,4%), идиопатическое (n = 12, 7,5%), сочетанное бесплодие (n = 6, 3,8%) (рис. 2).
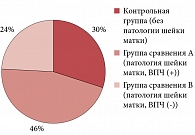
Контрольную группу без заболеваний шейки матки составили 47 (30%) пациенток, группу сравнения А – 74 (46%) пациентки с инфекционно-воспалительными и диспластическими заболеваниями шейки матки, но без лабораторно подтвержденного наличия ВПЧ, группу сравнения В – 38 (24%) пациенток с инфекционно-воспалительными, диспластическими, ВПЧ-ассоциированными заболеваниями шейки матки и ВПЧ, подтвержденным лабораторно (рис. 3).
В контрольной группе в 39 (82,9%) случаях протокол ВРТ завершился маточной беременностью.
Результаты лечения группы сравнения А
В группу сравнения А были включены 74 (46%) женщины с выявленными инфекционно-воспалительными, диспластическими заболеваниями шейки матки, но без ВПЧ. Пациентки с кольпоскопически обнаруженными субклиническими формами ВПЧ-инфекции, не подтвержденной лабораторно, в эту группу не вошли.
Всем пациенткам перед протоколом ВРТ выполнен мазок на онкоцитологию с оценкой его по классификации Бетесда. При этом интраэпителиальное плоскоклеточное поражение низкой степени тяжести (Low-Grade Squamous Intraepithelial – LSIL) было обнаружено у 14 пациенток, интраэпителиальное плоскоклеточное поражение высокой степени тяжести (High-Grade Squamous Intraepithelial Lesion – HSIL) – у двух женщин. В соответствии с международной классификацией кольпоскопических терминов у пациенток группы А превалировала I степень кольпоскопических изменений (слабовыраженные аномальные кольпоскопические картины) (n = 28) (табл. 2).
Спектр инфекционных агентов нижнего генитального тракта в этой группе был разнообразен. У подавляющего большинства (n = 48) женщин в бактериальном посеве отделяемого цервикального канала выявлен рост условно-патогенной флоры в титре 105 КОЕ и более (Escherichia coli, Enterococcus faecium, Enterococcus faecalis, Staphylococcus aureus, Candida spp. и ассоциация этих возбудителей). Кроме того, было обнаружено сочетание условно-патогенной флоры с Ureaplasma urealyticum или Chlamydia trachomatis (n = 10), изолированно Ureaplasma urealyticum (n = 6), Miсoplasma genitalium (n = 2), Gardnerrella vaginalis (n = 2). Таким образом, инфекционно-воспалительные заболевания шейки матки кольпоскопически были подтверждены у всех (100%) пациенток этой группы и лабораторно – у 68 (91,9%).
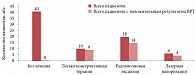
В группе сравнения А в 26 (35,1%) случаях наступила маточная беременность (рис. 4, табл. 3). 40 пациенток перед протоколом ВРТ не получали никакого лечения, при этом ни у одной из них не наступила беременность. 34 пациентки перед протоколом прошли этиотропное антибактериальное, симптоматическое, местное и системное лечение. 24 из них помимо консервативной санации проводилась с их согласия деструкция шейки матки методами радиоволновой эксцизии/конизации или лазерной вапоризации. В 26 случаях у пациенток, прошедших курс консервативного или комбинированного лечения, наступила маточная беременность с первой попытки ВРТ.
Результаты лечения группы сравнения B
Пациентки с лабораторно подтвержденным носительством ВПЧ были выделены в отдельную группу наблюдения – группу сравнения В (n = 38). Абсолютно все из них были инфицированы хотя бы одним высокоонкогенным типом ВПЧ (рис. 5).
В этой группе было помимо ВПЧ обнаруживались Ureaplasma urealyticum и Gardnerella vaginalis – по четыре (10,6%) случая, условно-патогенная флора в высоком титре более 105 КОЕ (Enterococcus faecalis и Escherichia coli) – в восьми (21%) случаях. Кроме того, регистрировались ассоциации ВПЧ с Gardnerella vaginalis и Ureaplasma urealyticum, Gardnerella vaginalis и Enterococcus faecalis в высоком титре более 105 КОЕ в 12 (31,6%) случаях.
Всем пациенткам этой группы перед протоколом ВРТ до лечения выполнен мазок на онкоцитологию с оценкой его по классификации Бетесда (табл. 4). LSIL наблюдалось у 16 пациенток, HSIL – у шести, воспалительно-измененные цитологические мазки (другие реактивные поражения) – у 12 женщин. Кольпоскопически у пациенток группы В превалировала I степень кольпоскопических изменений (слабовыраженные аномальные кольпоскопические картины изменения многослойного эпителия) (n = 20), а также чаще, чем в группе сравнения А (6 и 2 случая соответственно), отмечалась II степень кольпоскопических изменений (выраженные аномальные кольпоскопические картины).
20 пациенткам группы В с их согласия проводилась терапия, направленная на элиминацию ВПЧ, а десять из них кроме консервативной терапии прошли хирургическое лечение ВПЧ-ассоциированных изменений шейки матки. 18 пациенток не получали никакой противовирусной терапии перед протоколом ВРТ.
Известно, что эффективность лечения ВПЧ-ассоциированных заболеваний шейки матки во многом зависит от выбора метода терапии и целесообразности комбинированного (консервативного и хирургического) лечения. Большинство исследователей отмечают неудачу методов локальной деструкции и частые рецидивы ВПЧ-инфекции на фоне иммунодефицита, что обосновывает целесообразность проведения иммунотерапии [6]. Ряд авторов предлагают проводить деструктивное лечение папилломавирусных поражений шейки матки на фоне приема иммунопрепаратов, подавляющих вирус и повышающих иммунный ответ. Разумная иммунокоррекция увеличивает эффективность терапии и снижает вероятность рецидива [5, 7].
Наиболее широкое распространение получили иммуномодуляторы. Эти препараты стимулируют неспецифический иммунитет, усиливают продукцию интерлейкинов, повышая синтез антител, стимулируют хемотаксическую и фагоцитарную активность моноцитов, макрофагов и полиморфно-ядерных клеток. В настоящее время имеется большой выбор препаратов – активаторов иммунитета.
В настоящем исследовании в качестве адъювантной и неоадъювантной терапии перед хирургическим лечением патологии шейки матки и после него, а также в качестве монотерапии нами использовался противовирусный препарат с иммуномодулирующей активностью Изопринозин (действующее вещество – инозин пранобекс). Механизм противовирусного действия Изопринозина связан с ингибированием вирусной РНК и фермента дигидроптероатсинтетазы, участвующего в репликации некоторых вирусов, усилением подавленного вирусами синтеза мРНК лимфоцитов, что сопровождается подавлением биосинтеза вирусной РНК и трансляции вирусных белков, повышает продукцию лимфоцитами обладающих противовирусными свойствами интерферонов альфа и гамма. Кроме противовирусного препарат обладает и иммуномодулирующим свойством за счет комплекса инозина, что повышает его доступность для лимфоцитов.
20 пациенток группы сравнения В, инфицированные ВПЧ, с первого дня менструального цикла принимали Изопринозин по две таблетки (1 г) три раза в день на протяжении 21–28 дней непрерывно. На фоне терапии Изопринозином десяти пациенткам проводилось хирургическое лечение инфекционно-воспалительных и ВПЧ-ассоциированных изменений шейки матки: радиоволновая эксцизия/конизация шейки матки (n = 6), лазерная вапоризация шейки матки с одномоментной или предшествующей петлевой радиоволновой биопсией мини-петлей (n = 4).
Известно, что в среднем эпителизация шейки матки после лазерной или радиоволновой деструкции происходит к 27–30-му дню после операции. Для этих методов характерны незначительная лейкоцитарная инфильтрация, сокращение фазы экссудации и пролиферации, раннее начало эпителизации, а также быстрое отторжение коагуляционной пленки для лазерной вапоризации и отсутствие таковой для радиоволновой хирургии. Однако предшествующий фон: длительные хронические воспалительные изменения в цервиксе, обусловленные микст-инфекцией, персистенция ВПЧ, глубокие, иногда не полностью скорректированные гормональные изменения – не всегда позволяют ожидать быстрой полноценной эпителизации шейки матки после проведенных операций. Это и наблюдалось в данном случае – в группе сравнения В. В этой связи целесообразность назначения в послеоперационном периоде Изопринозина очевидна. На фоне приема Изопринозина благодаря его иммуномодулирующему действию сокращается фаза экссудативного послеоперационного отека, увеличивается тропность антисептических и антибактериальных препаратов к тканям шейки матки, что в конечном счете приводит к полноценной эпителизации здоровым эпителием.
В группе сравнения В в результате протоколов ВРТ наступило 18 (47,4%) беременностей, из них у 16 пациенток, прошедших курс лечения Изопринозином. Примечательно, что в этой группе только четыре пациентки, инфицированные ВПЧ (16-м и 18-м типом), имели латентную форму поражения этим вирусом (кольпоскопически и цитологически ВПЧ-ассоциированные изменения на шейке матке у них отсутствовали), у двоих из них наступила беременность. Десяти пациенткам помимо длительного курса терапии Изопринозином проводилась радиоволновая/лазерная деструкция шейки матки, у шестерых при этом наступила беременность. 18 пациенток с различными типами ВПЧ, клиническими и субклиническими формами этой инфекции не принимали Изопринозин и не согласились на хирургическое лечение, при этом только у двоих из них наступила беременность (рис. 6, табл. 5).
К сожалению, только 11 пациенток, инфицированных ВПЧ и пролеченных Изопринозином, обследовались повторно на ВПЧ непосредственно перед протоколом ВРТ, у семи (63,6%) из них диагностирована полная элиминация вируса через три месяца после лечения Изопринозином.
Обсуждение
Согласно полученным данным, пациенток с инфекционно-воспалительными процессами в шейке матки, включая ВПЧ-инфекцию, в нашем наблюдении было в два раза больше, чем здоровых пациенток. При этом в группах сравнения чаще диагностировались не инфекции, передающиеся половым путем, а выраженные дисбиотические изменения влагалищной микробиоты, в том числе с явлениями экзоэндоцервицитов. Это можно объяснить следствием «ускользания» микроорганизмов – приобретением ими форм персистенции, трудно доступных и для забора, и для улавливания современными реагентами, а также конкурентным взаимодействием, микробиологическим проигрышем условно-патогенной дисбиотической флоре. Высокая частота обнаружения воспалительных изменений шейки матки была также подтверждена цитологически и кольпоскопически. При этом в группах сравнения А и В у таких женщин результативность программ ВРТ была достоверно в два раза ниже (р < 0,05, критерий хи-квадрат). Частота наступления беременности была достоверно выше в группах сравнения среди пациенток, проходивших консервативное и/или хирургическое лечение патологии шейки матки.
Очевидна взаимосвязь результата ВРТ и наличия/отсутствия лечения выявленных заболеваний шейки матки. Так, в группах сравнения А и В маточные беременности наступили в основном у пролеченных пациенток (рис. 7).
Немаловажно, что в обеих группах сравнения превалировали кольпоскопически и цитологически воспалительные заболевания шейки матки (цервициты), LSIL и другие ВПЧ-ассоциированные поражения шейки матки. Даже если женщина не планирует беременность, обнаружение таких патологических изменений требует санации и дифференцированного индивидуального подхода в отношении методов и сроков деструктивного лечения. Известно, что ряд зарубежных и отечественных авторов называет оптимальной активно-выжидательную тактику в отношении LSIL (вплоть до 18–24 месяцев) у молодых и/или планирующих беременность женщин до 35 лет при условии проведения контрольной кольпоскопии каждые шесть месяцев, до тех пор, пока не будут получены доказательства того, что изменения исчезли или прогрессируют [8]. Однако подобной тактики вряд ли можно придерживаться у пациенток с бесплодием, желающих как можно быстрее реализовать репродуктивную функцию. Тем более уже не оспаривается факт признания ВПЧ самостоятельным инфекционным, иммунологическим агентом не только при его нахождении в эпителии цервикса, но и при персистенции вируса в эндометрии. В этой связи особенно актуальны после хирургического лечения патологии шейки матки быстрая реабилитация, качественное заживление, отсутствие рецидивов ВПЧ-связанных и постдеструктивных изменений. В проведенном исследовании это достигалось применением препарата Изопринозин в до-, пери- и послеоперационном периоде у пациенток, которым проводилась деструкция шейки матки, а также в виде монотерапии у пациенток, которые получали только консервативное лечение.
Выводы
Углубленное обследование состояния шейки матки у пациенток с бесплодием перед планируемым протоколом ВРТ – это не просто актуальная тенденция, а реальная возможность своевременно выявить женщин, нуждающихся как минимум в пристальном динамическом наблюдении.
На сегодняшний день золотым стандартом диагностики заболеваний шейки матки по-прежнему остается экономически затратная, но оправданная комбинация кольпоскопического, инфекционного и цитологического скрининига, а также ВПЧ-тестирования. Этот комплекс наиболее информативен и позволяет определиться с дальнейшей тактикой ведения пациенток.
Частое сочетание дисбиотических нарушений с цервицитами и диспластическими состояниями шейки матки свидетельствует о необходимости обследования на наличие дисбиотических сдвигов микробиоты влагалища, а также об их обязательной коррекции. Иначе говоря, инфекционный скрининг – это важная часть обследования и подготовки к протоколу ВРТ.
Только сочетание ВПЧ-инфекции с кольпоскопическими и/или цитологическими изменениями на цервиксе требует активной лечебной тактики.
Изолированное ВПЧ-носительство в современных условиях – редкое явление. В подавляющем большинстве случаев ВПЧ-инфекция сочетается с мико/уреаплазменной и условно-патогенной флорой, что требует активной консервативной терапии. Хирургическое лечение диспластических и ВПЧ-ассоциированных изменений цервикса оправдано в случае, если пациентке предстоит участие в протоколе ВРТ. В условиях отказа пациентки от хирургического лечения ВПЧ-ассоциированной патологии шейки матки или невозможности его проведения возможно назначение помимо стандартной консервативной терапии Изопринозина. Применение Изопринозина обеспечивает полную элиминацию ВПЧ и иммунокоррекцию в условиях сочетания ВПЧ с другими инфекционными агентами.
Состояние шейки матки вне и во время беременности, а также ее нормальное функционирование во время родовой схватки – один из маркеров репродуктивной состоятельности женщины. Вот почему оптимизация обследования и лечения пациенток с инфекционно-воспалительными заболеваниями шейки матки, а также их диагностика приобретает немаловажное значение и потенциально является резервом снижения репродуктивных потерь при проведении ВРТ.
N.A. Tatarova, Ye.A. Pustynnaya, I.V. Milichenko
North-Western State Medical University named after I.I. Mechnikov
The Pushkin Region Women’s Clinic (Pushkin)
Contact person: Yekaterina Aleksandrovna Pustynnaya, katpust@yandex.ru
Virtually no data regarding a link between cervical diseases and negative outcomes of using assisted reproductive technologies (ART) as well as an impact from treating cervix on efficacy of ART are available in scientific literature. We investigated outcomes from using ART in females with infectious and inflammatory cervical diseases. It was demonstrated that cervical pathology may be a co-factor of unfavorable outcome after applying ART protocols. In connection with this, the authors consider relevant to thoroughly examine and optimize methods and timeframe of treating cervical pathologies to increase efficacy of ART protocols.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.