Оценка эффективности и безопасности применения препарата Экоклиндин при бактериальном вагинозе
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Открытое многоцентровое наблюдательное проспективное клиническое исследование было проведено в женских консультациях, медицинских центрах Москвы и Екатеринбурга. Группу опытного препарата (Экоклиндин) составили 40 пациенток с верифицированным клинически и лабораторно (на основании теста Фемофлор-16) диагнозом «другие невоспалительные болезни влагалища» с доминированием анаэробных бактерий (БВ), получавших интравагинально в суппозиториях препарат Экоклиндин (клиндамицин 100 мг) один раз в день в течение трех дней. Группу сравнения (препарат Клиндацин) представляли 20 пациенток с аналогичным диагнозом, получавших интравагинально в суппозиториях препарат Клиндацин (клиндамицин 100 мг) один раз в день в течение трех дней. Клинико-лабораторную эффективность, переносимость препарата и комплаентность пациенток оценивали через 4 и 18 + 3 дня от начала терапии.
Результаты. В результате терапии БВ с применением препарата Экоклиндин наблюдалась эрадикация анаэробных возбудителей у 97,5% пациенток, а при использовании препарата Клиндацин – у 95,0%, что продемонстрировало более высокую клиническую эффективность препарата Экоклиндин.
Наибольшая приверженность терапии отмечалась на фоне применения препарата Экоклиндин у 97,5% пациенток, что связано с минимальным количеством возникших нежелательных явлений в 2,5% случаев. При этом приверженность терапии препаратом Клиндацин отмечалась у 90,0% пациенток, что обусловлено возникшими нежелательными явлениями в 10,0% случаев.
По результатам протокола исследования вагинальной микробиоты в ПЦР-РВ (тест Фемофлор-16), на 18 + 3 день от начала лечения пациенток с абсолютным и условным нормоценозом в группе препарата Экоклиндин насчитывалось 97,5%, что свидетельствует о преобладании лактобацилл в вагинальном микробиоценозе. В группе препарата Клиндацин таковых было 90%, причем у 10% из них сохранялся умеренный дисбиоз без восстановления лактобациллярной флоры (р = 0,002).
Наличие лактобациллярной флоры в количестве более 80% общей бактериальной массы (критерий нормоценоза) через 18 дней после лечения препаратом Экоклиндин выявлено у 87,5% пациенток, что значительно больше, чем в группе лечения препаратом Клиндацин, – 45% пациенток. Данный феномен можно объяснить влиянием лактулозы, входящей в состав препарата Экоклиндин.
Заключение. Полученные результаты свидетельствуют о более высокой клинической эффективности, безопасности, положительном влиянии на лактобациллы, высокой комплаентности и снижении рецидивирования БВ после применения препарата Экоклиндин по сравнению с препаратом Клиндацин, что позволяет рекомендовать препарат Экоклиндин для применения в клинической практике при БВ.
Материал и методы. Открытое многоцентровое наблюдательное проспективное клиническое исследование было проведено в женских консультациях, медицинских центрах Москвы и Екатеринбурга. Группу опытного препарата (Экоклиндин) составили 40 пациенток с верифицированным клинически и лабораторно (на основании теста Фемофлор-16) диагнозом «другие невоспалительные болезни влагалища» с доминированием анаэробных бактерий (БВ), получавших интравагинально в суппозиториях препарат Экоклиндин (клиндамицин 100 мг) один раз в день в течение трех дней. Группу сравнения (препарат Клиндацин) представляли 20 пациенток с аналогичным диагнозом, получавших интравагинально в суппозиториях препарат Клиндацин (клиндамицин 100 мг) один раз в день в течение трех дней. Клинико-лабораторную эффективность, переносимость препарата и комплаентность пациенток оценивали через 4 и 18 + 3 дня от начала терапии.
Результаты. В результате терапии БВ с применением препарата Экоклиндин наблюдалась эрадикация анаэробных возбудителей у 97,5% пациенток, а при использовании препарата Клиндацин – у 95,0%, что продемонстрировало более высокую клиническую эффективность препарата Экоклиндин.
Наибольшая приверженность терапии отмечалась на фоне применения препарата Экоклиндин у 97,5% пациенток, что связано с минимальным количеством возникших нежелательных явлений в 2,5% случаев. При этом приверженность терапии препаратом Клиндацин отмечалась у 90,0% пациенток, что обусловлено возникшими нежелательными явлениями в 10,0% случаев.
По результатам протокола исследования вагинальной микробиоты в ПЦР-РВ (тест Фемофлор-16), на 18 + 3 день от начала лечения пациенток с абсолютным и условным нормоценозом в группе препарата Экоклиндин насчитывалось 97,5%, что свидетельствует о преобладании лактобацилл в вагинальном микробиоценозе. В группе препарата Клиндацин таковых было 90%, причем у 10% из них сохранялся умеренный дисбиоз без восстановления лактобациллярной флоры (р = 0,002).
Наличие лактобациллярной флоры в количестве более 80% общей бактериальной массы (критерий нормоценоза) через 18 дней после лечения препаратом Экоклиндин выявлено у 87,5% пациенток, что значительно больше, чем в группе лечения препаратом Клиндацин, – 45% пациенток. Данный феномен можно объяснить влиянием лактулозы, входящей в состав препарата Экоклиндин.
Заключение. Полученные результаты свидетельствуют о более высокой клинической эффективности, безопасности, положительном влиянии на лактобациллы, высокой комплаентности и снижении рецидивирования БВ после применения препарата Экоклиндин по сравнению с препаратом Клиндацин, что позволяет рекомендовать препарат Экоклиндин для применения в клинической практике при БВ.


Введение
Бактериальный вагиноз (БВ) – полимикробное дисбиотическое заболевание, при котором резко уменьшается количество Lactobacillus spp. и увеличивается количество вагинальных факультативных и облигатных анаэробов и микроаэрофилов (Gardnerella vaginalis, Peptostreptococcus, Clostridiales spp., Prevotella spp., Bacteroides, Fusobacterium, Veillonella, Eubacterium, Atopobium vaginae, Mobiluncus spp., Megasphaera, Leptotrichia spp., Sneathia spp., Mycoplasma hominis, Ureaplasma urealyticum, Streptococcus viridians) [1, 2]. Распространенность БВ среди женщин репродуктивного возраста достигает 35%, среди пациенток с инфекциями, передаваемыми половым путем, – 60% [3]. Ведущая роль в этиопатогенезе БВ отводится G. vaginalis, A. vaginae, Prevotella bivia [4]. Следует отметить, что в норме среди 40 видов микроорганизмов, контаминирующих влагалище, облигатные и факультативные анаэробные, аэробные и микроаэрофильные бактерии занимают лишь 10–15% биотопа [5]. При этом концентрация во влагалище аэробов в десять раз ниже, чем анаэробов [6]. Однако при вторичных иммунодефицитных состояниях на фоне размножения анаэробных микроорганизмов маркерные метаболиты БВ усугубляют иммунные дисфункции, препятствуя развитию воспаления, чем и объясняется отсутствие лейкоцитарной реакции при БВ [7]. Важно, что доминирующая при БВ G. vaginalis способствует формированию сцепленной полимикробной биопленки, что ассоциируется с последующим затяжным течением процесса, склонностью к его хронизации, повышенной вероятностью диссеминации возбудителей, резистентностью к традиционной терапии [8]. Защелачивание вагинального содержимого и иммунодефицитные состояния способствуют последующей активации персистирующих вирусных инфекций, особенно папилломавирусных [9]. На этом фоне значительно возрастает риск развития эндоцервикальных неоплазий, а также воспалительных заболеваний органов малого таза с возникновением эндометриальных и овариальных дисфункций, предгестационных и гестационных осложнений, перинатальной инфекционной патологии беременных и новорожденных [10–12].
Проблема фармакотерапии БВ остается актуальной в силу высокой распространенности БВ среди женщин репродуктивного возраста, риска возникновения на этом фоне эндометриальных и цервикальных дисфункций, высокой частоты рецидивов после проведения стандартной терапии. В соответствии с клиническими рекомендациями, в схему лечения БВ включаются препараты группы нитроимидазолов, клиндамицин [13, 14]. Клиндамицин высокоэффективен при БВ. Однако его влияние на лактобактерии с дальнейшим частым рецидивированием анаэробного дисбиоза и резистентностью к стандартной терапии поставило клиническую практику в тупик [15, 16]. Парадигмой терапевтического подхода стало усовершенствование препарата клиндамицин с включением в его состав вспомогательного вещества лактулозы [17]. Использование лактулозы в качестве компонента препарата обусловлено ее свойствами: дисахарид лактулоза наиболее широко и специфически стимулирует и модулирует активность вагинальных лактобацилл, особенно L. crispatus, и, что важно, не стимулирует рост микроорганизмов БВ или C. albicans. Лактулоза не оказывает раздражающего действия на слизистую оболочку, не всасывается в системный кровоток через слизистую оболочку половых путей, не вызывает привыкания и может использоваться в течение продолжительного периода времени. Снижая уровень рН, лактулоза через систему интерлейкинов стимулирует клеточное и гуморальное звенья иммунитета, подавляет рост потенциально патогенных бактерий, таких как Clostridium spp. и Escherichia coli [18, 19].
Цель – оценить эффективность, безопасность и влияние на уровень лактобацилл влагалища препарата Экоклиндин (МНН клиндамицин), суппозитории вагинальные 100 мг (АО «АВВА РУС», Россия), а также приверженность пациенток с БВ терапии.
Материал и методы
Открытое наблюдательное исследование эффективности и безопасности применения препарата Экоклиндин (МНН клиндамицин) в параллельных группах проведено в медицинских центрах Москвы и Екатеринбурга. Обследовано и пролечено 40 пациенток репродуктивного возраста (18–45 лет) с БВ. Обследование включало в себя сбор анамнеза, анализ течения заболевания, общеклиническое исследование, гинекологический осмотр. Для уточнения клинико-лабораторной диагностики БВ применяли критерии Амселя: рН влагалища, количество ключевых клеток по данным микроскопического исследования мазков из влагалища, показатели аминотеста, серые выделения с неприятным запахом. Молекулярно-биологическое исследование вагинальной микробиоты осуществлялось методом ПЦР с детекцией результатов в режиме реального времени и использованием реагентов Фемофлор-16 (ООО «НПО ДНК-Технология»). Оценка микробиоценоза проводилась на основании технологии по применению теста Фемофлор-16:
- нормоценоз (абсолютный нормоценоз) – вариант биоценоза, при котором доля нормофлоры в его составе превышает 90%, количество Ureaplasma spp., Candida spp. менее 104 ГЭ/мл;
- условный нормоценоз – вариант биоценоза, при котором доля нормофлоры в его составе превышает 90%, количество Ureaplasma spp., Candida spp. более 104 ГЭ/мл;
- умеренный (аэробный или анаэробный) дисбиоз – вариант биоценоза, при котором доля лактобактерий в его составе определяется в пределах 20–80%, увеличена доля аэробов или анаэробов;
- выраженный (аэробный, анаэробный или смешанный) дисбиоз – вариант биоценоза, в составе которого доля аэробов или анаэробов превышает 20%, а доля лактобактерий менее 20% [20].
Пациентки включались в исследование исходя из критериев включения, невключения и исключения, без рандомизации.
Критерии включения:
- возраст от 18 до 45 лет включительно;
- клинически и лабораторно верифицированный БВ;
- отрицательный тест на беременность на момент скрининга;
- согласие на использование надежных методов контрацепции на протяжении всего исследования;
- информированное согласие.
Критерии невключения:
- беременность и период грудного вскармливания;
- воспалительные заболевания органов малого таза;
- острые и хронические воспалительные заболевания органов и систем организма;
- тяжелые, декомпенсированные или нестабильные соматические заболевания;
- неспособность пациентки выполнять процедуры исследования.
Критерии исключения из исследования:
- нарушение режима применения лекарственных препаратов;
- отказ от проведения запланированных протоколом исследований;
- развитие аллергических реакций на применение исследуемого лекарственного препарата.
Группу опытного препарата (ОП) Экоклиндин составили 40 пациенток, которым с первого дня после установления диагноза «невоспалительная болезнь влагалища» с доминированием анаэробных бактерий (БВ) был назначен препарат Экоклиндин (клиндамицин 100 мг), суппозитории вагинальные, один раз в день в течение трех дней.
Группу препарата сравнения (ПС) Клиндацин представляли 20 пациенток, которым с первого дня после установления диагноза «невоспалительная болезнь влагалища» с доминированием анаэробных бактерий (БВ) был назначен препарат Клиндацин (клиндамицин 100 мг), суппозитории вагинальные, один раз в день в течение трех дней.
Исследование включало несколько этапов: скрининг, назначение терапии (день 0), активное лечение (три дня), контроль излечения (день 4 + 1, 18 + 3, 30 + 3).
Проводилась оценка нежелательных явлений (НЯ) (через четыре дня после назначения терапии) и приверженности терапии по пятибалльной шкале.
Статистическую обработку данных осуществляли с помощью программного пакета SPSS STATISTICS v. 27.0. Для количественных данных с нормальным распределением применяли такие показатели, как N, M ± m, P ± mр, δ, где N – число наблюдений, М – среднее арифметическое, m – ошибка средней арифметической (ошибка репрезентативности), Р – относительный показатель (%), mр – ошибка репрезентативности относительного показателя. В качестве меры центральной тенденции количественных признаков была выбрана медиана Me, а в качестве интервальной оценки – 25-й и 75-й квартили, поскольку исследуемые выборки не подчинялись закону нормального распределения. Достоверность различий проверялась с помощью двустороннего критерия Фишера (при сравнении данных по частоте выявления) и критерия Манна – Уитни (для непараметрических данных) при уровне значимости (α) 0,05, критерия χ2 Пирсона с поправкой Йейтса (для количественных признаков, непараметрических данных). Критический уровень значимости при проверке статистических гипотез в данном исследовании p < 0,05.
Результаты
Всего в исследование на основании критериев включения и исключения было включено 60 пациенток репродуктивного возраста с верифицированным клинически и лабораторно (по данным бактериоскопического исследования и теста Фемофлор-16) диагнозом «невоспалительная болезнь влагалища» с доминированием анаэробной флоры (БВ). Средний возраст пациенток группы ОП (Экоклиндин) составил 28,5 [22,1 ± 34,3] лет, группы ПС (Клиндацин) – 29,2 [22,9 ± 35,1] лет (р = 0,462).
Обследованные и пролеченные пациентки были сопоставимы по возрасту, паритету, наличию гинекологической и экстрагенитальной патологии. У всех обследованных имелись жалобы. Так, 39 (97,5%) пациенток группы ОП (Экоклиндин) и 19 (95,0%) пациенток группы ПС (Клиндацин) указывали на жидкие серые выделения из половых путей с неприятным запахом. Значительная часть пациенток предъявляла жалобы на запах (75,0 и 75,0% в группах ОП и ПС соответственно), зуд (17,5 и 15,0% соответственно) и жжение (20,0 и 20,0% соответственно). Межгрупповые различия до терапии в отношении предъявляемых жалоб были незначимы по всем изучаемым показателям: выделения, запах, зуд, жжение (р = 0,944, р = 0,972, р = 0,941, р = 0,942 соответственно). Через четыре дня после лечения практически все пациентки обеих групп не предъявляли жалоб, у одной пациентки группы ОП (Экоклиндин) и одной пациентки группы ПС (Клиндацин) остались жалобы на незначительные выделения. Межгрупповые различия недостоверны. Это характеризует клиндамицин как препарат базовой терапии с хорошим эффектом в соответствии с клиническими рекомендациями [13, 14] (табл. 1).
Анализ динамики клинических проявлений продемонстрировал значительные изменения в обеих группах, но межгрупповые различия по параметрам «серые жидкие выделения» и «гиперемия вагинального эпителия» после проведенной терапии были статистически недостоверными (р = 0,843 при χ2 =1,164 и р = 0,935 при χ2 = 2,259 соответственно).
При бактериоскопическом обследовании до терапии мазок на флору показал отсутствие лактобацилл у 15 (37,5%) и 8 (40%) пациенток групп ОП (Экоклиндин) и ПС (Клиндацин) соответственно (р = 0,846 при χ2 = 2,132). У 97,5 и 95,0% пациенток групп ОП (Экоклиндин) и ПС (Клиндацин) соответственно до терапии лейкоцитарный профиль представлен в незначительном количестве (р = 0,932 при χ2 = 1,128). Ключевые клетки обнаружены у 47,5 и 45,0% пациенток групп ОП (Экоклиндин) и ПС (Клиндацин) соответственно (р = 0,813 при χ2 = 1,243).
После лечения в группе ОП (Экоклиндин) при контрольном осмотре через четыре дня от начала лечения, согласно результатам бактериоскопического исследования, ключевые клетки не обнаружены у 40 (100%) пациенток, лактобациллярная флора присутствовала в незначительном количестве у 29 (72,5%) пациенток, лейкоциты в мазке представлены в незначительном количестве (до 5–10) у всех пациенток.
После лечения в группе ПС (Клиндацин) при контрольном осмотре через четыре дня от начала лечения, согласно результатам бактериоскопического исследования, ключевые клетки не обнаружены у 20 (100%) пациенток, однако лактобациллярная флора присутствовала в незначительном количестве лишь у 8 (40%) пациенток, что значительно (на 32,5%) отличалось от аналогичного показателя в группе ОП (Экоклиндин) (р = 0,003 при χ2 = 10,526). Это может свидетельствовать о выраженном влиянии лактулозы в составе препарата Экоклиндин на сохранение лактобациллярной флоры. Полученные данные согласуются с результатами ряда зарубежных исследований [21]. Лейкоциты в мазке после лечения представлены в незначительном количестве (до 5–10) у всех пациенток.
Оценка вагинального микробиоценоза на основании теста Фемофлор-16 до назначения терапии продемонстрировала доминирование умеренного и выраженного анаэробного дисбиоза в обеих группах. Через две-три недели после терапии препаратом Экоклиндин у абсолютного большинства пациенток (39 (97,5%)) отмечался абсолютный и условный нормоценоз, тогда как после лечения препаратом Клиндацин абсолютный и условный нормоценоз выявлен у 18 (90%) пациенток. При этом у 2 (10%) больных сохранялся умеренный дисбиоз без восстановления лактобациллярной флоры (р = 0,002 при χ2 =11,364).
Частота встречаемости и спектр микроорганизмов, согласно тесту Фемофлор-16 до исследования и после терапии, представлены в табл. 2.
Как показал анализ спектра возбудителей, среди доминирующих анаэробных возбудителей у абсолютного большинства пациенток выявлена G. vaginalis в сочетании с P. bivia, на втором месте – Eubacterium spp. Не менее значимую роль среди облигатных анаэробов имел комплекс Megasphera spp. + Veillonella spp. + Dialister spp., что согласуется с данными ряда исследований БВ [22].
Полная элиминация большинства анаэробных возбудителей отмечалась после лечения как препаратом Экоклиндин, так и препаратом Клиндацин. Разница между группами несущественная (р = 0,894). Через 18 дней после лечения обнаружено незначительное количество аэробных (факультативных анаэробных) микроорганизмов с незначительными различиями между группами. Среди анаэробных возбудителей в небольшом количестве выявлены Eubacterium spp. и комплекс Mobiluncus spp. + Corynebacterium spp. По частоте встречаемости значимых различий между группами не установлено (р = 0,835). Обращает на себя внимание рост грибов рода Candida в группе ПС (Клиндацин). Между тем в группе ОП (Экоклиндин) наблюдалось снижение количества дрожжеподобных грибов, что может объясняться влиянием пребиотика лактулозы, входящего в состав препарата Экоклиндин, и не противоречит проведенным клиническим исследованиям [23, 24]. Пребиотик лактулоза способствует увеличению количества собственных генетически «родных» лактобацилл и препятствует избыточному размножению грибов рода Candida [24].
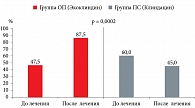
При анализе полученных результатов обращает на себя внимание достоверная и значимая разница в среднем количестве лактобактерий до и после лечения препаратами Экоклиндин и Клиндацин (р = 0,0002). До начала лечения лактобациллярная флора в количестве более 80% от общей бактериальной массы выявлена у 19 (47,5%) пациенток группы ОП (Экоклиндин) и у 12 (60%) пациенток группы ПС (Клиндацин). Следует отметить, что лактобациллярная флора в количестве более 80% общей бактериальной массы через 18 дней после лечения выявлена у 35 (87,5%) пациенток группы ОП (Экоклиндин). В группе ПС (Клиндацин) данный показатель имел место у 9 (45%) пациенток. Разница – 42,5%, р = 0,0002 при χ2 = 11,387 (рисунок).
Данный феномен может быть связан с пребиотическим влиянием лактулозы, входящей в состав препарата Экоклиндин, на лактобациллярную флору влагалища.
Клинические субъективные и объективные признаки БВ, по данным осмотра и бактериоскопического обследования при динамическом наблюдении (через 30 дней от начала терапии), отсутствовали у абсолютного большинства пациенток. Однако в группе ОП (Экоклиндин) таких пациенток насчитывалось 37 (92,5%). У трех больных отмечались признаки снижения лактобациллярной флоры с наличием незначительного количества ключевых клеток (по данным бактериоскопического исследования), без воспалительной реакции, на фоне вторичного иммунодефицитного состояния, что расценивалось как рецидивирование БВ с повторным назначением лечения. В группе ПС (Клиндацин) субъективные и объективные признаки БВ отсутствовали у 16 (80,0%) пациенток, что значительно ниже показателя в группе ОП (Экоклиндин) (р = 0,0002 при χ² =12,138) и свидетельствует о более высокой клинической эффективности препарата Экоклиндин. В группе ПС (Клиндацин) рецидивирование БВ зарегистрировано в четырех случаях с последующим повторным назначением лечения.
Частота развития НЯ на фоне приема препарата Экоклиндин не превышала 2,5% (единичный случай неприятных ощущений во влагалище), что отличалось от результатов на фоне приема препарата Клиндацин – 2 (10,0%) случая, р = 0,001 (жжение после введения препарата).
Пациенток, не завершивших курс лечения из-за непереносимости препаратов (развития НЯ), не зарегистрировано ни в одной из групп.
Обсуждение
Наличие лактобациллярной флоры в количестве более 80% общей бактериальной массы (критерий нормоценоза) через 18 дней от начала лечения препаратом Экоклиндин выявлено у 87,5% пациенток, что значительно больше, чем в группе лечения препаратом Клиндацин, – 45% пациенток. Данный феномен может объясняться влиянием лактулозы, входящей в состав препарата Экоклиндин.
Лактулоза – пребиотик, который усиливает рост полезных бактерий, таких как бифидобактерии и лактобациллы, способствует подавлению роста потенциально патогенных бактерий (Clostridium spp. и E. coli), что обеспечивает более благоприятный баланс микрофлоры.
Как показали ранее проведенные исследования, лактобациллы используют лактулозу в качестве питательного субстрата, что приводит к увеличению количества собственных лактобацилл (генетически «родных»). При этом вагинальные лактобациллы подавляют рост и образование гиф C. albicans in vitro и in vivo [25]. S.L. Collins и соавт. [21] продемонстрировали, что лактулоза наиболее активно и избирательно стимулирует рост лактобацилл, в том числе L. crispatus. C. albicans и анаэробные бактерии не метаболизируют лактулозу, она для них не является питательным субстратом. Восстановление Lactobacillus spp. до уровня выше 90% в структуре представителей микробиоты in vitro происходит в течение 48 часов [21].
Заключение
Согласно полученным результатам, препарат Экоклиндин ассоциируется с более высокой клинической эффективностью, безопасностью, положительным влиянием на лактобациллы, высокой комплаентностью и снижением частоты рецидивирования БВ по сравнению с препаратом Клиндацин. Это позволяет рекомендовать препарат Экоклиндин для применения в клинической практике при БВ в первой линии терапии в соответствии с клиническими рекомендациями.
I.N. Kononova, PhD, Yu.E. Dobrokhotova, PhD, Prof., Ye.N. Kareva, PhD, Prof., I.V. Graban, T.A. Ogurtsova, M.S. Shchepetova
N.I. Pirogov Russian National Research Medical University
Interregional Center for Continuing Professional Education
I.M. Sechenov First Moscow State Medical University
Medical Center ‘Edelweiss’, Yekaterinburg
Yekaterinburg Clinical Perinatal Сenter
Contact person: Irina N. Kononova, irkonmed@mail.ru
Purpose – evaluation of the efficacy, safety and impact on the level of vaginal lactobacilli of the drug Ecoclindin (INN clindamycin 100 mg, lactulose), vaginal suppositories (AO AVVA RUS, Russia) in the treatment of patients with bacterial vaginosis.
Material and methods. An open multicenter observational prospective clinical trial was conducted in women's clinics, medical centers in Moscow and Yekaterinburg. The experimental drug group (Ecoclinin) consisted of 40 patients with a clinically and laboratory-verified diagnosis of other non-inflammatory vaginal diseases (based on the Femoflor-16 test) with a predominance of anaerobic bacteria (BV) who received Ecoclinin (clindamycin 100 mg) intravaginally in suppositories once a day for three days. The comparison group (Clindacin) consisted of 20 patients with a similar diagnosis who received Clindacin (clindamycin 100 mg) intravaginally in suppositories once a day for three days. The clinical and laboratory efficacy, tolerability, and compliance of the drug were evaluated 4 and 18 + 3 days after the start of therapy.
Results. Eradication of anaerobic pathogens was observed in 97.5% of patients treated with Ecoclinin and in 95.0% of patients treated with Clindacin, which indicates a higher clinical efficacy of Ecoclinin. The greatest adherence to therapy was observed against the background of taking the drug Ecoclinin – 97.5% of patients, which is associated with a minimum number of adverse events in 2.5% of cases. At the same time, 90.0% of patients demonstrated adherence to Clindacin therapy, which is associated with the occurrence of adverse events in 10.0% of cases. According to the results of the protocol of the study of the vaginal microbiota in PCR-RV (Femoflor-16 test), on the 18 + 3 day after the start of treatment, there were 97.5% of patients with absolute and conditional normocenosis in the Ecoclinin group, which indicated the predominance of lactobacilli in the vaginal microbiocenosis. There were 90% of them in the Clindacin group, and 10% of them retained moderate dysbiosis without restoring lactobacillar flora (p = 0.002). The presence of lactobacillar flora in the amount of more than 80% of the total bacterial mass (normocenosis criterion) 18 days after treatment with Ecoclinin was detected in 87.5% of patients, which significantly differed from the same indicator in the group of patients taking Clindacin, 45%. This phenomenon can be explained by the effect of lactulose in the composition of the drug Ecoclindin.
Conclusions. The results obtained indicated a higher clinical efficacy, safety and positive effect on lactobacilli, high compliance and a decrease in BV recurrence after using Ecoclindin compared to Clindacin, which dictates the advisability of recommending Ecoclindin in clinical practice for the treatment of bacterial vaginosis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.