Опыт лечения плоскоклеточного рака кожи у пациентов с дистрофической формой буллезного эпидермолиза
- Аннотация
- Статья
- Ссылки
- English
Введение
Дистрофический буллезный эпидермолиз (БЭ) относится к одной из самых тяжелых форм генных дерматозов. Заболевание характеризуется наличием мутации в гене, отвечающем за синтез коллагена VII типа (COL7A1), и клинически проявляется рецидивирующим образованием язв, пузырей, рубцов на коже и слизистых оболочках, возникающих как при незначительной механической травме, так и самостоятельно. В настоящее время не существует специфических методов лечения данной патологии. Имеющиеся терапевтические опции позволяют лишь продлить жизнь пациентов и улучшить ее качество. Со временем поражения кожи постепенно прогрессируют.
Наиболее опасным осложнением хронического воспалительного процесса является развитие плоскоклеточного рака кожи (ПКРК). Сегодня известно, что частота встречаемости рака кожи коррелирует с тяжестью течения БЭ и возрастом. Чаще карцинома кожи развивается у пациентов с тяжелым генерализованным рецессивным подтипом БЭ (RDEB-gen sev.), достигая 90% к 55 годам [1, 2]. ПКРК у пациентов с БЭ характеризуется более агрессивным течением, чем у пациентов в общей популяции. Это выражается в более ранней манифестации опухоли, множественности характера поражения и раннем метастазировании [3]. Кроме того, пациенты с тяжелой формой БЭ отличаются крайне неудовлетворительным соматическим статусом, наличием хронических очагов инфекции, болевого синдрома. Поэтому стандартные подходы к лечению ПКРК не всегда применимы, а сравнительная редкость БЭ не позволяет проводить полноценные клинические исследования. В настоящее время прогрессирующий онкологический процесс является одной из основных причин смерти пациентов с дистрофической формой БЭ [1].
Представляем мультидисциплинарный опыт лечения ПКРК у четырех пациентов с дистрофической формой БЭ с участием специалистов, объединенных экспертным фондом «БЭЛА. Дети-Бабочки», входящим в состав международной ассоциации DEBRA International.
Клинический случай 1
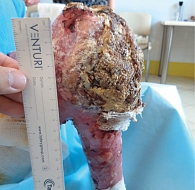
Мужчина, 21 год, с врожденным БЭ рецессивно-дистрофической формы (РДБЭ), генерализованным подтипом, тяжелой степенью, мутацией в гене COL7. БЭ, диагностированный при рождении, характеризовался крайне агрессивным течением. На момент госпитализации множественные раны кожи и слизистых оболочек занимали практически 100% площади тела. Со слов пациента, необычное новообразование кожи, которое локализовалось в области правого коленного сустава, беспокоило в течение нескольких лет. Однако злокачественный процесс заподозрили, когда опухоль достигла значительных размеров. На момент госпитализации опухоль распространилась на всю область коленного сустава, поразив его капсулу и сформировав огромный экзофитный компонент (рис. 1). Двигательная и опорная функции конечности утрачены.
В ходе комплексного обследования подтверждены местное распространение процесса, поражение не только кожи, но и подлежащих мягких тканей с инвазией коленного сустава. При этом данных об отдаленном и регионарном метастазировании не получено. На основании результатов конхотомной биопсии верифицирован диагноз: веррукозный ПКРК. С учетом степени распространенности опухолевого процесса пациенту предложили ампутацию пораженной конечности, но он отказался. Тяжелое состояние больного потребовало проведения метрономной полихимиотерапии препаратами циклофосфамид и метотрексат. Спустя два месяца лечения отмечалось прогрессирование опухолевого процесса в виде появления и роста опухолевых очагов в мягких тканях правой голени, что потребовало корректировки системной терапии (метотрексат заменили капецитабином в метрономном режиме). На фоне лечения зафиксирован распад первичной опухоли, а также дальнейшее прогрессирование в виде появления новых очагов в мягких тканях правого бедра. Клинически отмечалось ухудшение общего состояния пациента из-за усиления болевого синдрома, нарастания симптомов интоксикации, присоединения бактериальной инфекции. Была выполнена некрэктомия опухоли правого коленного сустава (от проведения радикальной операции пациент повторно отказался). Оперативное вмешательство позволило купировать болевой синдром и нивелировать симптомы опухолевой интоксикации. Соматический статус пациента улучшился, и системное лечение было продолжено с постепенной эскалацией дозы капецитабина. Спустя два месяца отмечались прогрессирование заболевания в виде роста старых опухолевых очагов, появление новых в ягодичной области и, как следствие, усиление болевого синдрома. Выполнена атипичная экзартикуляция правой нижней конечности в тазобедренном суставе с подвздошной лимфаденэктомией и иссечением опухоли ягодичной области. Кроме основного опухолевого конгломерата данные гистологического заключения подтвердили наличие очага плоскоклеточной карциномы кожи ягодичной области, метастатического поражения наружных подвздошных лимфоузлов (края резекции резецированных инфильтратов вне опухоли). Послеоперационный период прошел без осложнений, рана зажила первичным натяжением.
С учетом степени распространения онкологического заболевания, условной радикальности выполненного оперативного вмешательства, ожидаемой низкой чувствительности опухоли к системной цитостатической терапии при высоком риске развития побочных эффектов пациента оставили под динамическим наблюдением.
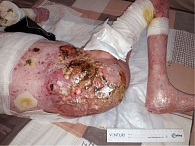
Через шесть месяцев диагностирована генерализация опухолевого процесса в виде появления новых опухолевых очагов на коже туловища, метастатическое поражение печени и общих подвздошных лимфатических узлов. С учетом распространенности поражения, высокого уровня экспрессии рецептора эпидермального фактора роста было принято решение о проведении таргетной терапии препаратом цетуксимаб. Данные контрольного обследования после пяти еженедельных введений цетуксимаба продемонстрировали разнонаправленную динамику – рост опухоли в области туловища (рис. 2) и стабилизацию метастатических очагов в подвздошных лимфатических узлах и печени.
На момент обследования пациент находился в тяжелом состоянии, опухолевый процесс прогрессировал, отмечались выраженный болевой синдром и нежелательные эффекты таргетной терапии. Резистентность опухоли к проводимой терапии послужила основанием для прекращения специфического лечения. Спустя месяц на фоне прогрессирования заболевания пациент скончался.
Клинический случай 2
Женщина, 37 лет, страдает РДБЭ (генерализованный подтип, тяжелая степень с мутацией в гене COL7). На момент обращения в специализированный стационар онкологический анамнез составил более двух лет. Тогда больная отметила появление длительно незаживающих ран с атипичным болевым синдромом в области правой стопы и левой голени. По месту жительства была выполнена биопсия язвенного дефекта в области левой голени. Подтверждена плоскоклеточная карцинома кожи. Затем проведено иссечение опухоли данной локализации (края резекции не оценивались). Комплексное обследование не проводилось, пациентку оставили под динамическим наблюдением, которое фактически не осуществлялось.
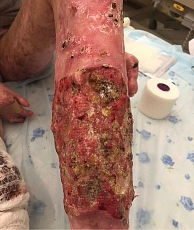
Через три месяца клинически выявлен местно-распространенный рецидив в области левой голени с поражением кожи, мягких тканей и костей голени, метастатическим поражением ипсилатеральных пахово-бедренных лимфоузлов. Тем не менее гистологическая верификация была получена лишь спустя еще восемь месяцев (рис. 3).
Таким образом, распространенность опухолевого процесса, высокая экспрессия рецептора эпидермального фактора роста в опухолевой ткани потребовали проведения биологической таргетной терапии препаратом цетуксимаб в комбинации с низкими дозами цитостатиков (цисплатин 20 мг еженедельно).
Проведено четыре цикла рекомендованного режима противоопухолевого лечения. Осложнения терапии проявлялись кожной токсичностью 2–3-й степени, которая была наиболее выражена после первого введения цетуксимаба и полностью купирована к четвертому введению препарата. Контрольное обследование показало стабилизацию опухолевого процесса с тенденцией к уменьшению очага плоскоклеточного рака в области левой голени. Однако специфическая терапия была прервана из-за присоединения бактериальной инфекции, развития выраженной стриктуры пищевода (дисфагия 3–4-й степени), обусловленной основным заболеванием, возникновением патологического перелома левой большеберцовой кости. На фоне перерыва в лечении зафиксированы отрицательная динамика в виде увеличения размеров опухоли и появление нового подозрительного внутрикожного очага в области правой стопы (контралатеральная сторона). На основании санитарных показаний принято решение выполнить ампутацию левой нижней конечности на уровне дистальной трети левого бедра с терапевтической пахово-бедренной лимфаденэктомией слева и биопсией язвенного дефекта в области правой стопы.
По данным гистологического исследования, в конгломерате лимфоузлов из левой паховой области выявлены метастазы плоскоклеточного ороговевающего рака. Результаты исследования биоптата, полученного из язвенного дефекта правой стопы, подтвердили ПКРК (G3). Полученные данные послужили основанием для выполнения иссечения очага карциномы кожи правой стопы с пластикой расщепленным аутотрансплантатом.
Послеоперационный период – без осложнений, рана зажила с полным приживлением трансплантата, гистологическое исследование не выявило опухоли в краях резекции.
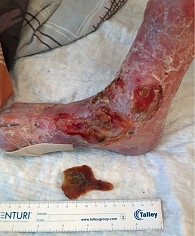
Спустя три месяца диагностирован локальный рецидив на коже правой стопы в зоне бедренных лимфоузлов слева. С учетом прогрессирования опухолевого процесса и достигнутого ранее терапевтического эффекта принято решение о реиндукции терапии цетуксимабом. Суммарно проведено еще шесть введений цетуксимаба. Осложнения (кожная токсичность 3-й степени, генерализованный инфекционный процесс, инфицирование порт-системы) требовали регулярного увеличения интервала между курсами. В результате достигнут эффект в виде стабилизации опухолевого процесса в бедренной области слева и полный регресс очага в зоне правой стопы (рис. 4).
Впоследствии был удален опухолевый конгломерат пахово-бедренной области слева (морфологически – веррукозный ПКРК, опухолевые клетки в краях резекции по вертикали).
Контрольное обследование показало стабилизацию процесса. В силу тяжелых токсических эффектов на фоне специфической терапии и отсутствия данных об активном опухолевом процессе пациентка была оставлена под динамическим наблюдением. В настоящее время срок наблюдения составляет шесть месяцев.
Клинический случай 3
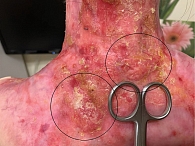
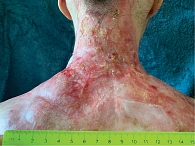
Женщина, 27 лет, с РДБЭ (генерализованный подтип, тяжелая степень с мутацией в гене COL7) и верифицированной плоскоклеточной карциномой кожи спины. Со слов пациентки, в течение четырех месяцев ее беспокоят длительно незаживающие язвенные дефекты кожи в межлопаточной области и нижней трети шеи (рис. 5).
Выполнена биопсия подозрительных участков кожи. Диагностирована псевдокарциноматозная гиперплазия многослойного плоского эпителия, в краях резекции одиночные клетки подозрительны в отношении высоко дифференцированного плоскоклеточного рака. Данные комплексного обследования подтвердили только образования вышеописанной локализации. Данных о метастатическом поражении не получено.
С учетом локализованного характера неопластического процесса было принято решение о выполнении оперативного этапа лечения в объеме широкого иссечения опухоли кожи межлопаточной области с пластикой перемещенными лоскутами кожи. Послеоперационное гистологическое исследование подтвердило умеренно дифференцированный ПКРК с положительным горизонтальным краем резекции. Общий соматический статус и отсутствие таргетного очага для терапии потребовали динамического наблюдения.
Вскоре был выявлен и подтвержден морфологически с помощью мультифокусной панч-биопсии рецидив в послеоперационной области. Выполнено радикальное иссечение. В настоящее время пациентка находится под динамическим наблюдением онкологов, в течение года сохраняется ремиссия (рис. 6).
Клинический случай 4
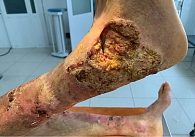
Мужчина, 35 лет, обратился за специализированной помощью по поводу длительно незаживающего язвенного дефекта в области правого голеностопного сустава. Данный процесс возник на фоне РДБЭ (средняя степень тяжести с мутацией в гене COL7) (рис. 7).
При осмотре выявлен язвенный дефект кожи, занимавший практически всю область правого голеностопного сустава. Выполнена биопсия образования, диагностирован ПКРК.
Комплексное обследование подтвердило отсутствие поражения голеностопного сустава, сухожилий и костей. Данных о регионарных и отдаленных метастазах не получено.
Впоследствии выполнено широкое иссечение опухоли правой голени в пределах здоровых тканей без пластики дефекта. Согласно данным послеоперационного морфологического заключения, оперативное вмешательство выполнено радикально. Рана зажила вторичным натяжением. Пациент находится под динамическим наблюдением (в настоящее время – четыре месяца, данных о локальном рецидиве нет).
Обсуждение
К сожалению, проблема плоскоклеточной карциномы кожи при БЭ не решена, отсутствуют четкие алгоритмы терапии, результаты лечения крайне неутешительны.
Силами мультидисциплинарной команды было пролечено четверо пациентов, страдавших ПКРК на фоне дистрофической формы БЭ. Приходится констатировать, что не во всех случаях был достигнут успех. Пациенты, обратившиеся за помощью с уже диссеминированным опухолевым процессом, продемонстрировали крайне низкие результаты лечения, несмотря на мультимодальный подход с использованием химиотерапии и биологически обоснованной таргетной терапии, многократных оперативных вмешательств, а также комплексной сопроводительной терапии.
Необходимо отметить, что такие неудовлетворительные результаты лечения обусловлены не только распространением опухолевого процесса, но и тяжестью течения буллезного эпидермолиза, что в сочетании с токсическими эффектами значительно осложняло проведение адекватной системной противоопухолевой терапии из-за невозможности соблюдения стандартного интервала между циклами и необходимости деэскалации доз препаратов.
Как уже отмечалось, в настоящее время отсутствуют общепринятые рекомендации по системной терапии ПКРК при БЭ [4]. Большинство публикаций ограничены демонстрацией отдельных клинических случаев или серией наблюдений, клинические исследования в данной области не опубликованы [5–8].
Опыт лечения ПКРК в общей популяции показал, что максимальная противоопухолевая эффективность достигается на фоне применения комбинированной цитостатической терапии в сочетании с ингибиторами контрольных точек или антагонистов рецептора эпидермального фактора роста [9]. Между тем использование стандартных схем полихимиотерапии для пациентов с БЭ сопряжено с крайне высоким уровнем токсичности и требует модификации доз и применения альтернативных биологических подходов [4].
Данные литературы свидетельствуют о потенциальной эффективности и удовлетворительной переносимости антагониста рецептора эпидермального фактора роста препарата цетуксимаб. В настоящее время оптимистичными являются результаты II фазы исследования эффективности терапии нерезектабельных форм ПКРК цемиплимабом – моноклональным антителом, ингибитором PD-1. Согласно данным систематического обзора S. Keeping и соавт., опубликованного в 2020 г., цемиплимаб имеет преимущество перед существующими режимами лечения по показателю общей выживаемости [10].
К сожалению, в случае распространенного ПКРК противоопухолевые мероприятия направлены на улучшение качества жизни пациентов и в большинстве случаев являются паллиативными. Диаметрально противоположные результаты имеют место в случае обнаружения ПКРК на ранней стадии, когда можно избежать не только калечащих операций, но и токсичности специфического лечения. Безусловно, необходимо продолжать поиск новых терапевтических агентов, эффективных при метастатической карциноме кожи. При этом важно помнить, что наиболее актуальным способом борьбы с опухолью является ее ранняя диагностика.
Знание особенностей течения ПКРК на фоне БЭ позволяет определить частоту обследования и своевременно поставить диагноз. Частота встречаемости рака кожи напрямую зависит от тяжести течения БЭ, поэтому при дистрофической форме ПКРК может манифестировать уже в детском и подростковом возрасте. Впоследствии риск возникновения опухоли увеличивается, достигая 67, 80 и 90% к 30, 45 и 55 годам соответственно, и становится одной из основных причин смерти в данной группе больных. При других формах буллезного эпидермолиза карцинома кожи встречается в 10% случаев [1, 3].
Учитывая столь высокий риск возникновения кожной неоплазии, пациенты должны регулярно проходить диспансерное наблюдение у дерматолога и онколога. При выявлении подозрительных участков кожи необходимо выполнить биопсию с включением в материал глубоких слоев (допускается биопсия из нескольких мест) с гистологическим исследованием полученного материала. В случае подтверждения злокачественности опухоли показано мультидисциплинарное обсуждение с целью определения дальнейшей тактики лечения в каждом конкретном случае.
Заключение
Только своевременная диагностика ПКРК обеспечивает хороший прогноз для жизни и здоровья пациентов с БЭ. Лечение же распространенных форм рака кожи зачастую оказывается неэффективным. Поэтому крайне важен адекватный уровень онконастороженности как среди медицинского персонала, так и самих пациентов. Данные исследований эффективности современной иммунотерапии при нерезектабельных формах ПКРК вселяют оптимизм. Исследования в этой области должны быть продолжены.
G.V. Zinovyev, PhD, D.A. Drozdovskaya, PhD, Ye.M. Anokhina, PhD, M.A. Gekht, A.S. Pleshkov, A.A. Sabitova, V.I. Kornev, M.V. Nikiforov
῾BELA. Children-Butterflies’ Charitable Foundation, Moscow
N.N. Petrov National Medical Research Center of Oncology, Saint-Petersburg
R.M. Gorbachyova Research Institute of Pediatric Oncology, Hematology and Transplantology of the Academician I.P. Pavlov First Saint-Petersburg State Medical University
Saint-Petersburg State University, N.I. Pirogov High Medical Technology Clinic of Saint-Petersburg State University
A.M. Nikiforov All-Russian Center of Emergency and Radiation Medicine, Saint-Petersburg
Contact person: Grigory V. Zinovyev, zinovevgrigory@gmail.com
Epidermolysis bullosa (EB) is a hereditary, heterogeneous group of rare genetic dermatoses characterized by the skin and mucous membranes fragility. One of the most severe forms of the disease is dystrophic EB, the severity of which is due to the generalized nature of the lesion of the skin and mucous membranes of internal organs. In the absence of pathogenetic treatment of EB, multidisciplinary care is aimed at minimizing the risk of progression of skin lesions, relieving symptoms and specific complications. One of the most dangerous complications of EB is the early development of squamous cell skin cancer (SCC), which is especially characteristic for patients with dystrophic form. There are no generally accepted recommendations for the systemic therapy of SCC in EB, as well as clear evidence of the cytotoxic drugs clinical effectiveness in the treatment of this group of patients. The presented in the article experience of treatment of both localized and widespread forms of SCC in patients with dystrophic form of EB shows the possibilities
of the surgical approach and the systemic therapy effectiveness. Of course, any experience in the treatment of a malignant tumor with such a severe orphan disease is of great value and can help in the selection of the most effective treatment tactics in the future.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.