Рецидивирующее течение плоскоклеточного рака кожи у пациента с дистрофическим типом буллезного эпидермолиза
- Аннотация
- Статья
- Ссылки
- English
Однако обнаружение ПКРК на фоне поражения кожного покрова при буллезном эпидермолизе представляет сложную задачу даже для опытного клинициста. Кроме того, существуют нюансы выполнения оперативного вмешательства, а также течения раннего послеоперационного периода у пациентов с особенностями строения кожи. В данной статье мы хотим поделиться редким опытом лечения рецидивирующей плоскоклеточной карциномы кожи у молодого пациента с дистрофическим буллезным эпидермолизом с рецессивным типом наследования.
Однако обнаружение ПКРК на фоне поражения кожного покрова при буллезном эпидермолизе представляет сложную задачу даже для опытного клинициста. Кроме того, существуют нюансы выполнения оперативного вмешательства, а также течения раннего послеоперационного периода у пациентов с особенностями строения кожи. В данной статье мы хотим поделиться редким опытом лечения рецидивирующей плоскоклеточной карциномы кожи у молодого пациента с дистрофическим буллезным эпидермолизом с рецессивным типом наследования.
Введение
Буллезный эпидермолиз (БЭ) включает в себя группу редких наследственных заболеваний, которые характеризуются особой хрупкостью кожного покрова. Данная особенность обусловлена мутациями в генах, кодирующих белки дермально-эпидермальной адгезии. В зависимости от уровня поражения кожи выделяют четыре типа БЭ: простой БЭ, пограничный БЭ, дистрофический БЭ и синдром Киндлера. Наиболее тяжелое, инвалидизирующее течение заболевания характерно для генерализованного дистрофического буллезного эпидермолиза с рецессивным типом наследования (РДБЭ). Патогенетическое лечение данного заболевания на сегодняшний день отсутствует. Продолжительность жизни таких больных во многом зависит от качества ухода, а также спектра осложнений БЭ. Так, одним из самых грозных последствий генодерматоза является развитие плоскоклеточного рака кожи (ПКРК) и слизистых оболочек. В отличие от ПКРК в общей популяции, когда хроническое воздействие ультрафиолетового излучения является ведущей причиной развития опухолей на участках, подверженных воздействию солнца, карцинома кожи, ассоциированная с БЭ, возникает на участках, подверженных хроническому воспалительному процессу: пузыри, раны, рубцовые изменения [1–3]. Можно предположить, что тяжесть течения БЭ коррелирует с частотой развития ПКРК, и это будет совершенно верным утверждением. Более того, чем старше пациент, тем выше риск развития рака кожи. Большинство эпидемиологических данных о плоскоклеточном раке при БЭ получено из Национального реестра БЭ США, который показал повышенный кумулятивный риск развития ПКРК при БЭ с возрастом. У пациентов с РДБЭ кумулятивный риск развития одного плоскоклеточного рака составил 7,5% к возрасту 20 лет, 67,8% к 35 годам и 90,1% к 55 годам, параллельно с повышенным кумулятивным риском смерти, связанным с плоскоклеточным раком: 38,7% к возрасту 35 лет, 70,0% к 45 годам и 78,7% к 55 годам [4]. Несмотря на столь высокие цифры заболеваемости, данных о лечении ПКРК на фоне БЭ недостаточно. Поэтому мы считаем необходимостью публикации случаев лечения злокачественных поражений кожного покрова, возникших на фоне столь редкого генодерматоза.
Описание клинического случая
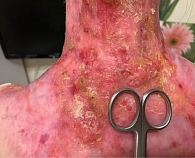
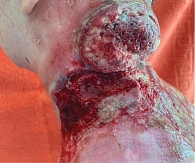
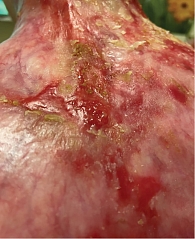
Молодая женщина 27 лет. Дистрофический буллезный эпидермолиз с рецессивным типом наследования (генерализованный подтип, тяжелая степень с мутацией в гене COL7) диагностирован в раннем детстве, клинические проявления заболевания манифестировали в первые сутки после рождения. Нужно отметить, что, несмотря на тяжелое течение БЭ, состояние пациентки сохранялось удовлетворительным благодаря своевременному и грамотному уходу. Родственниками пациентки на протяжении четырех месяцев отмечены незаживающие изъязвления кожи, локализованные в межлопаточной области и нижней трети шеи. Несмотря на неоднократную смену подходов локального ухода, эпителизация так и не была достигнута, в связи с чем пациентка была осмотрена онкологом. В ходе осмотра в указанной анатомической области визуализировались дефекты кожного покрова, представленные глубокими эрозиями с небольшим возвышением по периферии, площадь эрозивной поверхности имела разную глубину и не имела четкой границы с предполагаемыми здоровыми участками кожного покрова (рис. 1).
Учитывая тип БЭ, возраст пациентки, принято решение о цитологической верификации патологических участков кожного покрова. В исследуемом материале диагностирована псевдокарциноматозная гиперплазия многослойного плоского эпителия, а также подозрительные в отношении высокодифференцированного плоскоклеточного рака одиночные клетки. Учитывая данные мировой литературы, мы определили, что пациентка относится к группе высокого риска прогрессирования ПКРК. Дополнительное обследование в объеме компьютерной томографии органов грудной клетки, брюшной полости и малого таза и ультразвукового исследования регионарной группы лимфатических узлов не выявило признаков регионарного и отдаленного метастазирования. Стандартом лечения локализованных форм ПКРК является оперативное лечение, что и было выполнено в объеме иссечения опухоли с пластикой перемещенными лоскутами кожи. В послеоперационном периоде произошла несостоятельность швов, что привело к вторичному заживлению раны. Послеоперационное гистологическое исследование подтвердило наличие опухоли – умеренно дифференцированный плоскоклеточный рак кожи (EGFR – интенсивно положителен в большинстве клеток опухоли; PD-L1-позитивен в 80% клеток опухоли и в иммунных клетках, занимающих около 10% площади опухоли). Кроме этого, выявлены опухолевые клетки в одном из маркированных краев резекции, что потребовало повторного вмешательства в послеоперационном периоде для достижения «чистого» края резекции. После заживления раны адъювантная терапия не проводилась. Уход за кожными покровами пациентки осуществлялся в полном привычном объеме близкими родственниками.
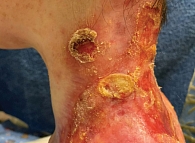
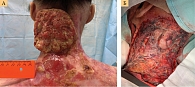
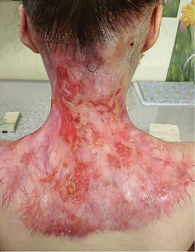
Спустя год и два месяца выявлен новый подозрительный очаг роста опухоли по заднелатеральной поверхности шеи слева и верхней трети спины (рис. 2) в виде гиперкератотических бляшек с приподнятыми краями по периферии.
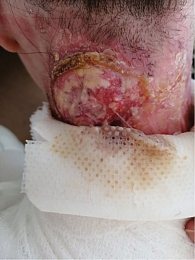
С целью получения диагностически достаточного материала была выполнена мультифокальная панч-биопсия. Такой характер биопсии позволил получить адекватный материал для гистологического исследования, а также повысил шансы верификации диагноза, поскольку существует значительная сложность в выборе зоны биопсии на фоне столь измененных кожных покровов. Во всех биопататах подтвержден плоскоклеточный ороговевающий рак. При этом скорость роста опухолевых очагов приобрела галопирующий характер (рис. 3).
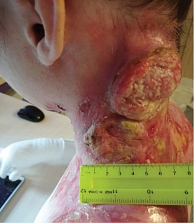
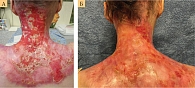
С учетом мультифокального рецидивирующего течения заболевания принято решение о проведении иммунотерапии с целью уменьшения размеров новообразований, а также снижения риска системного прогрессирования. После двух введений анти-PD-1-ингибитора пембролизумаба отмечено увеличение размеров опухоли, что могло расцениваться как псевдопрогрессирование, но в связи с быстрым ростом новообразований (рис. 4) принято решение о циторедуктивном пособии – криодеструкции.
С целью попытки локального контроля выполнена струйная криодеструкция очагов спины и шеи (рис. 5).
После криодеструкции выполнено еще три введения пембролизумаба. Несмотря на продолжение иммунотерапии, отмечалось бурное локальное прогрессирование основного опухолевого очага (рис. 6 А), что ставило под угрозу возможность выполнения условно-радикального оперативного пособия. С учетом резектабельности процесса на тот момент и отсутствия отдаленных метастазов принято решение о циторедуктивном хирургическом вмешательстве. Выполнено удаление новообразования кожи и подлежащих мягких тканей с резекцией мышечных структур с пластикой расщепленным свободным кожным лоскутом (рис. 6 Б).
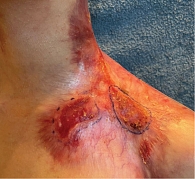
В послеоперационном периоде в связи с хронической инфекцией кожных покровов, несмотря на антибактериальную профилактику, произошел субтотальный некроз кожного трасплантата. В течение месяца достигнуто появление активных грануляций (рис. 7 А), а затем и полная эпителизация раны (рис. 7 Б). При контрольном обследовании и осмотрах свидетельств о продолженном росте, появлении новых очагов опухоли и отдаленных метастазов получено не было. Адъювантная терапия не проводилась.
Спустя восемь месяцев обнаружено появление нового очага, подозрительного в отношении ПКРК, но уже в области верхней трети спины ( рис. 9).
Выполнено иссечение новообразования кожи передней грудной стенки с пластикой композитной матрицей. Результат гистологического исследования ткани: изъязвленная ороговевающая плоскоклеточная карцинома кожи передней поверхности грудной стенки, 2,1 см в наибольшем измерении, с инвазией в дерму на глубину 5 мм, на фоне выраженной лимфоидной инфильтрации. Периневральная инвазия не выявлена. Послеоперационный период протекал благополучно. Матрица, покрывавшая дефект, эпителизировалась. Спустя еще пять месяцев обнаружен новый очаг ПКРК по задней поверхности шеи (рис. 8). Выполнено иссечение опухоли, заживление произошло вторичным натяжением, без особенностей.
В настоящее время состояние пациентки удовлетворительное, продолжено наблюдение (рис. 10), длительность которого на момент публикации составляет пять месяцев от последнего хирургического вмешательства, три года от манифестации первого очага опухоли.
Мы посчитали важным представить клиническую презентацию лечебного процесса в отношении опухоли у данной пациентки. Хотелось бы обратить внимание на полиморфность очагов ПКРК у одного и того же пациента. Несмотря на тяжелое фоновое заболевание, что безусловно затрудняет хирургические этапы лечения, в большинстве случаев послеоперационный период протекал без осложнений. Благодаря своевременному обнаружению опухоли удалость не только выполнить адекватный объем оперативного лечения, но и сохранить качество жизни пациентки.
Результаты и обсуждение
В данной статье продемонстрирован пример течения ПКРК на фоне тяжелой формы БЭ. С учетом данных мировой литературы, а также нашего опыта мы можем говорить о том, что подобное рецидивирующее или хроническое течение ПКРК является классическим для пациентов с РДБЭ. Почему же это происходит? Почему ПКРК при БЭ проявляет себя столь агрессивно?
Мутации в гене COL7A1 вызывают все формы дистрофического буллезного эпидермолиза. Если в результате мутации выработка коллагена VII типа значительно снижается или прекращается вовсе, у пациента проявляется тяжелое генерализованное течение дистрофического БЭ. У таких пациентов из-за малого количества или отсутствия коллагена VII типа нарушается соединение эпидермиса с дермой, вследствие чего любое трение или травма могут привести к разделению двух слоев кожи. Клинически это проявляется повреждением кожного покрова вплоть до дермы, образуются волдыри, эрозии, язвы, множественные очаги рубцовой ткани. Таким образом, в коже и слизистых оболочках персистирует процесс воспаления. В настоящее время патогенез развития ПКРК на фоне БЭ недостаточно изучен и четкого ответа на вопрос о причинах развития опухоли нет. Однако большинство исследований выделяют следующие предрасполагающие патологические процессы: хроническое воспаление, измененный процесс заживления ран у пациентов с РДБЭ – повторяющаяся реэпителизация, фиброз, бактериальная и грибковая контаминация ран, повторное повреждение тканей вследствие иммунного ответа, генетическая предрасположенность [1, 2, 5]. Вышеперечисленные патологические процессы создают идеальные условия для роста и развития ПКР, а также для изменения ее биологического поведения. Для пациентов с тяжелыми формами БЭ характерны ранняя манифестация опухоли кожи (средний возраст 32–36 лет), первично-множественный характер распространения – наличие нескольких очагов ПКРК при первичном обращении, раннее метастазирование, агрессивный метастатический потенциал, высокая смертность [2, 3].
Таким образом, ПКРК у пациентов с БЭ является серьезной терапевтической проблемой. Безусловно, существует проблема низкой осведомленности среди медицинского персонала о проблеме БЭ и ПКРК, сами пациенты с течением времени негативно относятся к частым осмотрам специалистов, ведь в их случае смена перевязочного материала неизменно ассоциируется с болью. Кроме того, при тяжелом кожном патологическом процессе своевременное обнаружение начальных очагов ПКРК представляет очень сложную поисковую задачу, в связи с чем некоторые ранние очаги опухоли могут быть пропущены, а значит, риск обнаружить ПКРК на ранней стадии снижается. Таким образом, большинство пациентов с БЭ обращаются за медицинской помощью, когда опухолевый процесс носит распространенный характер.
На сегодняшний день отсутствуют исследования в области лечения ПКРК на фоне БЭ, а следовательно, нет и рекомендаций [6]. Безусловно, мы можем и должны опираться на современные международные рекомендации по лечению злокачественных опухолей кожи. Однако тяжелое течение БЭ оказывает влияние на функционирование практически всех систем организма, что необходимо учитывать при выборе тактики лечения ПКРК. Стандартные курсы полихимиотерапии или таргетная терапия EGFR-ингибиторами для нерезектабельных или метастатических форм ПКРК могут быть использованы с особой осторожностью ввиду высокого риска развития побочных эффектов. Опыт иммунотерапии PD-1-ингибиторами у пациентов с РДБЭ также весьма ограничен, но должен быть рассмотрен в качестве наиболее перспективного подхода в лечении данной группы больных [7–9]. Когда речь идет о локальном контроле при локализованных опухолевых очагах, золотым стандартом остается хирургическое иссечение в пределах здоровых тканей. Необходимо учитывать тот факт, что опухоль характеризуется более агрессивным биологическим поведением, следовательно, отрицательный край резекции играет еще большую роль в дальнейшем прогнозе. Другие методы локального контроля, такие как криодеструкция опухоли, фотодинамическая терапия, могут быть использованы, если в конкретном клиническом случае это будет потенциально выполнимой и перспективной задачей. Дистанционная лучевая терапия имеет еще более ограниченный опыт применения, поскольку является опасным методом лечения для высокочувствительной кожи пациентов с БЭ, однако может быть использована с целью снижения выраженности симптомов опухоли и у паллиативных пациентов [6].
Выводы
На сегодняшний день БЭ является неизлечимым заболеванием, а значит, повлиять на риск развития ПКРК мы можем лишь повышением онконастороженности среди медицинского персонала и пациентов, а также улучшением мер, направленных на совершенствование мультидисциплинарного подхода в отношении пациентов с тяжелыми формами данного фонового заболевания. В первую очередь раннее обнаружение опухоли, своевременное ее удаление могут позволить не только снизить риск мучительной смерти от прогрессирующего ПКРК, но и предотвратить проведение калечащих оперативных вмешательств.
G.V. Zinovyev, PhD, D.A. Drozdovskaya, PhD, E.M. Anokhina, PhD, A.A. Sabitova, M.A. Ebert, M.A. Gecht, A.S. Pleshkov, V.I. Kornev, PhD, M.V. Nikiforov, O.S. Orlova
Charitable Foundation ʻBELA. Butterfly Childrenʼ
N.N. Petrov National Medical Research Center of Oncology
R.M. Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantology
A.M. Nikiforov All-Russian Center for Emergency and Radiation Medicine
Clinical Hospital of St. Luke
Contact person: Grigory V. Zinoviev, zinovevgrigory@gmail.com
The development of squamous cell skin carcinoma (SCCC) is one of the most common complications in the junctional and dystrophic form of epidermolysis bullosa. Currently, early detection and surgery is the gold standard for treatment of skin tumors. However, detection of SCCC in patients with epidermolysis bullosa is a challenge even for an experienced clinician. In addition, there are nuances of performing a surgery, as well as postoperative care in these patients. In this article, we would like to share a rare experience
of treatment of recurrent squamous cell skin carcinoma in young patient with recessive dystrophic epidermolysis bullosa.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.