Опыт применения алендроновой кислоты (Осталон) в комплексном лечении постменопаузального остеопороза
- Аннотация
- Статья
- Ссылки
- English
Согласно заключению экспертов Всемирной организации здравоохранения проблема остеопороза (ОП) носит глобальный характер. По медико-социальной значимости данное заболевание стоит на четвертом месте после сердечно-сосудистых, онкологических заболеваний и сахарного диабета. В структуре ОП на постменопаузальный ОП приходится практически 60% [1–3].
В настоящее время для профилактики и лечения как первичного, так и вторичного ОП (глюкокортикоид-индуцированного, ОП у мужчин) широко используют бисфосфонаты [1–10]. Учитывая доказанную эффективность бисфосфонатов в снижении риска переломов (позвоночных и внепозвоночных), а также их фармакоэкономические преимущества, данная группа лекарственных средств рассматривается в качестве первой линии терапии постменопаузального ОП. Следует подчеркнуть, что терапия ОП является одновременно и его профилактикой, поскольку предупреждает прогрессирование заболевания и снижает риск новых переломов [6–9].
Алендроновая кислота по химической структуре относится к группе аминобисфосфонатов [10]. Доказательная база по оценке ее эффективности в лечении постменопаузального ОП начала формироваться более 15 лет назад, однако наиболее значимые результаты получены в конце 1990-х гг. [1, 2, 4]. Для улучшения комплаенса лечения и снижения риска развития побочных эффектов со стороны желудочно-кишечного тракта была создана ретардная форма алендроната в дозе 70 мг один раз в неделю. Сравнительное исследование эффективности и переносимости препарата в дозе 10 мг в сутки и 70 мг один раз в неделю в лечении постменопаузального ОП подтвердило преимущество ретардной формы при меньшей частоте побочных эффектов [4, 6, 10–19].
Оценке эффективности алендроната (препарата Осталон, компания Gedeon Richter) в дозе 70 мг в сочетании с комбинированным препаратом карбоната кальция и холекальциферола в терапии постменопаузального остеопороза у пациенток в возрасте до 70 лет посвящена настоящая работа.
Материал и методы исследования
Проспективное сравнительное клиническое исследование проведено на базе Республиканского центра медицинской реабилитации и бальнеолечения.
Критерии включения в исследование: женщины с верифицированным диагнозом «постменопаузальный ОП» в возрасте до 70 лет, согласие на участие в исследовании.
Критерии исключения: возраст старше 70 лет, наличие хирургической менопаузы, проведение заместительной гормональной терапии на момент начала работы или в анамнезе, сопутствующие заболевания и состояния, ассоциированные со снижением минеральной плотности кости (МПК), заболевания опорно-двигательного аппарата III и IV функционального класса, хронические заболевания внутренних органов выше 2-й степени недостаточности.
В исследование было включено 27 пациенток. В ходе первого визита проводилось общеклиническое обследование с оценкой антропометрических данных (рост, масса тела, индекс массы тела, окружность талии); изучение факторов риска ОП в ходе анкетирования (минутный тест для оценки риска ОП, рекомендованный Международным фондом остеопороза (International Osteoporosis Foundation – IOF)). Оценивались суточное потребление кальция и витамина D по данным опросника питания (описание рациона пациентки в течение трех дней в неделю), в дальнейшем использовался программный комплекс I-Nutrition, физическая активность – по данным анкетирования.
Согласно дизайну исследования всех пациенток проинформировали об особенностях питания, физических нагрузок, режима приема лекарственных средств. Был рекомендован комплекс ежедневных упражнений «7 × 7», ходьба не менее 60 минут в день. В качестве базисного лекарственного средства назначен комбинированный препарат карбоната кальция и витамина D3 (по две таблетки в сутки после еды – обед, ужин), что составило 1000 мг карбоната кальция и 400 МЕ витамина D3. В схему лечения добавлена алендроновая кислота в дозе 70 мг один раз в неделю в течение 12 месяцев.
Для повышения приверженности лечению пациенткам помимо заполнения анкет было рекомендовано вести дневник самоконтроля: отмечать регулярность выполнения физических упражнений, приема лекарственных средств, наличие нежелательных явлений. Для оценки клинических параметров и данных самоконтроля запланированы повторные визиты – через три, шесть и 12 месяцев. Через 12 месяцев наблюдения проводился контроль лабораторно-инструментальных исследований.
Две пациентки через шесть месяцев прекратили участие в исследовании: одна в связи со сменой места жительства, вторая в связи с отказом принимать большое количество лекарственных средств. Таким образом, только 25 пациенток дошли до конца исследования.
Лабораторные исследования также выполнялись на базе Республиканского центра медицинской реабилитации и бальнеолечения. Биохимический анализ крови (мочевина, креатинин, общий белок, холестерин, триглицериды, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза (ЩФ), Са, Р) проводился на автоматическом многоканальном биохимическом анализаторе HITACHI 911 компании Roche Diagnostics (Германия) с использованием реагентов Cormay (Польша).
Исследование паратиреоидного гормона (ПТГ) осуществлялось на иммуноферментном автоматизированном анализаторе AXSYM компании Abbot c применением реагентов Abbot (США).
Уровень кальцидиола (25-гидроксивитамин D3 – 25(ОН)D3) в сыворотке крови устанавливали с помощью автоматизированной системы плашечного иммуноферментного анализатора BRIO компании SEAK (Италия) с применением реагентов DRG (США).
Для оценки скорости костного метаболизма в сыворотке крови определяли содержание маркеров костеобразования и костной резорбции: N-MID остеокальцин (ОК), бета-КроссЛапс. Использовали метод иммуноферментного электрохемилюминесцентного анализа с помощью системы MODULAR E 170 компании Roсhe Diagnostics с применением реагентов Roсhe Diagnostics (Германия).
МПК оценивали на основании результатов двойной рентгеновской денситометрии осевого скелета на денситометре PRODIGY LUNAR компании General Electric Medical Systems (США), год выпуска – 2004. Рентгеновская нагрузка в одной проекции – 0,04 мЗв. Проводилось исследование МПК (г/см2): Z-критерия, T-критерия в области поясничного отдела позвоночника (LI–LIV) и проксимального отдела бедра (ПОБ) (шейка бедра (ШБ) – neck, область Варда – upper neck, область большого вертела – trochanter, ПОБ – total hip). При оценке динамики показателя МПК учитывался процент изменений за 12 месяцев.
Для количественной оценки состояния МПК использовался Т-критерий (более -1,0 – норма; от -1,0 до -2,5 – остеопения; менее -2,5 – остеопороз) [5–7].
Статистическая обработка полученных результатов проводилась с помощью программ Exсel for Windows (2000), Statistiсa 7.0 StatSoft Inc. (США) с предварительной проверкой соответствия рассматриваемых переменных нормальному распределению по критерию Колмогорова – Смирнова. Распределение исследуемого признака считали нормальным при р > 0,05. К количественным признакам, имеющим распределение, отличное от нормального, применяли непараметрические методы и использовали U-критерий Манна – Уитни. Для сравнения двух связанных выборок – критерий Вилкоксона (W), трех – критерий Фридмана (χr2). Во избежание проблемы множественных сравнений при анализе трех и более независимых групп применяли метод Краскела – Уоллиса (Н) [16].
Результаты и их обсуждение
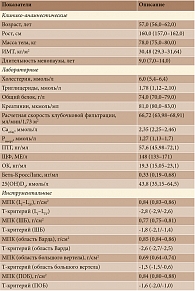
Клиническая характеристика пациенток, включенных в исследование и завершивших его, представлена в табл. 1.
Результаты проведенного анкетирования пациенток (n = 25) на момент включения в исследование представлены в табл. 2.
К установленным факторам риска ОП относится низкая физическая нагрузка, в том числе ходьба менее 60 минут в день [6, 7]. Анкетирование показало, что показатель физической активности соответствовал норме у 12 (48,0%) пациенток (табл. 2).
Согласно рекомендациям IOF суточное потребление кальция с продуктами питания для пациенток в период постменопаузы должно составлять 1500 мг, витамина D – 800 МЕ (20 мкг/сут) [6, 7]. У пациенток эти показатели были ниже целевых значений.
Анализ анкет участниц исследования через шесть и 12 месяцев показал достоверное увеличение суточного потребления кальция и витамина D с продуктами питания, а также уровня физической активности на фоне комплексной терапии ОП (рис. 1–3).
Результаты, полученные в ходе оценки динамики лабораторных показателей, характеризующих фосфорно-кальциевый и костный метаболизм исходно и через 12 месяцев лечения, представлены в табл. 3.
На фоне проводимого лечения отмечено достоверное снижение содержания бета-КроссЛапс, ПТГ и повышение содержания 25(ОН)D3.
В результате увеличения потребления кальция и витамина D
с продуктами питания увеличилось количество пациенток с нормальными значениями Саобщ и 25(ОН) D3 в сыворотке крови, отмечено снижение показателей ПТГ (табл. 4). Данные изменения потенциально отражают универсальный механизм регуляции фосфорно-кальциевого обмена, направленный на поддержание его собственного гомеостаза [20–22].
Оценка лабораторных показателей, характеризующих фосфорно-кальциевый обмен и костный метаболизм, в группе наблюдения показала снижение уровня ПТГ на фоне повышения содержания Саобщ и 25(ОН)D3. Кроме того, отмечено снижение маркера костной резорбции бета-КроссЛапс и отсутствие значимой динамики показателей ЩФ и ОК. Полученные данные потенциально свидетельствуют о снижении скорости костного метаболизма преимущественно за счет подавления процессов костной резорбции в результате комплексного лечения ОП.
Динамика показателей МПК осевого скелета на фоне лечения ОП представлена в табл. 5.
Достоверное повышение показателей МПК в области позвоночника и ПОБ через 12 месяцев подтверждает эффективность проводимой комплексной терапии.
Известно, что различные области ПОБ неоднородны по содержанию трабекулярного и кортикального компонентов костной ткани. Так, МПК в области Варда, расположенной в основании ШБ, ассоциирована с ранними изменениями костной плотности и коррелирует с МПК тел поясничных позвонков, что может служить маркером риска их переломов. Выделение зон ШБ и ПОБ наиболее значимо для оценки состояния минеральной плотности кортикальной кости [22].
Разницу между исходными показателями МПК в области позвоночника, ШБ, большого вертела, ПОБ и показателями МПК через 12 месяцев наблюдения отражает показатель «% изменений МПК». Если данный показатель менее -3%, динамика отрицательная, от -3% до 3% – стабилизация, более 3% – динамика положительная. Изменение МПК в ходе лечения представлено в табл. 6.
Более высокие значения показателя «% изменения МПК» осевого скелета отмечены в области LI–LIV, ШБ, ПОБ. При этом большая доля пациенток имела положительную динамику (более 3%) МПК в области LI–LIV и ПОБ (табл. 7).
Приверженность лечению составила 92,3%.
Выводы
Результаты проведенного проспективного клинического исследования свидетельствуют об эффективности комплексной терапии постменопаузального ОП (включающей нефармакологические методы, комбинированный препарат карбоната кальция 500 мг и холекальциферола 400 МЕ в сочетании с алендроновой кислотой (препарат Осталон) 70 мг в неделю) в течение 12 месяцев у женщин в возрасте до 70 лет. Основание: повышение МПК в области позвоночника на 5,1% (4,2–7,2%) с более выраженной положительной динамикой МПК в области позвоночника – 84,0% пациенток; повышение МПК в области ШБ на 2,9% (1,9–3,8%), в ПОБ на 2,7% (1,4–3,5%). Отмечена также высокая приверженность пациенток лечению – 92,3%.
Experience of Using Alendronic Acid (Ostalon) in a Combination Therapy of Postmenopausal Osteoporosis
A.P. Shepelkevich1, V.L. Lobashova1, N.A. Vasilyeva2
1 Belarusian State Medical University
2 Republican Center of Medical Rehabilitation and Balneology
Contact person: Alla Petrovna Shepelkevich, alusha71@mail.ru
There are presented results obtained from prospective clinical study on assessing efficacy of combination therapy
of postmenopausal osteoporosis (including non-pharmacological methods, drug combining Calcium Carbonate
500 mg and cholecalciferol 400 ME together with alendronic acid (Ostalon) 70 mg per week) administered
to females under 70.
It was found that a combination therapy applied for 12 weeks in patients with osteoporosis resulted in elevated bone mineral density in the spine by 5.1% (4.2–7.2%) that had a more pronounced positive dynamics in 84.0% of patients, femoral neck – by 2.9% (1.9–3.8%), proximal femur – by 2.7% (1.4–3.5%). High compliance with treatment was noted in patients reaching up to 92.3%.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.