Оценка эффективности препаратов золедроновой кислоты для парентерального введения
- Аннотация
- Статья
- Ссылки
- English
Золедроновая кислота обладает антирезорбтивным действием, поэтому используется при различных заболеваниях костной ткани, включая остеопороз.
В настоящее время широкое распространение получили дженерики золедроновой кислоты, в том числе Остеостатикс.
Цель – сравнить эффективность дженерика золедроновой кислоты в дозе 5 мг (Остеостатикс) и оригинального препарата золедроновой кислоты в дозе 5 мг (Акласта) при постменопаузальном остеопорозе.
Материал и методы. В течение 2021 и 2022 гг. обследовано 139 женщин с постменопаузальным остеопорозом. Пациентки были разделены на две группы. Первая группа (n = 69) применяла дженерик золедроновой кислоты Остеостатикс, вторая группа (n = 70) – оригинальный препарат золедроновой кислоты Акласта. В дополнение к назначенной терапии все пациентки ежедневно получали 1000 мг карбоната кальция и 2000 МЕ витамина D.
Повторное измерение минеральной плотности костной ткани (МПКТ) проводили через 6 и 12 месяцев после инфузии препарата золедроновой кислоты.
Результаты. Через 6 и 12 месяцев после лечения в обеих группах отмечено статистически значимое увеличение МПКТ относительно исходного уровня как в поясничном отделе позвоночника, так и в шейке бедра. При этом различий в прибавке МПКТ между группами не зафиксировано.
Динамика изменений через 6 и 12 месяцев после инфузии золедроновой кислоты свидетельствовала о сходной эффективности оригинального препарата и его дженерика.
Заключение. Эффективность дженерика золедроновой кислоты Остеостатикс в дозе 5 мг сопоставима с эффективностью оригинального препарата Акласта.
Золедроновая кислота обладает антирезорбтивным действием, поэтому используется при различных заболеваниях костной ткани, включая остеопороз.
В настоящее время широкое распространение получили дженерики золедроновой кислоты, в том числе Остеостатикс.
Цель – сравнить эффективность дженерика золедроновой кислоты в дозе 5 мг (Остеостатикс) и оригинального препарата золедроновой кислоты в дозе 5 мг (Акласта) при постменопаузальном остеопорозе.
Материал и методы. В течение 2021 и 2022 гг. обследовано 139 женщин с постменопаузальным остеопорозом. Пациентки были разделены на две группы. Первая группа (n = 69) применяла дженерик золедроновой кислоты Остеостатикс, вторая группа (n = 70) – оригинальный препарат золедроновой кислоты Акласта. В дополнение к назначенной терапии все пациентки ежедневно получали 1000 мг карбоната кальция и 2000 МЕ витамина D.
Повторное измерение минеральной плотности костной ткани (МПКТ) проводили через 6 и 12 месяцев после инфузии препарата золедроновой кислоты.
Результаты. Через 6 и 12 месяцев после лечения в обеих группах отмечено статистически значимое увеличение МПКТ относительно исходного уровня как в поясничном отделе позвоночника, так и в шейке бедра. При этом различий в прибавке МПКТ между группами не зафиксировано.
Динамика изменений через 6 и 12 месяцев после инфузии золедроновой кислоты свидетельствовала о сходной эффективности оригинального препарата и его дженерика.
Заключение. Эффективность дженерика золедроновой кислоты Остеостатикс в дозе 5 мг сопоставима с эффективностью оригинального препарата Акласта.


Введение
Остеопороз – хроническое прогрессирующее метаболическое заболевание скелета, характеризующееся низкой костной массой и нарушением микроархитектуры кости, что приводит к снижению прочности костей и повышению риска переломов [1]. К основным факторам риска развития остеопороза относят пожилой возраст и женский пол [2]. Данная патология может сочетаться с сахарным диабетом 2 типа [3], сердечно-сосудистыми заболеваниями [4], саркопенией [5, 6], ожирением [7], синдромом падений [8] и старческой астенией [9].
Остеопороз является частой причиной переломов. Наиболее распространенными локализациями остеопоротических переломов признаны позвонки, бедро и дистальный отдел предплечья [10].
С учетом прогнозируемого возрастания случаев остеопоротических переломов необходимы современные методы лечения, позволяющие снизить риск таковых [11].
К основным терапевтическим средствам при постменопаузальном остеопорозе относятся бисфосфонаты [2, 12]. Будучи эффективными препаратами, они включены как в российские, так и в зарубежные рекомендации по лечению остеопороза [13, 14].
Бисфосфонаты – производные неорганического пирофосфата. Первое поколение, простые бисфосфонаты, представлено этидронатом, клодронатом и тилудронатом, второе поколение, азотсодержащие бисфосфонаты с короткими алкильными цепями, – памидронатом, неридронатом и алендронатом, третье поколение, азотсодержащие бисфосфонаты с разветвленной или кольцевой структурой, – ибандронатом, золедронатом, минодронатом и ризедронатом [15].
Антирезорбтивная активность бисфосфонатов обусловлена наличием в молекуле азотистой или аминогруппы [16]. При этом она различается у разных препаратов. Так, антирезорбтивный потенциал этидроната алендронат превосходит в 500 раз, золедронат – в 10 тыс. раз [15].
Препараты золедроновой кислоты (золедронат) предназначены для внутривенного введения. Их используют при различных заболеваниях костной ткани, включая остеопороз [17], а также для профилактики повторных переломов [1].
Баланс синтеза и разрушения костной ткани зависит от многих факторов [18]. Важным этапом в формировании новой костной ткани является активное связывание неорганического пирофосфата с кристаллами гидроксиапатита. Азотсодержащие бисфосфонаты, такие как золедронат, являются аналогами пирофосфата с более высокой аффинностью связывания. Они предпочтительно связываются с костной тканью, особенно в тех местах, в которых идет активный процесс реконструкции. Связанные с костью бисфосфонаты высвобождаются вследствие разрушения кости остеокластами. После высвобождения бисфосфонаты поглощаются остеокластами. Далее они связываются с фарнезил-дифосфат синтазой, блокируя ее активность. Фарнезил-дифосфат синтаза – важный внутриклеточный фермент в цепи редуктазы 3-гидрокси-3-метилглютарил-кофермента А. Она отвечает за выработку изопреноидных липидов, холестерина и других стеринов. Ингибирование этого пути предотвращает посттрансляционную модификацию небольших белков, включая гуанозинтрифосфатсвязывающие белки, которые необходимы для обеспечения активности и выживания остеокластов [19]. Таким образом, золедроновая кислота усиливает апоптоз остеокластов, тем самым снижая резорбцию и потерю костной ткани. При этом золедронат не влияет на активность остеобластов и формирование костной ткани. Следовательно, его применение изменяет метаболическую активность костной ткани в сторону костеобразования, уменьшая потерю костной массы. В конечном итоге это приводит к увеличению костной массы и плотности кости [19].
В настоящее время все большую популярность приобретают дженерики. Дженерик – лекарственный препарат, предназначенный для возможной замены инновационного лекарственного препарата, выпускаемый без лицензии компании, производящей оригинальный лекарственный препарат, и размещаемый на рынке после окончания срока действия патента [1].
Дженерики терапевтически эквивалентны своим дорогостоящим брендовым аналогам, но намного дешевле. Они считаются незаменимыми заменителями дорогостоящих оригинальных препаратов. При этом дженерики должны соответствовать стандартам качества, эффективности и безопасности, которые предъявляются к оригинальным препаратам.
Появление дженериков бисфосфонатов позволяет сделать терапию остеопороза экономически более доступной без ущерба для качества оказываемой медицинской помощи [20, 21]. Оригинальным препаратом золедроновой кислоты является Акласта, одним из его дженериков – Остеостатикс.
Целью настоящего исследования стало сравнение эффективности дженерика золедроновой кислоты в дозе 5 мг (Остеостатикс) и оригинального препарата золедроновой кислоты в дозе 5 мг (Акласта) у пациенток с постменопаузальным остеопорозом.
Материал и методы
Исследование проводилось на базе Самарского областного межведомственного центра профилактики остеопороза.
В течение 2021 и 2022 гг. обследовано 139 женщин с постменопаузальным остеопорозом.
Пациентки были разделены на две группы. Первая группа (n = 69) применяла дженерик золедроновой кислоты Остеостатикс, вторая группа (n = 70) – оригинальный препарат золедроновой кислоты Акласта.
После подписания информированного добровольного согласия на участие в исследовании каждая пациентка в соответствии со стандартным протоколом лечения получила одну инфузию золедроновой кислоты в дозе 5 мг [1].
Помимо этого больные ежедневно получали 1000 мг карбоната кальция и 2000 МЕ витамина D.
Диагноз «остеопороз» устанавливали на основании уровня минеральной плотности костной ткани (МПКТ) в шейке бедра и поясничном отделе позвоночника, определяемого с помощью двухэнергетической рентгеновской денситометрии (dual-energy X-ray absorptiometry, DXA). Повторно уровень МПКТ измеряли через 6 и 12 месяцев после инфузии препарата золедроновой кислоты.
Статистический анализ данных проводили с помощью пакета программ SPSS Statistics 21.0. Для определения нормальности распределения переменных использовали критерии Колмогорова – Смирнова и Шапиро – Уилка. Полученные результаты представляли в виде среднего значения и стандартного отклонения (M ± SD). Для отражения динамики уровня МПКТ через 6 и 12 месяцев использовали среднее значение и 95%-ный доверительный интервал (ДИ). Исходные параметры в группах сравнивали с помощью t-критерия Стьюдента для независимых групп. С целью сравнения частоты признаков между двумя группами применяли хи-квадрат. Для оценки изменения уровня МПКТ к 6-му и 12-му месяцам от начала лечения применяли t-критерий Стьюдента для парных выборок. Значение считалось статистически значимым при p < 0,05.
Результаты
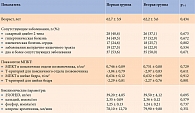
Клинические и лабораторные параметры пациенток двух групп представлены в табл. 1.
Обе группы были сопоставимы по возрасту, наличию сопутствующих заболеваний, показателям МПКТ в поясничном отделе позвоночника и шейке бедра, уровню 25-гидроксивитамина D (25(OH)D), кальция и фосфора в крови, а также по клиренсу креатинина.
Согласно результатам DXA, через шесть месяцев после введения золедроновой кислоты МПКТ увеличилась (табл. 2). При этом в обеих группах повышение показателя относительно исходного было не только статистически значимым (p < 0,001), но и сопоставимым.
Через 12 месяцев после лечения в обеих группах отмечено статистически значимое (p < 0,001) увеличение уровня МПКТ как в поясничном отделе позвоночника, так и в шейке бедра по сравнению с исходным уровнем (табл. 3). При этом в отношении прибавки МПКТ группы не различались.
Динамика уровня МПКТ через 6 и 12 месяцев после инфузии золедроновой кислоты доказывает сопоставимую эффективность оригинального препарата и его дженерика.
Обсуждение
Постменопаузальный остеопороз довольно распространенное заболевание, которое нередко становится причиной смерти и инвалидизации женщин пожилого возраста [18].
Бисфосфонаты – препараты, широко используемые в клинической практике для лечения остеопороза. Они обладают высоким сродством с кристаллами гидроксиапатита костей. Большинство бисфосфонатов остаются на поверхности кости в течение длительного периода времени [22].
На протяжении многих лет бисфосфонаты демонстрируют свою безопасность и эффективность. Об этом свидетельствуют увеличение МПКТ и снижение риска переломов [22]. Преимущества профилактики переломов и повышения уровня МПКТ сохраняются в течение многих лет во время и после лечения бисфосфонатами. Другими положительными аспектами применения этих препаратов являются снижение трат на здравоохранение, заболеваемости и значительное увеличение выживаемости [23]. Согласно данным С.Ю. Шкиреевой и соавт. (2023), бисфосфонаты с успехом могут использоваться для длительного лечения остеопороза [24].
Золедронат применяется для лечения многих метаболических заболеваний костей [19]. Золедроновая кислота усиливает апоптоз остеокластов, тем самым снижая резорбцию и потерю костной ткани. Применение золедроната не влияет на активность остеобластов и формирование костной ткани. Следовательно, его применение изменяет метаболическую активность костной ткани в сторону костеобразования. В конечном итоге это приводит к увеличению костной массы и плотности кости, поскольку процесс образования кости преобладает над процессом ее разрушения [16].
В работе X. Li и соавт. (2023) доказано, что золедроновая кислота является мощным антирезорбтивным средством, повышающим МПКТ и снижающим риск переломов при постменопаузальном остеопорозе [25].
Согласно данным M. McClung и соавт. (2013), у лиц с низкотравматическими переломами бедра трехлетний прием золедроновой кислоты способствовал снижению риска смерти на 28% [23].
В ходе ретроспективного когортного исследования, проведенного J. Fan и соавт. (2023), установлено, что золедроновая кислота предотвращала быструю потерю костной массы после инструментального спондилодеза [26]. Потеря костной массы в позвоночнике составила 0,76 ± 4,71%. В группе, не получавшей лечения, костная масса уменьшилась на 11,47 ± 16,45% (р < 0,001). Изменение МПКТ в шейке бедренной кости у получавших и не получавших лечения составило +1,52 ± 5,88 и -1,28 ± 6,58% соответственно (р = 0,036). Результаты исследования свидетельствуют о преимуществе периоперационного внутривенного введения золедроновой кислоты в качестве антиостеопоротического средства для предотвращения быстрой потери костной массы окружающих позвонков после инструментального спондилодеза. Авторы работы предположили, что женщинам с остеопорозом в период постменопаузы следует проводить интенсивное лечение остеопороза в периоперационном периоде.
Золедроновая кислота также показана лицам пожилого и старческого возраста. Согласно данным A. Johansen и соавт. (2023), четверть гериатрических пациентов умирали в течение года после перелома шейки бедра [27]. Кроме того, немаловажным фактором риска переломов была старческая астения. Внутривенное введение золедроната снижало риск повторных переломов через шесть месяцев. Был сделан вывод, что золедронат – высокоэффективное средство первой линии для лечения остеопороза.
Золедроновая кислота безопасна при сопутствующей сердечно-сосудистой патологии. В ходе ретроспективного когортного исследования L. Spangler и соавт. (2023) оценивали риск инсульта (ишемического или геморрагического) и инфаркта миокарда у женщин в период постменопаузы и мужчин, которые начинали лечение остеопороза деносумабом или золедроновой кислотой [28]. В данной популяции рассчитывали кумулятивные риски на 6-, 12‐ и 36‐месячный периоды, а также оценивали скорректированные коэффициенты риска и различия. Из баз данных MarketScan и Optum были выбраны 96 611 и 73 127 пациентов. На основании данных MarketScan и Optum через 36 месяцев соотношение рисков (референтная группа золедроновой кислоты) составило 1,22 (95% ДИ 0,77–1,66) и 0,97 (95% ДИ 0,63–1,32) для инфаркта миокарда, а также 1,00 (95% ДИ 0,61–1,40) и 0,87 (95% ДИ, 0,56–1,17) для инсульта соответственно.
Золедронат продемонстрировал высокую клиническую и экономическую эффективность в лечении остеопороза [29–31].
Способ введения золедроната (внутривенно) обусловливает целесообразность его применения у пациентов с непереносимостью или противопоказаниями к назначению пероральных бисфосфонатов.
Использование золедроната в качестве начальной терапии для профилактики постменопаузального остеопороза оправданно у пациентов с очень высоким риском переломов [2].
Результаты нашего исследования позволяют сделать вывод, что отечественный препарат Остеостатикс обладает высокой эффективностью, сходной с эффективностью оригинального препарата Акласта. Так, через 6 и 12 месяцев после однократной внутривенной инфузии 5 мг препарата Остеостатикс МПКТ увеличилась как в поясничном отделе позвоночника, так и в шейке бедренной кости.
Заключение
Эффективность дженерика золедроновой кислоты Остеостатикс в дозе 5 мг сопоставима с эффективностью оригинального препарата золедроновой кислоты Акласта. Следовательно, российский препарат Остеостатикс является эффективным средством для комплексной терапии постменопаузального остеопороза.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Финансирование
Исследование не имело спонсорской поддержки.
I.A. Shafieva, PhD, S.V. Bulgakova, MD, PhD, D.P. Kurmaev, PhD, E.V. Treneva, PhD
Clinics of Samara State Medical University
Samara State Medical University
Ministry of Health of the Samara region
Contact person: Irina A. Shafieva, ifabtdf@yandex.ru
Bisphosphonates are one of the main drugs for the treatment of postmenopausal osteoporosis. This group of drugs includes zoledronic acid (zoledronate), used for intravenous administration. Zoledronic acid has an antiresorptive effect and is used to treat various bone diseases, including osteoporosis. Currently, generic preparations of zoledronic acid, including Osteostatics, have become widespread.
Aim – to compare the effectiveness of the generic preparation of zoledronic acid 5 mg (Osteostatics) with the original preparation of zoledronic acid 5 mg (Aclasta) in postmenopausal osteoporosis.
Material and methods. During 2021–2022, we examined 139 patients with postmenopausal osteoporosis. The patients were divided into two groups. The first group (69 people) received a generic drug (generic) of zoledronic acid Osteostatics. The second group (70 people) is the original preparation of zoledronic acid Aclasta. All patients additionally received 1000 mg of calcium carbonate and 2000 IU of vitamin D daily.
Patients of both groups repeated measurement of bone mineral density (BMD) 6 and 12 months after infusion of zoledronic acid.
Results. After 6 months and 12 months after treatment, both groups showed a statistically significant increase in BMD in both the lumbar spine and hip neck, compared with the baseline level. At the same time, there were no differences between the increase in BMD between the two groups of patients receiving Osteostatics and Aclasta. The dynamics of the increase in BMD after 6 months and 12 months after the infusion of zoledronic acid indicates a similar effectiveness of the original and generic drugs.
Conclusion. Effectiveness of the generic preparation of zoledronic acid Osteostatics at a dose of 5 mg is comparable to the original preparation Aclasta.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.