Неврологические заболевания и остеопороз
- Аннотация
- Статья
- Ссылки
- English
Введение
С проблемой остеопороза и связанных с ним переломов сталкиваются врачи разных специальностей.
Традиционно остеопороз рассматривается как возраст-ассоциированное состояние. Так, согласно статистике, в России среди лиц 50 лет и старше остеопороз встречается у 34% женщин и 27% мужчин, остеопения – у 43 и 44% соответственно [1].
Однако остеопороз является полиэтиологическим заболеванием. Его развитие может быть связано с наследственной предрасположенностью, особенностями образа жизни и физической активности, состоянием эндокринной системы и наличием сопутствующих заболеваний, приемом ряда лекарственных препаратов, старением организма и индивидуальной продолжительностью жизни [1].
Социальная значимость остеопороза определяется его последствиями – переломами тел позвонков и костей периферического скелета, что приводит к увеличению затрат здравоохранения, высоким показателям нетрудоспособности, инвалидизации и смертности.
Необходимо отметить, что остеопорозу вследствие различных заболеваний нервной системы, также имеющих большую медико-социальную значимость, уделяется существенно меньшее внимание, чем постменопаузальному остеопорозу.
Тем не менее известно, что некоторые неврологические заболевания ассоциированы со снижением плотности костной ткани, повышенным риском падений и переломов. Изменение образа жизни, вторичное по отношению к неврологическим расстройствам, может иметь неблагоприятное последствие для костной ткани. Так, снижение уровня физической активности вплоть до иммобилизации является чрезвычайно важным фактором стремительной потери костной массы у пациентов любого возраста. Развитию вторичного остеопороза могут способствовать препараты для лечения поражений как центральной, так и периферической нервной системы. Установлено, что селективные ингибиторы обратного захвата серотонина, нейролептики, противоэпилептические препараты играют независимую роль в развитии и прогрессировании патологии. Ассоциированные с выраженной инвалидизацией и/или жизнеугрожающими состояниями аутоиммунные заболевания центральной и периферической нервной системы, а также нервно-мышечной системы обусловливают необходимость применения глюкокортикостероидов, повышающих риск развития лекарственного остеопороза и переломов.
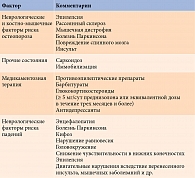
В настоящее время выделяют следующие неврологические заболевания и ассоциированные с ними состояния, характеризующиеся повышенным риском развития остеопороза и падений (табл. 1).
Интерфейс «мозг – кость»
Ремоделирование костной ткани обеспечивается эндокринными, паракринными, механическими и нейронными факторами.
Изучение вклада нейрональной сигнализации в регуляцию ремоделирования и гомеостаза костной ткани началось более 20 лет назад с оценки взаимосвязи уровня лептина и трабекулярного костного индекса [2]. После того как стало очевидным, что пути, соединяющие мозг и кость, играют решающую роль в регуляции энергии и костном метаболизме, было проведено большое количество исследований, посвященных интерфейсу «мозг – кость». Было показано, что как симпатическая, так и парасимпатическая нервная система влияет на состояние костной ткани через различные пути. Помимо лептина указывается роль серотонина, адипонектина, циркадных генов, нейропептида Y, мускариновых, никотиновых и β-адренорецепторов [3, 4].
Обсуждается также связь между возникновением остеопороза и психологическим стрессом. Она реализуется за счет активации гипоталамо-гипофизарно-надпочечниковой оси, передачи сигналов глюкокортикостероидов и изменения реакции факторов роста, влияющих на костную массу (инсулиноподобный фактор роста 1) [5]. Было установлено, что белки костного метаболизма остеокальцин, остеопонтин и склеростин воздействуют на центральную нервную систему in vivo [6]. Более того, остеогенный гормон остеокальцин необходим для активации реакции на острый стресс посредством ингибирования парасимпатической нервной системы [7]. Остеокальцин способен проникать через гематоэнцефалический барьер, усиливать синтез серотонина, дофамина и норадреналина, подавлять секрецию γ-аминомасляной кислоты и связываться с нейронами ствола и среднего мозга, а также гиппокампа [8]. Паратиреоидный гормон способен преодолевать гематоэнцефалический барьер и в качестве регулятора метаболизма кальция и фосфатов обеспечивать связь между когнитивной функцией и здоровьем костей. Гиперпаратиреоз ассоциируется не только с потерей костной массы за счет активации остеокластов и физической слабостью, но и со снижением когнитивных функций [9].
Таким образом, ось «мозг – кость» важна для метаболизма скелета, сенсорной иннервации и эндокринных взаимодействий между этими органами.
Значительные клинические данные в отношении многих неврологических заболеваний указывают на то, что изменения в нервной системе связаны с нарушениями физиологии кости, что приводит к снижению минеральной плотности кости и содержания в ней минеральных веществ, изменению ее микроархитектоники и прочности, что в конечном итоге обусловливает развитие остеопении и остеопороза, ассоциирующихся с повышением риска переломов.
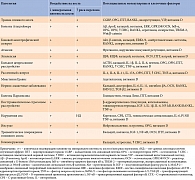
Недавние клинические и доклинические исследования способствовали открытию общих гормональных, иммунных, молекулярных и клеточных путей, на которые воздействуют неврологические расстройства и которые могут опосредовать вторичные эффекты на кость (табл. 2). К ним относятся устойчивая активация периферической и центральной нервной системы, воспалительных путей, изменение передачи сигналов глутамата, нарушение симпатической и парасимпатической регуляции, регуляции гипоталамо-гипофизарно-надпочечниковой оси.
Эпилепсия
Согласно данным экспертов Всемирной организации здравоохранения, в 2021 г. в мире на 1000 населения приходилось от 4 до 10 страдающих эпилепсией [10]. Для данного заболевания характерны повторяющиеся припадки в виде кратковременных непроизвольных судорог в какой-либо части тела (парциальные судороги) или по всему телу (генерализованные судороги), иногда сопровождающиеся потерей сознания и утратой контроля над функциями тазовых органов.
Эпилепсия ассоциируется с повышенной травматизацией пациентов, замедлением функционального восстановления, усугублением когнитивных и эмоциональных нарушений, стигматизацией и снижением качества жизни [11].
У пациентов с эпилепсией риск развития остеопороза и остеопоротических переломов в два – шесть раз выше, чем в общей популяции [12]. Малоподвижный образ жизни в помещении и использование противоэпилептических препаратов, которые могут привести к нарушению координации и метаболизма кальция, способствуют ухудшению здоровья костей [13, 14].
Изучение процессов, приводящих к возникновению остеопороза при эпилепсии, продолжается. Текущие данные указывают на измененный метаболизм витамина D и натрия, повышенный уровень паратиреоидного гормона и нарушение регуляции метаболизма костной ткани на фоне приема противоэпилептических препаратов [15].
Рассеянный склероз
Распространенность рассеянного склероза достигает 112 на 100 тыс. случаев [16]. Патология часто становится причиной нетрудоспособности и инвалидизации лиц молодого и среднего возраста [17].
На сегодняшний день получены данные о высокой частоте случаев снижения минеральной плотности кости при рассеянном склерозе [18].
В ходе крупного клинического исследования было обнаружено, что распространенность остеопороза значительно выше у пациентов с рассеянным склерозом по сравнению со здоровым контролем (16–26 против 6–15%) после поправки на такие факторы, как возраст, пол, история переломов и сопутствующие заболевания.
При рассеянном склерозе риск развития остеопороза увеличивается более чем в два раза (скорректированное отношение рисков (ОР) 2,41 при 95%-ном доверительном интервале (ДИ) 1,82–3,19) [19].
Согласно результатам метаанализа (суммарно 13 906 пациентов), встречаемость остеопороза в данной популяции составляет 17% (95% ДИ 14–20), остеопении – 43% (95% ДИ 35–51) [20].
К потенциальным факторам риска снижения минеральной плотности кости у пациентов с рассеянным склерозом относят дефицит витамина D, длительность заболевания более семи лет, общую дозу глюкокортикостероидов более 15 г, тяжесть заболевания, снижение способности передвигаться, изменение парасимпатической нервной системы [15].
С учетом большой частоты падений среди лиц с рассеянным склерозом и связи между падениями и переломами необходимо более глубокое изучение изменений минеральной плотности кости и причин развития остеопороза у таких пациентов.
Болезнь Паркинсона
Болезнь Паркинсона – второе по распространенности неврологическое заболевание и наиболее частое нейродегенеративное двигательное расстройство. Так, показатели распространенности и заболеваемости составляют примерно 108–257 на 100 тыс. и 11–19 на 100 тыс. в год соответственно [21].
Для болезни Паркинсона характерны прогрессирующая дегенерация и гибель дофаминергических нейронов. Отличительным ее признаком является образование фибриллярных агрегатов во внутринейрональных включениях [22].
Ведущими двигательными симптомами болезни Паркинсона признаны тремор, ригидность, брадикинезия или акинезия, постуральная неустойчивость. Нарушение походки и равновесия может стать причиной падений. Следует отметить, что терапия ингибиторами холинэстеразы не приводит к значительному увеличению скорости ходьбы и уменьшению числа падений у лиц с болезнью Паркинсона [23].
Кроме того, у пациентов с болезнью Паркинсона часто наблюдается потеря веса. При этом масса тела снижается по мере прогрессирования патологии [24, 25].
Согласно результатам многоцентрового когортного исследования, вероятность переломов в регрессионной модели Кокса с факторами риска FRAX в большей степени ассоциировалась с наличием болезни Паркинсона, рассеянного склероза, хронической обструктивной болезни легких, остеоартрита и болезни сердца. При этом болезнь Паркинсона была признана наиболее важным фактором по сравнению с другими изученными факторами – ОР с поправкой на возраст 2,2 (95% ДИ 1,6–3,1; р < 0,001) [26].
Метаанализ результатов 23 исследований, проведенных с целью оценки связи между болезнью Паркинсона и остеопорозом, показал, что у пациентов с болезнью Паркинсона минеральная плотность кости была значительно ниже. По сравнению со здоровым контролем они были подвержены более высокому риску развития остеопороза (OР 2,61 (95% ДИ 0,69–4,03)) и переломов (ОР 2,28 (95% ДИ (1,83–2,83)). Сообщалось также, что у женщин с болезнью Паркинсона риск развития остеопороза оказался выше, чем у мужчин (OР 0,45 (95% ДИ (0,29–0,68)) [27].
В другом метаанализе, в котором оценивались результаты 15 исследований, также отмечен более высокий риск развития остеопороза при болезни Паркинсона (ОР 1,18 (95% ДИ 1,09–1,27)). Однако в отличие от предыдущего метаанализа таковой был выше у мужчин – OР 2,44 (95% ДИ 1,37–4,34) против 1,16 (95% ДИ 1,07–1,26) соответственно [28].
Симпатическая иннервация является фундаментальной для интеграции скелетного гомеостаза с составом тела, главным образом за счет подавления образования и увеличения резорбции костной ткани вследствие увеличения продукции рецепторного активатора лиганда ядерного фактора κB (RANKL). Таким образом, дофаминергические изменения при болезни Паркинсона могут трансформироваться в измененную симпатическую иннервацию скелета [29]. Дофаминовые рецепторы (DRD) экспрессируются в остеобластах (DRD-3 и DRD-4) и остеокластах (DRD-1 и DRD-3) и влияют на гомеостаз кости. Агонист дофаминовых рецепторов леводопа ингибирует дифференцировку остеокластов и остеогенез [30].
Вегетативные расстройства при болезни Паркинсона или ее лечение могут влиять на ремоделирование кости за счет усиленной адренергической передачи сигналов, что приводит к разобщению процессов остеогенеза и резорбции. Однако фундаментальных или трансляционных исследований для проверки этих гипотез не проводилось.
Нарушить процесс костеобразования у пациентов с болезнью Паркинсона способны саркопения и иммобилизация. Не исключена роль эндокринных изменений. Так, установлено, что у нелеченых лиц с болезнью Паркинсона возникают гипоталамические нарушения, которые могут привести к снижению гипоталамических рилизинг-факторов и, как следствие, отрицательным эффектам на костную ткань [31, 32].
Представлены данные о низких уровнях минеральной плотности кости и витамина D уже на ранних стадиях болезни Паркинсона.
Современные исследователи подчеркивают важность раннего скрининга в отношении остеопороза при болезни Паркинсона [33, 34].
В клинической практике возможны трудности в диагностике остеопороза в данной популяции. У лиц с болезнью Паркинсона отмечаются постуральные нарушения, такие как камптокормия, или синдром согнутой спины, что следует дифференцировать от клинических проявлений множественных компрессионных деформаций тел позвонков [35].
Необходимо учитывать, что оба эти состояния могут иметь место у одного и того же больного.
Болезнь Альцгеймера
Согласно оценкам экспертов Всемирной организации здравоохранения, деменцией страдают 8,1% женщин и 5,4% мужчин старше 65 лет [36, 37]. Болезнь Альцгеймера поражает более чем одного человека из девяти, или 11,3%, в возрасте 65 лет и старше.
Болезнь Альцгеймера представляет собой необратимое прогрессирующее заболевание, характеризующееся аномальной агрегацией амилоидного β-пептида и накоплением гиперфосфорилированного тау-белка, что приводит к нейровоспалению, развитию окислительного стресса и утрате холинергических, синаптических и когнитивных функций [38].
Патологически и иммунологически болезнь Альцгеймера и остеопороз различны. Однако результаты многочисленных исследований свидетельствуют о двунаправленном и взаимно антагонистическом взаимодействии этих двух возрастных расстройств. Установлено, что по сравнению с общей популяцией у женщин в постменопаузе более высок риск развития болезни Альцгеймера [39]. Эстрогены могут влиять как на старение мозга, так и на метаболизм костной ткани. Возрастные изменения воспалительных процессов, в том числе повышенный уровень циркулирующего интерлейкина 6 и снижение активности Т-регуляторных клеток, могут способствовать потере костной массы через локальную активацию остеокластов и снижению когнитивных функций через повышение уровня нейронального α2-макроглобулина – ингибитора протеазы, вовлеченного в патогенез болезни Альцгеймера [15].
Показано, что снижение минеральной плотности кости в шейке бедра связано с риском развития болезни Альцгеймера у женщин (ОР 2,04 (ДИ 1,11–3,75)), но не у мужчин (ОР 1,33 (0,46–3,86)) [40].
В ряде исследований установлено, что у пациентов с болезнью Альцгеймера снижена минеральная плотность бедренной кости и почти в два раза выше риск перелома бедра [41–43].
Связь между остеопорозом и болезнью Альцгеймера также подтверждается корреляцией между значениями минеральной плотности кости, измеренными с помощью рентгеновской денситометрии, и объемом мозга, оцененным с помощью магнитно-резонансной томографии, что отражает потери минералов в костной ткани и нейронов в головном мозге соответственно [44, 45]. Аномально выраженное отложение амилоида, по-видимому, связано с сигнальным каскадом RANKL, что нарушает баланс между остеогенезом и резорбцией, поскольку гиперэкспрессия амилоидного β-пептида может иметь место как в головном мозге, так и в костной ткани. Более высокий риск развития остеопороза при болезни Альцгеймера отчасти могут объяснить отсутствие физической активности и дефицит витамина D. Так, более низкий уровень 25(OH)D в плазме крови был связан с повышенным риском развития деменции и болезни Альцгеймера. Рассматривается также роль витамин D-связывающего белка в снижении уровня витамина D и повышенной агрегации амилоидного β-пептида [46].
При болезни Альцгеймера прогрессирует нарушение походки, что увеличивает риск падений [47].
Необходимо отметить, что перелом скелета резко ухудшает качество жизни и приводит к преждевременной смерти пожилых пациентов с болезнью Альцгеймера [39]. Неподвижность вследствие перелома усугубляет течение соматических заболевания и увеличивает бремя, которое несут члены семьи, обеспечивающие уход [48].
Цереброваскулярные заболевания
Цереброваскулярные заболевания широко распространены у лиц пожилого и старческого возраста. Они приводят к нарушению когнитивных и постуральных функций.
В данной популяции переломы в основном связаны с высоким риском сердечно-сосудистых событий. Известно, что у пациентов с сердечно-сосудистыми заболеваниями риск переломов выше [49].
Инсульт – одна из актуальных неврологических проблем. Частым исходом инсульта является гемиплегия, приводящая к потере произвольных движений, иммобилизации и сенсорным нарушениям.
После инсульта нередко документируют остеопороз или остеопению и повышенный риск переломов.
Влияние инсульта на здоровье костей и риск переломов остается предметом активного изучения [50]. Установлено, что относительный риск переломов у госпитализированных по поводу инсульта более чем в семь раз превышает таковой в контрольной популяции того же возраста и пола [51].
Связь между переломами и сердечно-сосудистыми заболеваниями, в частности инсультом, объясняют механизмами, обусловливающими потерю костной массы [52, 53]. Атеросклероз и остеопороз часто возникают одновременно и могут иметь сходные патогенетические звенья. Так, окисленные липопротеины низкой плотности, участвующие в атерогенезе, могут ингибировать дифференцировку остеобластов [49, 54].
После перенесенного инсульта в пораженных или паретичных конечностях наблюдаются выраженное ухудшение качества и изменение геометрии кости, особенно в первые несколько месяцев. При этом отмечается сильная зависимость между состоянием кости и мышечной массой [55].
Снижение физической активности после перелома (особенно тазобедренного сустава) считается важным фактором развития сердечно-сосудистых заболеваний [56].
Цереброваскулярная патология и остеопороз являются взаимно провоцирующими состояниями. Так, согласно отечественным данным, переломы при минимальном уровне травмы отмечены у каждой пятой женщины через восемь – десять лет после первого перенесенного ишемического инсульта [57]. Постинсультная эпилепсия является ведущей причиной пароксизмальных состояний [11], что увеличивает риск падений и травм.
У лиц старше 50 лет без инсульта или деменции в анамнезе низкая минеральная плотность кости коррелирует с когнитивными нарушениями [58]. Изменения плотности кости и снижение исполнительной функции часто возникают одновременно. При этом остеопороз и остеопоротические переломы связаны с прогрессированием когнитивных нарушений [59].
Одной из защитных стратегий от падений являются снижение скорости ходьбы и замещение автоматизированной ходьбы более осознанной, что в свою очередь снижает внимание и замедляет время реакции при появлении других задач. Предполагается, что снижение когнитивных функций уменьшает ресурсы, необходимые для компенсации ухудшения автоматических моторных процессов, особенно равновесия. Реабилитационные мероприятия, направленные на восстановление функции равновесия, требуют учета статуса пациента [60].
Таким образом, у пациентов с инсультом необходим скрининг на наличие патологии костной системы [61]. Лечение остеопороза после инсульта может препятствовать снижению минеральной плотности кости, однако на сегодняшний день таких данных недостаточно [62]. Необходимо проведение дополнительных исследований, как фундаментальных, позволяющих проанализировать молекулярные механизмы потери костной массы и развития цереброваскулярной патологии, так и клинических, позволяющих сформировать рекомендации по скринингу и лечению этой категории пациентов, в частности каким больным оно показано, в какое время должно проводиться и какими препаратами.
Иммобилизация при неврологических заболеваниях
Дисфункциональный остеопороз, или остеопороз без использования, – состояние потери костной массы из-за локальной разгрузки скелета или системной иммобилизации.
Постиммобилизационный остеопороз отмечается при широком спектре неврологических нарушений, к наиболее драматичным из которых относится вегетативное состояние [63].
В целом критическое состояние, в том числе нейрореанимация, связано с усилением метаболизма костной ткани и нарушением баланса между резорбцией и остеогенезом. Это приводит к потере костной массы, подтверждаемой изменением уровней костных маркеров в сыворотке крови и минеральной плотности кости. Ключевым фактором потери костной массы у реанимационных больных помимо воспаления, недостаточного питания и дефицита витамина D является иммобилизация [64].
Иммобилизация приводит к немедленной потере костной ткани как в трабекулярном, так и в кортикальном скелете вследствие повышенной резорбции и сниженного остеогенеза. Ухудшение остеогенеза связано с высокими уровнями склеростина, секретируемого остеоцитами. Это одно из многих открытий, которое привлекло внимание к механочувствительным остеоцитам, встроенным в матрикс. Остеоциты воспринимают механическую нагрузку через механосенсоры, которые преобразуют внеклеточные механические сигналы во внутриклеточные биохимические и регулируют экспрессию генов. Остеоцитарные механосенсоры включают цитоскелет остеоцитов и дендритные отростки, ионные каналы, внеклеточный матрикс и др.
Таким образом, неиспользование представляет собой один из основных факторов, способствующих немедленной потере костной массы и развитию остеопороза, при этом решающее значение, по-видимому, имеет изменение в остеоцитарных путях [65].
У большинства перенесших тяжелую травму спинного мозга впоследствии развивается остеопороз. В данной клинической ситуации помимо связанной с иммобилизацией недостаточной нагрузки на длинную кость возможны другие механизмы потери плотности костной ткани. Установлено, что нейрональные нарушения и инвалидизация могут усилить эффекты RANKL и, как следствие, резорбцию кости [66].
При всей очевидности проблемы развития остеопороза вследствие иммобилизации в настоящее время практические рекомендации по его скринингу и профилактике отсутствуют.
Глюкокортикостероидный остеопороз
В неврологической практике глюкокортикостероиды применяются для лечения аутоиммунных заболеваний центральной и периферической нервной системы (рассеянный склероз, оптикомиелит, воспалительные полиневропатии, миастения, полимиозиты), вертеброгенной патологии, онкологических и системных дизиммунных заболеваний с вовлечением нервной системы.
Распространенность в популяции неврологических заболеваний, требующих назначения глюкокортикостероидов, достаточно высока, а продолжительность лечения может составлять от нескольких месяцев до года и более. Такая длительность терапии обусловливается необходимостью предотвращения инвалидизации и развития жизнеугрожающих состояний, таких как бульбарный синдром и слабость дыхательной мускулатуры (для миастении – миастенический криз), достижения стабилизации и последующего стойкого улучшения состояния.
Ассоциация риска переломов с приемом глюкокортикостероидов преимущественно характерна для пероральной терапии. Наибольшая опасность связана с использованием глюкокортикостероидов в суточных дозах, эквивалентных 7,5 мг преднизолона и выше.
Следовательно, все неврологические больные, обычно получающие глюкокортикостероиды из расчета 1 мг/кг массы тела более трех месяцев, находятся в группе риска развития остеопороза и переломов [67].
Терапия остеопороза и ее специфика у неврологических больных
Бифосфонаты рекомендованы для предупреждения патологических переломов и повышения минеральной плотности кости у женщин с постменопаузальным остеопорозом (алендроновая кислота, ризедроновая кислота, ибандроновая кислота, золедроновая кислота), у мужчин с остеопорозом (алендроновая кислота, ризедроновая кислота, золедроновая кислота), у пациентов с глюкокортикостероидным остеопорозом (алендроновая кислота, ризедроновая кислота, золедроновая кислота). Следует помнить, что характерная для многих заболеваний нервной системы неспособность пациентов стоять или сидеть прямо по крайней мере 30 минут после приема препарата является ограничением к назначению пероральных бифосфонатов. В этой связи целесообразно рассмотреть возможность проведения парентеральной терапии, в том числе введения золедроновой кислоты, деносумаба, терипаратида.
Заключение
Исследования последних лет позволили лучше понять роль оси «мозг – кость», которая регулирует скелетный метаболизм, гормональный ответ и сенсорную иннервацию.
На сегодняшний день установлено, что не только различные неврологические расстройства способны влиять на состояние костной системы, но и нарушения костной системы могут влиять на состояние нервной системы. Так, изменения в головном мозге способны вызывать изменения в костной ткани, включая развитие остеопении или остеопороза, ассоциированных с повышенным риском переломов. Это связано со сложным взаимодействием нейронных, психологических (гипоталамо-гипофизарно-надпочечниковая ось), механических, клеточных (макрофаги, нейроны, остеобласты, остеокласты и др.) и молекулярных механизмов с образом жизни (падение, недоедание, отсутствие физической активности, дефицит витамина D) и специфической терапией (противоэпилептические препараты, глюкокортикостероиды и др.).
Современные методы лечения остеопороза могут быть актуальны для пациентов с неврологическими заболеваниями.
M.M. Tanashyan, MD, PhD, Prof., Corresponding member of the RASci., K.V. Antonova, MD, PhD, A.S. Mazur, N.Ye. Spryshkov
Research Center of Neurology, Moscow
Contact person: Ksenia V. Antonova, kseniya.antonova@mail.ru
Generalized data on the prevalence of osteoporosis are presented of osteoporosis in patients with various pathologies of the nervous system, including those with epilepsy, multiple sclerosis, Parkinson's disease, Alzheimer's disease. Concidered the topical issues concerning some common hormonal, immune and molecular mechanisms affected by neurological disorders and mediating secondary effects in the bone system. Also discussed the effect of specific therapy on the appearance of bone disorders and an increased risk of fractures. Special attention is paid to the therapy of osteoporosis aimed at increasing bone mineral density and preventing pathological fractures.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


