Опыт применения аналога человеческого инсулина ультракороткого действия глулизин (Апидра) у детей и подростков с сахарным диабетом 1 типа
- Аннотация
- Статья
- Ссылки
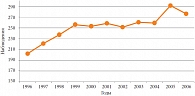

В настоящее время компенсация углеводного обмена с помощью адекватной инсулинотерапии – единственный способ профилактики ранней инвалидизации и смертности детей и подростков, страдающих сахарным диабетом 1 типа (СД 1). Заболеваемость и распространенность СД 1 в последние годы неуклонно растет. При этом во всем мире, в том числе в московском регионе, происходит драматическое уменьшение возраста впервые заболевших детей (рис. 1).
Данные многочисленных исследований, опубликованные в отечественных и зарубежных источниках, достаточно убедительно демонстрируют зависимость между степенью контроля гликемии и риском развития диабетических микрососудистых осложнений, как острых, так и хронических [1–6]. Сегодня большинство авторов согласны с тем, что использование в лечении СД 1 аналогов человеческого инсулина, полученных генно-инженерными методами, приводит к стойкому улучшению показателей углеводного обмена, маркером которого является уровень гликированного гемоглобина крови (НbА1с).
Не вызывает сомнения и эффективность интенсивной терапии СД 1 в профилактике острых и хронических заболеваний. Этот факт был убедительно доказан в 1990-х гг., когда данные исследования Diabetes Control and Complications Trial (DCCT) [2, 7] произвели настоящую революцию в лечении СД 1, продемонстрировав важность снижения уровней гликемии и НbА1с до нормальных значений. Кроме того, было показано, что интенсивную терапию СД 1 необходимо начинать до выявления осложнений [8, 9]. Во всем мире интенсивная инсулинотерапия рекомендована детям и подросткам, однако практические аспекты этого вида лечения все еще требуют более детальной проработки [9].
В этой статье описываются методы инсулинотерапии для профилактики острых и хронических осложнений СД 1 с точки зрения наиболее оптимального соответствия принципам интенсивной терапии СД 1 и особенностям ребенка или подростка. С одной стороны, российские и международные исследования [1, 3, 9] показали зависимость уровня НbА1с от самоконтроля гликемии, проводимого пациентом, то есть было доказано, что интенсивное лечение СД 1 зависит от частоты самоконтроля гликемии в динамике, а также от самостоятельного регулирования питания и физических упражнений. С другой стороны, достижение оптимального контроля гликемии у детей и подростков сопряжено с целым рядом трудностей, обусловленных различиями в пищевых привычках, физической активности, риском развития гипогликемии [9].
При всей оптимизации обследования и лечения СД 1 достаточно большое количество детей и подростков по разным причинам имеют НbА1с выше 8–9%. В 2008 г. средний уровень НbА1с у детей и подростков московского региона составил 8,3% [10]. Необходимость улучшения контроля гликемии очевидна, однако эффективное лечение детей и подростков с СД 1 представляет собой сложную задачу. Так, в исследовании DCCT [2], несмотря на жесткий контроль и усилия врачей, у подростков уровень НbА1с был выше, чем у взрослых (8,06 и 7,12% соответственно). С дебюта заболевания на протяжении всей своей жизни дети получают ежедневное инвазивное обследование (многократное взятие крови для исследования гликемии) и лечение (многократные инъекции инсулина).
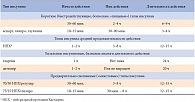
В этой связи представляется оправданным внедрение в практическую диабетологию методов и препаратов, не только улучшающих гликемический контроль заболевания, но и снижающих инвазивность обследования и лечения пациента [7, 3–9]. Достаточно эффективным методом лечения СД 1 у детей являются инсулиновые помпы, но на практике инсулиновая помпотерапия встречается нечасто. Кроме того, использование метода непрерывного подкожного введения инсулина возможно не во всех случаях [11]. В таблице 1 [12] приведены примеры практически всех типов инсулина, применяемых в детской диабетологии в наши дни. Препараты разбиты на группы по параметру продолжительности действия.
Инсулины короткого действия достигают пика активности медленнее, чем более современные быстродействующие аналоги инсулина. Для достижения оптимального эффекта они требуют введения за 30 минут до еды. Эта особенность фармакокинетики инсулинов короткого действия, как правило, затрудняет применение препаратов у детей. Тем не менее использование этого типа инсулина имеет свои преимущества, связанные именно с более продолжительным действием препарата. Например, у школьника утренняя инъекция обеспечит потребность в инсулине с утра до обеда. В этом случае отсутствие дополнительных инъекций делает интенсивную терапию более привлекательной и менее инвазивной. Однако это преимущество регулярного инсулина нивелируется недостатком повышения риска развития гипогликемии при пропуске обязательного перекуса.
Первый быстродействующий аналог инсулина (лизпро) стал доступен в клинической практике в 1996 г., позже появились другие препараты этого типа. Быстродействующие инсулиновые аналоги – продукты модификации химической структуры нативного инсулина путем замещения вариантов аминокислот в разных позициях на белке человеческого инсулина. Цель – укоротить начало и продлить действие (в сравнении с регулярным, растворимым, инсулином) – достигается аналогами за счет снижения скорости агрегации белка в димеры и гексамеры после инъекции, давая возможность мономерным молекулам аналога быстрее всасываться из места инъекции [9]. Аналоги инсулина быстрого действия (лизпро, аспарт и глулизин) широко применяются в клинической практике у детей и подростков, страдающих СД 1. Эти препараты могут использоваться непосредственно перед едой, а у маленьких детей, которые не имеют постоянной ежедневной базисной пищевой модели, могут вводиться сразу после еды [1, 13, 14].
Назначение быстродействующих аналогов инсулина за 5–15 минут до еды оказывает значительно большее влияние на уровень постпрандиальной глюкозы крови по сравнению с человеческим инсулином. По данным Андреи К. Стек (Andrea K. Steck) и соавт., при использовании быстродействующих аналогов у детей концентрация глюкозы крови варьирует от 0,6 до 2 ммоль/л [9]. Это важно, учитывая, что повышение уровня постпрандиальной гликемии – доказанный фактор риска развития кардиоваскулярных осложнений, зависимый от уровня НbА1с [1, 9]. Другим преимуществом быстродействующих аналогов инсулина относительно человеческого инсулина является уменьшение эпизодов гипогликемии [13, 15]. Некоторые исследования у взрослых демонстрировали незначительное снижение уровня НbА1с (от -0,1 до -0,2%) для быстродействующих аналогов (лизпро, аспарт и глулизин) по сравнению с лечением регулярным инсулином, хотя аналогичные исследования у детей не выявили никаких достоверных различий этого показателя [9, 16].
Инсулин глулизин (Апидра) – это быстродействующий аналог инсулина, применяемый для прандиальной (болюсной) инсулинотерапии, созданный с помощью генно-инженерного метода. При введении данного инсулина в диабетологическую практику было выполнено два пилотных исследования. У взрослых пациентов этот препарат был впервые применен и описан в 2006 г. в работе доктора Клауса Раве (Кlaus Rave) и соавт. [17]. В рандомизированном, стандартизированном, перекрестном, моноцентровом исследовании сравнивался постпрандиальный контроль гликемии при использовании глулизина до или через 15 минут после приема пищи и человеческого инсулина короткого действия типа регуляр, вводимого за 30 минут или непосредственно перед едой. Болюсная доза и для глулизина, и для регуляра была единой и составляла 0,15 ЕД/кг на одну инъекцию.
В исследовании приняли участие 20 больных СД 1 мужского и женского пола со средним возрастом 36,4 года и средним индексом массы тела (ИМТ) 26 кг/м2. После рандомизации десять пациентов получали глулизин, а десять – регуляр в качестве болюсной инсулинотерапии. В обеих группах изучались постпрандиальные параметры, вариабельность, максимальные и минимальные колебания гликемии и время этих колебаний. Оценивалась концентрация инсулина в сыворотке крови во время изменений гликемии. После статистической оценки описанных параметров было доказано, что инсулин глулизин более эффективен в качестве болюсной инсулинотерапии для улучшения гликемического контроля и приближения его к физиологическим целевым параметрам по сравнению с инсулином регуляр вне зависимости от назначения глулизина до или после приема пищи [17].
В детской диабетологической практике эффективность применения инсулина глулизин была описана проф. Томасом Данном (Тhomas Danne) и соавт. в 2005–2006 гг. [18]. Целью исследования в педиатрической практике было изучение фармакокинетики, постпрандиальных колебаний гликемии и безопасности инсулина глулизин в сравнении с человеческим инсулином типа регуляр при назначении обоих препаратов до еды у детей и подростков, страдающих СД 1. Всего в описываемое рандомизированное, моноцентровое, двойное слепое, перекрестное исследование были включены 10 детей в возрасте от 5 до 11 лет и 10 подростков в возрасте от 12 до 17 лет. Определялась гликемия до еды и концентрация инсулина в сыворотке крови. Далее пациентам, рандомизированным в группы глулизина и регуляра, в качестве болюсной инсулинотерапии вводились дозы препаратов из расчета 0,15 ЕД/кг за 2 минуты до приема стандартной пищи.
Авторы намеренно включили в дизайн исследования введение инсулина регуляр непосредственно перед едой, поскольку именно такая схема приема препарата (вопреки рекомендациям врачей) наиболее распространена в реальной жизни. Исследовались пре- и постпрандиальные параметры гликемии, вариабельность гликемии, максимальные и минимальные колебания, а также время колебаний гликемии с оценкой концентраций инсулина в сыворотке крови. В результате авторы пришли к заключению, что по фармакокинетическим и фармакодинамическим параметрам, продемонстрированным при лечении детей и подростков с СД 1, инсулин глулизин является быстродействующим инсулиновым аналогом. В сравнении с человеческим инсулином регуляр аналог инсулина глулизин при его назначении детям и подросткам в качестве болюса непосредственно перед приемом пищи более эффективен в качестве болюсной инсулинотерапии для улучшения гликемического контроля [18].
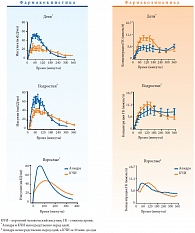
Общим результатом обоих германских исследований [18] явилось доказательство того, что инсулин глулизин (Апидра) имеет одинаковые профили фармакологической концентрации и действия у детей, подростков и взрослых (рис. 2) [17, 18]. По сравнению с широко применяемыми в педиатрической практике инсулиновыми аналогами лизпро и аспарт, инсулин глулизин по своему действию является более плоским. Кроме того, фармакокинетические особенности глулизина позволяют улучшить гликемический контроль при применении этого препарата у пациентов с длительно сохраняющейся постпрандиальной гликемией. Поскольку глулизин действует короче, чем регуляр, ниже риск развития гипогликемических состояний. Это помогает избежать дополнительных подколов, снизить инвазивность лечения (в некоторых случаях даже при наличии перекуса на одну хлебную единицу), что очень важно в педиатрической практике. Дело в том, что в детском и подростковом возрасте немало пациентов с длительной постпрандиальной гликемией. В этой связи фармакологические свойства глулизина делают этот препарат весьма востребованным у детей и подростков, страдающих СД 1.
После публикации работ исследователей из Профильного института метаболических исследований (Нойс, Германия) и Центра диабета для детей и подростков при Детской больнице района Бульт (Ганновер, Германия) [17, 18] было проведено 26-недельное, многоцентровое, открытое, рандомизированное, контролируемое исследование в параллельных группах «Эффективность и безопасность инсулина глулизин по сравнению с лизпро в качестве болюсного инсулина у детей и подростков, страдающих СД 1». В исследовании, предпринятом для доказательства гипотезы «не хуже», приняли участие 572 ребенка с СД 1 в возрасте от 4 до 17 лет (уровень HbA1c от 6 до 11%), наблюдаемые в 65 центрах по всему миру, в том числе в России [20, 21].
Отделение эндокринологии Морозовской детской городской клинической больницы (МДГКБ) Департамента здравоохранения Москвы также участвовало в этом исследовании. Среди других клинических детских центров России, включенных в проект, нами наблюдалась самая большая группа пациентов – 26 человек (14 мальчиков и 12 девочек): 7 детей с 6 до 12 лет и 19 подростков в возрасте от 13 до 16 лет. Целевые значения уровня НbА1с для данного исследования были выбраны по критериям Американской диабетической ассоциации – ADA [22]: для 4–6 лет – от 7,5 до 8,5%, для 6–12 лет – менее 8%, для 13–17 лет – менее 7,5%. В качестве базального инсулина пациенты получали инсулин гларгин один раз в день или инсулин НПХ два раза в день.
Инсулин гларгин (Лантус) – это базальный аналог инсулина, созданный генно-инженерным методом. Модификация структуры естественного человеческого инсулина привела к появлению аналога этого гормона, метаболический эффект которого начинается примерно через 1 час после инъекции и продолжается 24 часа. При этом в крови в течение суток поддерживаются постоянные уровни гормона при отсутствии пиков концентрации. Интраиндивидуальная вариабельность концентраций инсулина гларгин ниже, чем HПХ, и сопоставима с вариабельностью уровней инсулина при непрерывном его введении с помощью инсулиновой помпы [11]. Эти свойства позволяют вводить базальный аналог инсулина гларгин (Лантус) один раз в сутки по сравнению с 2–3-кратным введением HПХ-инсулина при традиционной интенсифицированной схеме инсулинотерапии, снижая инвазивность лечения СД 1 [19].
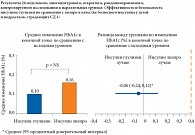
В ходе исследования было доказано, что среднее изменение уровня HbА1с в конечной точке по сравнению с исходным значением в двух группах лечения было сопоставимо. Скорректированное среднее изменение показателя HbА1с в группе инсулина глулизин и в группе инсулина лизпро составляло + 0,10% и + 0,16% соответственно. Разница между группами по изменениям HbА1с в конечной точке по сравнению с исходным уровнем составила 0,06% в пользу инсулина глулизин. Это значение находилось в пределах заранее установленной границы для «не хуже» – 0,4% (рис. 3). При оценке всех возрастных групп вместе оказалось, что достоверно больше пациентов группы инсулина глулизин достигло целевого уровня HbА1с, определенного для данного возраста, чем в группе инсулина лизпро (p = 0,0386). Эта разница была наиболее выраженной у подростков (13–17 лет), среди которых целевого уровня HbA1c < 7,5% достигло на 10% больше пациентов группы инсулина глулизин, чем в группе инсулина лизпро (p = 0,0251) (рис. 4).
Между месяцем 4 и конечной точкой частота всех симптоматических гипогликемий в двух группах лечения была одинаковой и составляла 3,1 против 2,91 (все) и 0,06 против 0,07 (симптоматические) эпизодов/пациент в месяц для инсулина глулизин и инсулина лизпро соответственно. Результаты исследования впервые были представлены на конгрессе ISPAD в 2008 г. в виде постера и опубликованы в этом же году международным коллективом авторов [21]. По данным нашего наблюдения, как и по приведенным выше материалам зарубежных публикаций, можно сделать следующие выводы.
- Инсулиновый аналог ультракороткого действия глулизин (Апидра) эффективен и безопасен для болюсной инсулинотерапии у детей и подростков при сахарном диабете.
- Применение инсулина глулизин (Апидра) как до, так и после приема пищи способствует снижению уровня постпрандиальной гипергликемии и достижению целевых показателей компенсации сахарного диабета.
- Применение инсулина глулизин (Апидра) позволяет достоверно снизить уровень НbА1с у детей и подростков без увеличения потребности в болюсном инсулине, а также в общей дозе всего инсулина, вводимого за сутки.
- Длительное применение инсулина глулизин (Апидра) позволяет при достоверном улучшении компенсации сахарного диабета снизить суточную дозу инсулина.
- Особенности гипогликемического действия инсулина глулизин (Апидра) позволяют рекомендовать его в первую очередь пациентам с длительно сохраняющейся постпрандиальной гипергликемией.
Применение инсулина Апидра получило одобрение FDA (США) 24 октября 2008 г. (от 4 лет и старше), а в России – 22 июля 2009 г. (от 6 лет и старше).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.