Несмотря на различную этиологию возникновения эпилепсии и отдельных эпилептических синдромов, в 70–80% случаев удается достичь полного контроля над эпилептическими пароксизмами с помощью лечения антиконвульсантами. В 20–30% случаев судорожные состояния и эпилептические синдромы резистентны к проводимой противосудорожной терапии. Особенностью этих форм эпилепсии является прогрессирующее течение, приводящее в кратчайшие сроки к глубокой инвалидизации пациентов [1, 2]. Учитывая довольно высокую распространенность эпилепсии в общей популяции, количество пациентов с устойчивыми к противосудорожной терапии формами заболевания представляется значительным. У таких пациентов допускается комплексная терапия с применением двух, трех препаратов, однако политерапия у них также часто оказывается неэффективной. Таким образом, одним из актуальных вопросов современной эпилептологии является разработка эффективных методов лечения резистентных к антиконвульсантам форм эпилепсии и эпилептических синдромов.
В настоящее время ведется интенсивный поиск новых высокоэффективных противосудорожных препаратов, проводятся исследования по подбору оптимальных комбинаций известных антиконвульсантов, разработке хирургических методов коррекции, а также оценке эффективности неантиконвульсантных методов лечения при резистентных формах эпилепсии [3].
К альтернативным методам лечения фармакорезистентных форм эпилепсии относятся:
- гормональная терапия (синтетический аналог адренокортикотропного гормона (АКТГ), преднизолон);
- кетогенная диета;
- терапия высокими дозами препаратов иммуноглобулина для внутривенного использования.
В последние годы в клиническую практику стало активно внедряться применение высоких доз иммуноглобулина для внутривенного использования. Первые упоминания о неспецифической иммунокоррекции относятся к 1666 г. и принадлежат R. Lower, который данный процесс характеризовал как «...исправление плохой крови заимствованием из хорошего тела». Первый рациональный подход к специфической иммунокоррекции относится к 1888–1889 гг., когда C. Richet и J. Hericourt, а годом позже E. von Behring и S. Kitasato установили, что кровь перенесших столбняк кроликов, перелитая здоровым животным, обладает свойствами, которые позволяют предохранить последних от заболевания [4]. В 1938 г. A. Tiselius и E. Kabat показали, что «антитела», определяющие специфические иммунозащитные свойства сыворотки, относятся к фракции гамма-глобулинов. Это открытие позволило создать в 1949 г. иммуноглобулин для внутримышечного использования. А в начале 1980-х гг. был создан интактный немодифицированный иммуноглобулин для внутривенного использования.
Препараты иммуноглобулина для внутривенного использования представляют собой пулированный, вирусинактивированный, нормальный поливалентный иммуноглобулин человека. Его основу составляет иммуноглобулин типа G (IgG) – 90–96%, присутствуют также следовые количества иммуноглобулинов типа M (IgM) и типа A (IgA), обладающие широким спектром опсонизирующих и нейтрализующих антител. Кроме того, препараты содержат различные структуры и детерминанты рецепторов, суперантигены, цитокины, антигены главного комплекса гистосовместимости.
Иммуноглобулин для внутримышечного, а затем и для внутривенного использования был создан для замещения дефектов естественного иммунитета при различных иммунодефицитных состояниях как первичного, так и вторичного характера.
P. Imbach и соавт. (1981) отметили положительный эффект применения иммуноглобулина для внутривенного использования при аутоиммунных заболеваниях, в частности, при идиопатической тромбоцитопенической пурпуре [5]. Результаты данного наблюдения открыли новое направление в области применения иммуноглобулина, получившее название иммуномодулирующей терапии. Поскольку данный эффект достигается только при применении существенно бóльших (в среднем 400 мг/кг), чем при заместительной терапии (50 мг/кг), доз препарата, такое лечение получило название терапии высокими дозами иммуноглобулина. Таким образом, в настоящее время существуют два современных направления клинического использования препаратов иммуноглобулина – заместительная и иммуномодулирующая терапия.
Препараты иммуноглобулина для внутривенного использования производятся из донорской плазмы, имеют период полувыведения 21–24 дня. В связи с этим современная технология производства данных лекарственных средств включает многоэтапную вирусинактивацию (пастеризацию, применение сольвентдетергентного метода, инкубацию при рН = 4), соответствующую требованиям, принятым в 1986 г. Всемирной организацией здравоохранения (ВОЗ) и в 1995 г. Институтом Пауля Эрлиха (Paul Ehrlich Institut). Как все препараты плазмы крови, иммуноглобулины для внутривенного использования имеют строгий режим введения. Лекарственное средство должно вводиться медленно, с начальной скоростью 0,75–1,0 мл/мин в течение первых 15 минут (15 капель в минуту), затем – 1,2–1,5 мл/мин в последующие 15 минут (25 капель в минуту). Оставшееся количество может вводиться со скоростью 2,5 мл/мин (45 капель в минуту). Если за время инъекции не отмечено возникновения нежелательных реакций, то последующие введения могут производиться со скоростью 3 мл/мин (54 капли в минуту). Нарушение данного протокола может привести к развитию побочных реакций.
В среднем по данной группе препаратов частота побочных реакций колеблется в пределах 5–15%. Более 90% побочных реакций являются посттрансфузионными осложнениями, что связано, как правило, с превышением скорости введения. Наиболее часто после введения препарата иммуноглобулина для внутривенного использования отмечаются повышение температуры (4%), озноб (3%), тошнота (1,5%), головная боль (1,5%). Другие реакции в виде головокружения, слабости, сонливости, болей в спине, повышенного слюноотделения, икоты, учащения пульса отмечаются с частотой менее 0,7%. В литературе существуют описания возникновения асептического менингита; острой почечной недостаточности, связанной с повышением осмолярности вводимых препаратов. Единственным противопоказанием для введения препаратов иммуноглобулина для внутривенного использования является повышение титра специфических антител к IgA.
Впервые позитивный эффект применения иммунотерапии при резистентных формах эпилепсии был отмечен во Франции в 1977 г. J.C. Péchadre и соавт. при проведении профилактики сезонных аллергозов препаратами иммуноглобулина для внутримышечного использования [6]. В результате у больных с резистентными эпилептическими приступами на фоне терапии отмечалось снижение частоты и тяжести судорожных приступов. У 7 из 10 больных выявлено улучшение электроэнцефалографической картины. С момента первых исследований выполнена серия работ, в ходе которых установлено положительное влияние иммунотерапии высокими дозами иммуноглобулина для внутривенного использования на течение эпилепсии [7, 8, 9, 10, 11]. Однако эффективность данного вида терапии оценивалась без учета формы эпилепсии, типа эпилептических пароксизмов.
В литературе обсуждается вопрос о длительности клинической ремиссии, возникающей после применения препаратов иммуноглобулина, и ее возможной взаимосвязи с этапами развития заболевания [8, 11]. Результаты представлены на небольшом количестве наблюдений и носят противоречивый характер.
В настоящее время не существует четких схем и рекомендуемых доз препаратов иммуноглобулина как для терапии эпилепсии, так и других аутоиммунных заболеваний. В проведенных исследованиях использовались, как правило, эмпирические дозы от 400 до 2000 мг/кг веса тела на курс при разовой дозе от 100 до 1000 мг/кг за 1–5 инъекций. Частота проведения повторных инъекций была различной.
В настоящее время все еще недостаточно ясен механизм действия иммуноглобулина при различных формах патологии, в том числе и при эпилепсии. По-видимому, имеет место сочетание нескольких механизмов. Основу иммуномодуляторного эффекта иммуноглобулина, по всей видимости, определяет спектр различных фрагментов структур, представленных в препарате.
Предполагаемыми механизмами действия иммуноглобулинов для внутривенного использования при аутоиммунных и воспалительных заболеваниях являются [12]:
- Блокада Fc-рецепторов.
- Противовоспалительный эффект за счет:
- снижения активности комплемент-опосредованных нарушений тканей;
- индукции противовоспалительных цитокинов;
- нейтрализации микробных токсинов.
- Нейтрализация патологических аутоантител к антиидиотипам.
- Нейтрализация суперантигенов.
- Выбор иммунного «репертуара»:
- контроль независимых структур: костный мозг, тимус;
- модуляция моноцитов и продукции цитокинов Т-клетками;
- модуляция распространенности и активации подклассов лимфоцитов;
- селективное снижение или повышение активности клонов В-клеток.
Иммунорегуляторное действие препарата у пациентов с различными формами эпилепсии и эпилептическими синдромами объясняется несколькими гипотезами:
- заместительная терапия при дефиците иммуноглобулинов у больных с генетически детерминированными формами эпилепсии;
- коррекция дисфункций изменений В-системы иммунитета;
- коррекция наследственных недиагностированных иммунологических нарушений у пациентов с резистентными формами эпилепсии;
- воздействие на механизм высвобождения медиаторов, нейрорегуляторов и других веществ центральной нервной и иммунной систем организма.
При сравнительном анализе различных методов альтернативной терапии резистентных форм эпилепсии отмечается, что иммунотерапия удобна для использования, поскольку включает только внутривенные инъекции. Благодаря довольно длительному периоду полувыведения IgG (21–24 дня), при применении препаратов иммуноглобулина для внутривенного использования можно достичь более стойкого эффекта, чем при применении кетогенной диеты и гормональной терапии. Препараты иммуноглобулина для внутривенного использования хорошо переносятся, имеют меньшее, по сравнению со стероидами, количество побочных эффектов при применении. Данные препараты могут быть использованы в терапии эпилепсии при наличии у пациентов острых или хронических инфекций, сахарного диабета, заболеваний сердечно-сосудистой системы. Недостатком иммунотерапии является высокая стоимость курса лечения, поскольку иммуноглобулины для внутривенного использования являются дорогостоящими плазматическими препаратами.
Таким образом, представленные данные свидетельствуют о необходимости дальнейшего и более глубокого изучения вопросов взаимосвязи эпилепсии с функциональным состоянием иммунной системы. Важным аспектом проблемы является определение показаний для назначения иммунотерапии больным разными формами эпилепсии, а также разработка оптимальных схем и доз препаратов иммуноглобулина для внутривенного использования.
Материалы и методы исследования
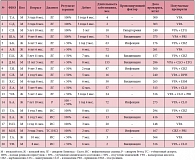
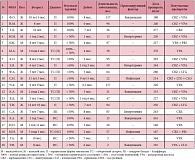
Основной целью исследования являлась комплексная оценка эффективности и переносимости препаратов иммуноглобулина для внутривенного использования в терапии фармакорезистентных форм эпилепсии. Иммунотерапия была проведена 35 пациентам в возрасте от 8 месяцев до 14 лет 10 месяцев с резистентными к антиконвульсантным препаратам формами эпилепсии. Среди обследованных больных 20 детей страдали генерализованными формами эпилепсии (у 13 пациентов был синдром Леннокса – Гасто, у 6 – инфантильные спазмы, у 1 – генерализованные судороги при синдроме Ретта). Характеристика группы больных с генерализованными формами эпилепсии, получавших иммунотерапию, представлена в таблице 1. В исследование также было включено 14 детей с парциальными формами эпилепсии (из них у 5 отмечались парциальные судороги при туберозном склерозе) и 1 ребенок с приобретенной эпилептической афазией – синдромом Ландау – Клеффнера. Характеристика группы больных с парциальными формами эпилепсии, получавших иммунотерапию, представлена в таблице 2.
Иммуноглобулин для внутривенного использования вводился в виде 5%-ного раствора, внутривенно, капельно, на 1, 15, 36-й день терапии в дозе от 157 мг/кг до 416 мг/кг (на одно введение). При проведении исследования использовались препараты иммуноглобулина, выпускаемые различными фирмами, в том числе Интратект («Биотест фарма ГмбХ», Германия). В 1 мл препарата содержится 50 мг белков плазмы человека, из них IgG не менее 96% (подкласс IgG1 – 57%, подкласс IgG2 – 37%, подкласс IgG3 – 3%, подкласс IgG4– 3%). Отметим, что при производстве Интратекта применяется инновационная технология – двустадийная катиообменная хроматография, позволяющая получать высокоочищенный препарат иммуноглобулина IgG.
Препараты вводились в соответствии с рекомендуемым протоколом введения иммуноглобулинов для внутривенного использования. Эффективность оценивалась на основании дневника приступов, заполняемого родителями ежедневно в течение всего периода наблюдения. Курс иммунотерапии проводился в стационарных условиях на фоне постоянного приема различных комбинаций противосудорожных препаратов в различных терапевтических дозировках, включавших препараты вальпроевой кислоты (VPA) (Депакин, Орфирил, Конвулекс); карбамазепина (CBZ) (Финлепсин, Тимонил, Тегретол); ламотриджина (LTG) (Ламиктал); клоназепама (CLO); примидона (PRI) (Гексамидин, Мисолин); этосуксимида (ESM) (Суксилеп).
Результаты иммунотерапии пациентов с генерализованными и парциальными резистентными формами эпилепсии
Клиническая оценка эффективности терапии препаратами иммуноглобулина для внутривенного использования у детей, страдающих резистентными формами эпилепсии, проводилась спустя 2 (n = 35) и 12 (n = 24) месяцев после последнего (3-го) введения препарата.
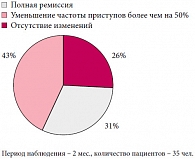
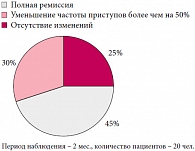
При анализе результатов иммунотерапии резистентных форм эпилепсии спустя 2 месяца после последней инъекции (рис. 1) у 11 пациентов отмечалось исчезновение приступов, у 15 детей – улучшение клинического состояния в виде снижения частоты судорожных пароксизмов более чем на 50%, и у 9 пациентов изменений не отмечено.
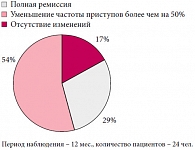
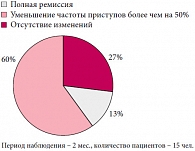
При оценке эффективности иммунотерапии через 12 месяцев после последней инъекции (рис. 2) показано, что из 24 больных полная ремиссия эпилептических приступов отмечалась у 7 детей, снижение частоты пароксизмов более чем на 50% – у 13 детей, и у 4 пациентов судороги отмечались в исходном (до иммунотерапии) объеме.
Вопрос о длительности клинического эффекта после применения препаратов иммуноглобулина и возможной взаимосвязи с этапами развития заболевания в настоящий момент обсуждается [11, 13, 14, 15]. В нашем исследовании при проведении катамнестического наблюдения за клиническим состоянием 24 пациентов в течение 12 месяцев было выявлено, что только у трети детей отмечалось стабильное воздействие иммунотерапии на течение эпилептического процесса.
После проведения курса терапии препаратами иммуноглобулина для внутривенного использования у всех детей, страдающих тяжелыми формами эпилепсии, наблюдалась положительная динамика психоэмоционального развития, выражавшаяся в повышении внимания, улучшении познавательных функций, правильности выполнения инструкций, усложнении используемых ребенком игр, снижении исходно повышенной возбудимости на внешние раздражители.
При динамическом электроэнцефалографическом исследовании до и после курса иммунотерапии отмечалась положительная динамика в виде улучшения общей биоэлектрической активности головного мозга, снижения эпилептической активности головного мозга, комплексов «пик – волна» с частотой 2–2,5 Гц по различным отведениям.
Переносимость препаратов иммуноглобулина для внутривенного использования была удовлетворительной. Побочные эффекты отмечались у 9 больных: гипертермия и озноб – у 7 детей, кожные реакции – у 2 пациентов. Важно, что данные реакции, по-видимому, носили характер посттрансфузионных осложнений, были непродолжительными (от 20 минут до 6 часов) и не сопровождались отклонениями биохимических параметров. Серьезных побочных реакций при проведении иммунотерапии отмечено не было.
Все пациенты, включенные в исследование по оценке эффективности иммунотерапии резистентных форм эпилепсии, были разделены на две группы в зависимости от характера эпилептического пароксизма.
Результаты иммунотерапии пациентов с генерализованными формами эпилепсии
Курс терапии препаратами иммуноглобулина для внутривенного использования был проведен 20 пациентам с генерализованными эпилептическими пароксизмами. Отметим, что сразу после курса иммунотерапии улучшение клинического состояния в виде снижения частоты судорожных пароксизмов отмечалось у 75% пациентов (рис. 3).
Результаты оценки эффективности иммунотерапии спустя 2 месяца после последнего введения, представленные в таблице 3, демонстрируют клиническую ремиссию у 9 больных, снижение частоты приступов более чем на 50% – у 6 детей, отсутствие изменений в частоте приступов – у 5 пациентов.
При последующем наблюдении у 4 детей выявлялась положительная динамика в виде снижения частоты эпилептических пароксизмов, у 5 – отмечалось ухудшение клинического состояния, проявлявшееся в учащении приступов.
При анализе результатов катамнестического наблюдения 13 пациентов с генерализованными формами эпилепсии спустя год после курса терапии, полная ремиссия эпилептических пароксизмов отмечалась у 4 пациентов (31%), улучшение клинического состояния в виде снижения частоты приступов более чем на 50% – у 6 детей (46%), наличие пароксизмов в исходном объеме – у 3 (23%) больных (табл. 3).
С целью поиска факторов, определяющих эффективность иммунотерапии, более подробно были проанализированы группы детей, страдающих инфантильными спазмами (n = 6) и синдромом Леннокса – Гасто (n = 13). При оценке эффективности курса иммунотерапии у больных с синдромом Леннокса – Гасто спустя 2 месяца после последнего введения у 4 детей (30,8%) отмечалось отсутствие эпилептических пароксизмов, у 6 пациентов (46,1%) – снижение частоты приступов более чем на 50%, у 3 больных (23,1%) – отсутствие изменений в частоте приступов. Через 12 месяцев после курса иммунотерапии (n = 9) полный контроль приступов отмечался у 2 пациентов (22%), улучшение клинического состояния в виде снижения частоты эпилептических пароксизмов – у 5 детей (56%), отсутствие эффекта иммунотерапии наблюдалось у 2 (22%) больных. При сопоставлении клинико-анамнестических данных и эффективности терапии у пациентов, наблюдавшихся с синдромом Леннокса – Гасто, обнаружено, что наилучшие результаты лечения достигнуты у больных мужского пола при длительности заболевания менее 1 года при использовании дозы препаратов иммуноглобулина, превышающей 300 мг/кг (на одно введение).
У больных с инфантильными спазмами (n = 6) спустя 2 месяца после последнего введения полный контроль приступов достигнут в 4 случаях (67%), отсутствие эффекта отмечалось у 2 детей (33%). Клиническая ремиссия в течение 12 месяцев наблюдалась у 2 больных с инфантильными спазмами, у 1 ребенка отмечен рецидив приступов. Отметим, что клиническая ремиссия эпилептических приступов была достигнута у детей в возрасте старше 1 года.
Результаты иммунотерапии пациентов с парциальными формами эпилепсии
Курс терапии препаратами иммуноглобулина для внутривенного использования был проведен 15 пациентам с симптоматическими парциальными формами эпилепсии (рис. 4).
Данные рисунка 4 свидетельствуют, что при оценке эффективности иммунотерапии спустя 2 месяца после последнего введения было выявлено: клиническая ремиссия эпилептических приступов отмечалась у 2 больных; снижение частоты пароксизмов более чем на 50% – у 9 пациентов, у 4 пациентов приступы регистрировались с прежней частотой.
Как видно из таблицы 4, при анализе результатов катамнестического наблюдения 11 пациентов с парциальными формами эпилепсии спустя 12 месяцев после курса иммунотерапии полная ремиссия приступов отмечена у 3 пациентов (27%), улучшение клинического состояния в виде снижения частоты приступов более чем на 50% – у 7 детей (64%), отсутствие изменений – у 1 ребенка (9%). После курса терапии улучшение клинического состояния в виде снижения частоты эпилептических пароксизмов более чем на 50% отмечено только у 60% пациентов. У 2 детей стойкая ремиссия возникла спустя 2 месяца после последнего введения препарата.
При анализе результатов исследования было установлено, что ремиссия эпилептических приступов наблюдалась у детей, для которых была характерна трансформация эпилептических приступов, согласно истории заболевания, из генерализованных в парциальные пароксизмы.
Обсуждение результатов исследования
Целью этой работы являлась разработка новых методов лечения, включающих антиконвульсантную и иммунотерапию у детей с резистентными формами эпилепсии. Изменение антигенных свойств нормальных клеток мозга возможно вследствие действия микробных токсинов, вирусов, лекарственных препаратов, термического воздействия, что может приводить к «срыву» аутотолерантности тканей головного мозга и «запуску» иммунных механизмов. Поскольку антигенные структуры головного мозга иммунологически обособлены, именно нарушения гематоэнцефалического барьера при эпилептическом приступе способствуют вовлечению структур головного мозга в иммунологические реакции, воспринимая их как чужеродные. Во время первого судорожного пароксизма в мозге возникают или впервые проявляются процессы, являющиеся пусковым моментом эпилептогенеза. Таким образом, при хроническом эпилептическом процессе, по-видимому, могут возникать аутоиммунные нарушения с вовлечением различных структур головного мозга.
До сих пор не существует единого представления о том, является ли эпилепсия либо отдельные эпилептические синдромы атопическими, аутоиммунными заболеваниями, иммунокомплексной патологией или в их развитии возможно участие нескольких механизмов, опосредованно влияющих через иммунные реакции на клетки мозга с формированием хронического эпилептического процесса.
Результаты применения препаратов иммуноглобулина для внутривенного использования у 35 детей, страдающих резистентными к терапии антиконвульсантами формами эпилепсии, демонстрируют эффективность данного вида лечения в 74% случаев. Спустя 2 месяца после курса терапии в 31% случаев отмечалась ремиссия эпилептических приступов, у 42,8% детей – улучшение клинического состояния в виде снижения частоты эпилептических пароксизмов более чем на 50%. При наблюдении в течение 12 месяцев установлено, что в 81% случаев иммунотерапия оказывает стойкий положительный эффект на течение заболевания.
Результаты иммунотерапии демонстрируют бóльшую эффективность лечения у пациентов с генерализованными, чем с парциальными, формами эпилепсии. Таким образом, иммунотерапия была эффективной у пациентов с хроническими эпилептическими синдромами, протекающими по типу диффузных энцефалопатий (инфантильные спазмы, синдром Леннокса – Гасто). Отметим, что терапия препаратами иммуноглобулина для внутривенного использования была более эффективной у пациентов с «полиантигенной» сенсибилизацией организма к структурам головного мозга. Более высокую клиническую эффективность иммунотерапии при генерализованных формах эпилепсии, по всей видимости, можно объяснить тем, что препараты иммуноглобулина содержат поливалентные антитела.
Отсутствие эффекта при парциальных формах эпилепсии, предположительно, определяется повышенным содержанием моноспецифических антимозговых аутоантител. Кроме того, у таких больных может сохраняться больше клеток иммунологической памяти на антигенные детерминанты мозговых структур одной области, учитывая локальный характер повреждения. Вероятно, что именно этим обусловлен бóльший процент рецидивов приступов у пациентов с парциальными формами эпилепсии, чем у пациентов с генерализованными пароксизмами.
Механизм действия препаратов иммуноглобулина для внутривенного использования у пациентов, страдающих различными формами эпилепсии, не ясен и требует дальнейшего изучения. По-видимому, эффект достигается за счет изменения межклеточных взаимодействий (идиотип – антиидиотип), снижения продукции аутоантител, изменений высвобождения различных цитокинов, регулирования активности Т-клеток за счет Fc-рецепторной блокады, основанной на способности молекул IgG пересекать гематоэнцефалический барьер.
Таким образом, терапия препаратами иммуноглобулина для внутривенного использования нормализует иммунные возможности организма детей, страдающих различными формами эпилепсии. Практически у всех пациентов после курса иммунотерапии отмечалось улучшение познавательных функций и электроэнцефалографической картины, что в целом свидетельствовало об улучшении качества жизни больных.