Особенности клинических проявлений и лечения увеита при анкилозирующем спондилите
- Аннотация
- Статья
- Ссылки
- English
Введение
Спондилоартриты (СпА) – большая группа воспалительных заболеваний суставов и позвоночника, объединенных общими патогенетическими, иммуногенетическими и клиническими признаками. Прототипом этой группы болезней является анкилозирующий спондилит (АС).
Помимо поражения позвоночника и суставов, АС характеризуется широким спектром внесуставных проявлений, из которых наиболее часто встречается увеит. Увеитом называется воспаление структур увеального тракта глаза, в который входят радужная оболочка, цилиарное тело и собственно сосудистая оболочка, или хориоидея. В зависимости от преимущественной локализации воспалительного процесса увеит классифицируется как передний (ирит, иридоциклит, циклит, кератоувеит), периферический, или интермедиарный (парспланит), задний (хориоретинит, эндофтальмит) и панувеит (панофтальмит) [1–3].
Клинические проявления увеита
Воспалительный процесс при увеите характеризуется клеточной инфильтрацией вследствие повышения проницаемости сосудистой стенки, что можно наблюдать при офтальмоскопии в различных отделах глаза: в передней камере, стекловидном теле, сетчатке. Активность увеита оценивается по количеству воспалительных клеток в передней камере глаза и выраженности воспалительных изменений в структурах глаза. Учитывается также степень помутнения стекловидного тела. Изменение этих параметров позволяет судить как о наличии обострения или ремиссии, так и об эффективности проводимой терапии [2].
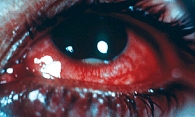
По данным разных авторов, частота развития увеита при АС составляет от 20 до 40% [4, 5]. Воспаление первично поражает передние структуры глаза: радужную оболочку и ресничное тело, затем в процесс включается также стекловидное тело. Клинически увеит проявляется болью в глазу, фотофобией, слезотечением, затуманиванием зрения. Частый симптом острого переднего увеита (ОПУ) – инъекция конъюнктивы, чаще перикорнеальная (застой в сосудах в области корнеосклерального соединения) (рис. 1). При биомикроскопии выявляется также опалесценция влаги передней камеры глаза вследствие наличия в ней воспалительных клеток. Склеенные фибрином клеточные элементы могут оседать на задней поверхности роговицы, образуя преципитаты.
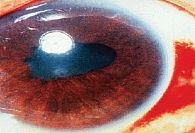
Из-за наличия воспалительного экссудата в передней камере глаза возникают задние синехии (склеивание зрачкового края радужной оболочки с передней капсулой хрусталика) и передние (сращение в области корня радужной оболочки, рис. 2). Высокая активность воспаления сопровождается помутнением влаги передней камеры за счет множества воспалительных клеток и образования гипопиона (осадка на дне с горизонтальным уровнем).
Для увеита при АС характерно не одновременное поражение обоих глаз, а поочередное воспаление то правого, то левого глаза. В связи с этим увеит при АС, как правило, односторонний. Он начинается остро, длится обычно меньше трех месяцев, но имеет склонность к рецидивированию. Наши собственные наблюдения позволяют говорить о том, что у части больных АС рецидивирующий увеит – доминирующее клиническое проявление АС, определяющее тяжесть состояния. Эти пациенты подвержены частым обострениям увеита – до 5–6 в течение года, которые могут иметь затяжной характер и плохо поддаваться локальной противовоспалительной терапии. В результате частых продолжительных атак увеита могут развиваться такие осложнения, как катаракта, глаукома, фиброзные изменения в стекловидном теле. Интенсивное воспаление в переднем сегменте глаза нередко сопровождается образованием передних и задних синехий, затрудняющих отток глазной жидкости.
Наблюдение за 140 пациентами с АС, у которых имелось хотя бы одно обострение увеита в анамнезе, показало, что в большинстве случаев (у 58% больных) увеит развился в первые 10 лет после манифестации АС. Осложнения увеита, приведшие к нарушению зрительных функций, отмечены у 29% больных: синехии – у 26 (18%), деструкция стекловидного тела – у 20 (14%), катаракта – у 32 (23%), глаукома – у 13 (9%), макулопатия – у 6 (4%), лентовидная дегенерация роговицы – у 6 (4%), частичная атрофия зрительного нерва – у 3 (2%) [6].
При затяжном течении или неадекватном лечении воспаление может распространиться на задние отделы глаза с развитием витрита, ретинального васкулита, кистовидного макулярного отека и других угрожающих зрению состояний.
Патогенез увеита
Увеит может развиться задолго до первого проявления спондилита или дебютировать на фоне малосимптомного спондилита, поэтому в настоящее время, в соответствии с классификационными критериями ASAS (SpondyloArthritis international Society – Международное общество по изучению спондилоартрита), его учитывают при ранней диагностике АС [7].
Увеит достоверно чаще наблюдается у больных, имеющих другие системные проявления, в частности, изменения со стороны сердечно-сосудистой системы в виде поражения аорты и клапанов, а также нарушения ритма и проводимости [8]. При обследовании 344 пациентов с АС, наблюдавшихся в НИИ ревматологии РАМН, нарушения проводимости (атриовентрикулярная и внутрижелудочковая блокада) отмечены у 24,3% больных с увеитом и у 10,6% лиц без увеита (р = 0,006). Кроме того, увеит достоверно чаще диагностировался у больных, имеющих разные нарушения проводимости, по сравнению с лицами без нарушения проводимости (14 (31,8%) из 44 и 50 (16,7%) из 300 пациентов соответственно; р = 0,01). Подобная закономерность выявлена также в отношении структурных изменений сердца, свойственных АС. Например, утолщение стенки аорты и клапанов сердца, субаортальное гребневидное утолщение достоверно чаще регистрировались при эхокардиографии у больных с увеитом в анамнезе, чем у пациентов без увеита (у 16 (59,3%) из 27 и 28 (37,8%) из 74 человек соответственно; р = 0,04). И наоборот, увеит достоверно чаще отмечался у пациентов с изменениями аорты и клапанов сердца по сравнению с больными без структурных изменений сердца (у 21 (46,7%) из 45 и 6 (16,7%) из 56 человек соответственно; р = 0,0001). Таким образом, наличие увеита может свидетельствовать о возрастании риска развития других системных проявлений у больных АС.
Большой интерес представляет изучение патогенетической роли антигена гистосовместимости HLA-В27 в развитии различных проявлений АС, в том числе поражения глаз. Связь между HLA-В27 и ОПУ впервые установили D. Brewerton и соавт. в 1973 г. [9]. С одной стороны, большинство пациентов с АС, имеющие хотя бы одну атаку увеита в течение болезни, являются носителями антигена гистосовместимости HLA-В27. С другой стороны, почти 30–50% больных с ОПУ HLA-В27-позитивны, а около 50% больных из этой группы имеют признаки АС [10].
Популяционные генетические исследования среди европейцев показали, что HLA-В27 обусловливает только 16% генетического риска заболевания, в то время как в целом для генов главного комплекса гистосовместимости (major histocompatibility complex, MHC) эта цифра составляет 50%, что указывает на существование дополнительных генов в MHC-регионе, предрасполагающих к развитию заболевания [11, 12]. В ряде исследований продемонстрировано, что в патологический процесс, приводящий к развитию ОПУ, может быть вовлечен MICA – ген главного комплекса гистосовместимости, расположенный на коротком плече 6-й хромосомы рядом с локусом В и отличающийся высоким полиморфизмом. Этот ген с высокой частотой выявляется как у HLA-В27-позитивных, так и у HLA-В27-негативных пациентов с ОПУ, а также у пациентов с язвенным колитом и псориазом [13, 14].
В развитие увеита при АС могут быть вовлечены не только гены главного комплекса гистосовместимости. В частности, с этим заболеванием может быть ассоциирован генетический регион, который находится на 16-й хромосоме [15]. Здесь расположен ген NOD-2, обнаруженный у пациентов с болезнью Крона, АС, псориазом и другими воспалительными заболеваниями, протекающими с поражением глаз. Ранее этот ген идентифицировали как ответственный за развитие семейного ювенильного системного гранулематоза (синдрома Блау (Blau) – редкого заболевания с аутосомно-доминантным типом наследования, одним из основных проявлений которого служит увеит). Поскольку АС, болезнь Крона и реактивный артрит имеют много общих симптомов и могут встречаться у членов одной семьи, можно предположить, что ген NOD-2 подвергается мутации у пациентов с серонегативными спондилоартритами с системными проявлениями и может быть вовлечен в развитие увеита.
Имеются сведения и о других генетических маркерах ОПУ, в частности исследователями в Японии была установлена ассоциация между ОПУ и HLA-DRB1*08, однако в других исследованиях она не подтвердилась [5]. Не так давно получены данные о роли полиморфизма гена-промотора фактора некроза опухоли (ФНО) альфа в развитии В27-ассоциированного увеита. Показано, что HLA-В27-позитивые пациенты имеют повышенный риск развития увеита при наличии А-аллели гена-промотора ФНО-альфа в позиции 238 и меньший риск при наличии данной аллели в позиции 308 [16]. Исследование полиморфизма гена рецептора ФНО-альфа (tumor necrosis factor receptor superfamily – надсемейство рецепторов факторов некроза опухоли, TNFRSF) продемонстрировало, что у пациентов с HLA-В27-ассоциированным ОПУ повышен риск развития осложнений при наличии аллелей TNFRSF1A-201T и TNFRSF1A-1135T [17].
Интересна роль KIR-комплекса (killer cell immunoglobulin-like receptors – иммуноглобулиноподобные рецепторы клеток-киллеров) в патогенезе увеита при АС. Эти рецепторы экспрессируются на клетках-киллерах и некоторых Т-клетках, включая активированные Т-клетки CD8+, которые взаимодействуют с молекулами HLA I класса, в том числе с HLA-В27. Оказалось, что такое взаимодействие играет роль в развитии многих воспалительных процессов, в том числе увеита у HLA-В27-позитивных больных АС. HLA-В27 реализует риск воспалительного заболевания отчасти путем взаимодействия с некоторыми KIR. Комплекс KIR – HLA-В27 инициирует ранний NK- или CD8+-клеточный ответ, нивелирующий антигенный стимул. У HLA-В27-позитивных пациентов с АС и увеитом выявлена тенденция к уменьшению числа KIR 3DS1, 2DS1 и 2DS5 [18]. HLA-B27 в отсутствие этих рецепторов не способен активировать ранний NK- или CD8+T-клеточный ответ, опосредованный KIR-комплексом и необходимый для уменьшения антигенной стимуляции, что способно привести к быстрому началу глазного воспаления, характерного для АС.
Современные методы лечения больных с увеитом при АС
Взаимосвязь между указанными генетическими факторами и роль каждого из них в развитии увеита заслуживают внимания и могут стать предметом дальнейших исследований.
Лечение увеита у больных АС должно проводиться при тесном сотрудничестве офтальмолога и ревматолога. Основной метод лечения ОПУ, типичного для АС, – местное применение глюкокортикостероидов (ГКС) в виде капель и инъекций в сочетании с циклоплегическими агентами. Во многих случаях при использовании этих препаратов в начале заболевания воспаление удается полностью купировать. При недостаточной эффективности капель производятся пара- или ретробульбарные инъекции ГКС, которые позволяют создать относительно высокую концентрацию препарата в патологическом очаге и избежать нежелательных системных явлений. При затяжном и рецидивирующем течении увеита в схему лечения добавляют противовоспалительные препараты системного действия: нестероидные противовоспалительные средства (НПВС) и базисные противовоспалительные препараты (БПВП).
НПВС являются препаратами первого ряда при лечении пациентов с АС и, кроме того, способствуют уменьшению воспалительной инфильтрации, отека и боли в глазу.
Среди БПВП в комплексном лечении увеита, ассоциированного с АС, чаще других применяется сульфасалазин. Данные ряда авторов и собственные наблюдения показывают, что длительный прием сульфасалазина достоверно уменьшает количество обострений увеита у пациентов с АС [19, 20].
Существуют немногочисленные свидетельства положительного эффекта метотрексата в предотвращении атак увеита [21, 22]. Однако в исследовании S. Gangaputra и соавт. принимали участие больные не только с ОПУ, но и с глазным воспалением другой этиологии, в том числе с задним, интермедиарным увеитом, панувеитом, склеритом. В связи с этим оценить эффективность метотрексата у больных АС с клиническим проявлением в виде увеита по данным этого исследования сложно. В исследовании S. Muñoz-Fernandez и соавт. проспективно изучена небольшая группа больных – 10 человек с рецидивирующим ОПУ, получавших метотрексат в течение года. Показано, что число атак увеита за год достоверно снизилось.
Еще один иммуносупрессивный препарат, успешно применяющийся при лечении увеитов, – циклоспорин А [23–27]. В большинстве случаев он использовался в комбинации с ГК или в виде монотерапии для лечения тяжелых форм заднего увеита и панувеита, рецидивирующего периферического неинфекционного увеита различной этиологии. В рамках АС такие формы увеита встречаются нечасто. Сравнительных исследований эффективности разных БПВП в лечении увеита при АС не проводилось, поэтому говорить о преимуществах циклоспорина А перед сульфасалазином или метотрексатом в данном случае сложно.
В настоящее время в терапии больных с увеитом с успехом применяются различные генно-инженерные биологические агенты, в первую очередь препараты, воздействующие на ФНО-альфа. Моноклональные антитела к ФНО-альфа (инфликсимаб, адалимумаб) высокоэффективны при лечении ряда ревматических заболеваний, ассоциированных с увеитом, в том числе АС, ювенильного хронического артрита, болезни Крона. Теоретическим обоснованием применения анти-ФНО-препаратов при лечении увеита послужили доказательства ключевой роли ФНО-альфа в развитии увеита, полученные в ряде исследований с использованием лабораторных животных, а также данные о повышении уровня ФНО-альфа в сыворотке крови и внутриглазной жидкости больных увеитом. Предположение о том, что блокирование активности ФНО-альфа может оказаться эффективным в терапии увеита, нашло подтверждение в клинической практике. В последние годы появляется все больше данных об анти-ФНО-терапии увеита у человека.
Имеются сведения о применении при разных формах увеита трех ингибиторов ФНО: инфликсимаба, адалимумаба, этанерцепта.
Родоначальником среди игибиторов ФНО-альфа является инфликсимаб (препарат Ремикейд). Он представляет собой химерное соединение на основе гибридных моноклональных антител к ФНО-альфа, состоящее на 75% из человеческого белка и на 25% – из мышиного. С антигеном (ФНО-альфа) связывается часть молекулы, состоящая из мышиного белка. Инфликсимаб с высокой специфичностью блокирует как циркулирующий, так и фиксированный на клеточных мембранах ФНО-альфа.
Впервые инфликсимаб применили для лечения увеита при болезни Бехчета, а в дальнейшем стали успешно использовать и для лечения больных АС с увеитом [28, 29].
Активная противовоспалительная терапия требуется пациентам с АС и частыми затяжными обострениями увеита. Ингибиторы ФНО-альфа продемонстрировали способность быстро купировать увеит и предотвращать повторные обострения. Для подавления атаки ОПУ оказалось достаточно назначения инфликсимаба в качестве единственного противовоспалительного средства [30]. Препарат назначали в дозе 10 мг на 1 кг массы тела восьми пациентам с HLA-В27-ассоциированным ОПУ. Критериями эффективности лечения служили количество воспалительных клеток и преципитатов в передней камере глаза, а также уровень С-реактивного белка в крови до и после лечения. После одной инфузии у всех пациентов отмечен быстрый регресс всех симптомов увеита, включая уменьшение количества клеток в передней камере глаза. В течение 17 месяцев увеит не рецидивировал.
Инфликсимаб оказался высокоэффективным при лечении не только переднего, но и заднего увеита, рефрактерного к обычному лечению ГКС и, по крайней мере, одним иммунодепрессантом [31]. Авторы подчеркивают особую эффективность инфликсимаба при заднем увеите с преобладающим ретинальным васкулитом и витритом.
Для лечения увеита активно применяется и другой ингибитор ФНО-альфа – адалимумаб, который представляет собой полностью человеческое антитело, полученное с использованием рекомбинантной ДНК-технологии. Адалимумаб специфически связывается с ФНО-альфа и блокирует его взаимодействие с р55 и р75 поверхностными клеточными рецепторами ФНО-альфа, тем самым нейтрализуя активность этого цитокина. Благодаря этим эффектам адалимумаб сокращает концентрацию матричных металлопротеиназ (ММП-1 и 3), молекул адгезии, ответственных за миграцию лейкоцитов (ELAM-1, VCAM-1, ICAM-1), уменьшает концентрацию острофазовых белков. При этом активность адалимумаба высокоспецифична и не ингибируется лимфотоксином, известным как ФНО-бета, – цитокином, продуцируемым лимфоцитами и поражающим разные клетки. ФНО-бета модулирует разные биологические ответы, являющиеся результатом стимуляции ФНО-альфа.
Показательны данные открытого исследования, проведенного M. Rudwaleit и соавт. с участием 1250 пациентов с активным АС, получавших лечение адалимумабом в дозе 40 мг один раз в 2 недели в течение 20 недель [32]. При этом сравнивалось количество атак увеита в пересчете на 100 пациенто-лет до начала терапии адалимумабом и на фоне терапии. Оказалось, что частота обострений увеита на фоне лечения адалимумабом снизилась на 51% у всех пациентов, на 58% – у больных с увеитом в анамнезе, на 68% – у лиц, перенесших увеит в течение последнего года, и на 50% – у пациентов, имевших активный увеит на момент начала лечения. Препарат продемонстрировал высокую эффективность как в отношении купирования, так и предотвращения обострений увеита у пациентов с АС.
Эффективность адалимумаба подтверждена и в других исследованиях, в частности, при лечении пациентов с рефрактерным аутоиммунным увеитом: 19 человек получали адалимумаб в дозе 40 мг один раз в две недели в течение 12 месяцев [33]. У всех пациентов отмечены уменьшение признаков глазного воспаления, улучшение зрительных функций по окончании лечения, а также полное рассасывание кистовидного макулярного отека глаз в 18 из 33 случаев. Отмечена хорошая переносимость адалимумаба.
Имеются данные об успешной замене инфликсимаба на адалимумаб при лечении увеита у пациентов с непереносимостью или недостаточной эффективностью инфликсимаба. K. Takase и соавт. наблюдали пациентов с болезнью Бехчета и увеитом, получавших лечение инфликсимабом и циклоспорином, с инфузионными реакциями на инфликсимаб [34]. При этом прекращение анти-ФНО-терапии приводило к обострению увеита. Назначение адалимумаба этим пациентам привело к быстрому купированию обострения увеита. У больных АС и увеитом с недостаточной эффективностью инфликсимаба также возможно улучшение течения увеита после смены анти-ФНО-препарата.
Следующий клинический пример демонстрирует успешную замену инфликсимаба на адалимумаб.
Клинический случай
Больной Г., 1956 г. р., наблюдается в НИИ ревматологии РАМН с 1997 г. с диагнозом: АС, HLА-В27-позитивный, поздняя стадия, двусторонний коксит, энтезопатии, внескелетные проявления (рецидивирующий передний увеит), активность высокая.
Из анамнеза известно, что воспалительная боль в позвоночнике появилась у мужчины с 30 лет. Диагноз АС поставлен через 7 лет после начала болезни, когда были выявлены двусторонний сакроилеит, ограничение подвижности всех отделов позвоночника. В 2004 и 2006 гг. отмечены эпизоды артрита правого коленного сустава. С 2008 г. регистрировались неоднократные затяжные атаки увеита левого глаза с кратковременным эффектом на фоне инъекций ГКС. С февраля 2010 г. больной постоянно принимал сульфасалазин 2 г/сут и НПВС, но признаки активного глазного воспаления сохранялись: отек радужки, клетки в стекловидном теле и передней камере глаза.
При обследовании в НИИ ревматологии РАМН в сентябре 2010 г. выявлены признаки АС поздней стадии: усиление грудного кифоза, сглаженность шейного и поясничного лордоза, отсутствие движений в шейном отделе позвоночника, ограничение экскурсии грудной клетки до 3 см, ограничение подвижности в поясничном отделе позвоночника (тест Шобера – 2 см, боковое сгибание – 8 см). Определялась высокая воспалительная активность по индексу BASDAI (Bath ankylosing spondylitis disease activity index – Индекс активности заболевания анкилозирующим спондилитом) (4,5 см) и по лабораторным тестам (скорость оседания эритроцитов (СОЭ) – 26 мм/ч, С-реактивный белок (СРБ) – 80 ед/мл).
На рентгенограммах таза выявлялись двусторонний сакроилеит IV стадии, сужение щелей тазобедренных суставов, эрозии симфиза и седалищных бугров. На рентгенограммах позвоночника отмечены остеопороз, множественные синдесмофиты в поясничном и грудном отделах позвоночника.
Окулистом выявлены периокулярный отек левого глаза (OS), серовато-белые преципитаты на роговице, опалесценция влаги передней камеры, субатрофия радужки, старые задние синехии, неравномерно расширенный зрачок, помутнение задней капсулы хрусталика, помутнение и деструкция стекловидного тела; офтальмоскопия глазного дна не проводилась. Правый глаз (ОD) – без признаков воспаления.
В связи с частыми стойкими атаками увеита, недостаточным эффектом терапии сульфасалазином и НПВС с сентября 2010 г. пациенту было начато лечение инфликсимабом (Ремикейд) в дозе 3 мг на 1 кг массы тела по стандартной схеме. После первой инфузии отмечено значительное улучшение состояния OS в виде уменьшения количества преципитатов и отека, а также уменьшение боли и увеличение подвижности позвоночника. Через 1 месяц после третьей инфузии развилось обострение увеита OS, потребовавшее стационарного лечения в офтальмологическом отделении. После четвертой инфузии инфликсимаба в течение двух месяцев отмечено 3 атаки увеита OS.
В связи с рецидивами увеита на фоне терапии инфликсимабом было принято решение о замене этого препарата на адалимумаб. С сентября 2011 г. начато лечение адалимумабом в дозе 40 мг подкожно 1 раз в 2 недели.
За полгода терапии адалимумабом обострений увеита не было, боль в позвоночнике значительно уменьшилась, индекс BASDAI – 2,9 см. Лабораторные показатели без отклонений от нормы. Пациент продолжает принимать сульфасалазин в дозе 2 г/сут и диклофенак при необходимости.
Сравнение эффективности ингибиторов ФНО
Таким образом, адалимумаб может с успехом использоваться для лечения рецидивирующего увеита у больных АС. Особенности структуры адалимумаба, состоящего только из человеческого белка, позволяют уменьшить риск нежелательных явлений, обусловленных выработкой антихимерных антител. К преимуществам адалимумаба можно отнести подкожный способ введения, что более удобно для пациентов и не требует посещения медицинского учреждения.
При АС в течение длительного времени с успехом применяется этанерцепт (препарат Энбрел), представляющий собой димерный комбинированный белок, состоящий из человеческого растворимого рецептора ФНО-альфа р75, соединенного с Fc-фрагментом человеческого иммуноглобулина G1. Однако ряд авторов подвергают сомнению его эффективность в предотвращении увеита у больных АС [35]. Более того, имеются сведения о том, что этанерцепт может провоцировать увеит у больных АС и другими СпА [36, 37]. В связи с этим интересны работы по сравнительной оценке влияния анти-ФНО-терапии на предотвращение рецидивов увеита у пациентов с АС. В исследовании J. Braun и соавт. данные о лечении и последующем наблюдении за пациентами с рецидивирующим ОПУ при АС с применением инфликсимаба и этанерцепта были оценены по результатам четырех плацебоконтролируемых и трех открытых исследований: 297 больных получали этанерцепт, 90 – инфликсимаб, 190 – плацебо [38]. Оказалось, что частота обострений увеита в группе больных, получавших антицитокиновые препараты, достоверно ниже – 6,8 эпизода на 100 пациенто-лет по сравнению с группой плацебо-контроля – 15,6 эпизода на 100 пациенто-лет при р = 0,01. Обострения увеита наступали реже у пациентов, получавших инфликсимаб, чем у тех, кто принимал этанерцепт (3,4 на 100 пациенто-лет и 7,9 на 100 пациенто-лет соответственно), хотя это различие не достигало уровня статистической значимости. Авторы сделали вывод о том, что антицитокиновая терапия позволяет существенно снизить частоту обострений переднего увеита при АС, причем инфликсимаб в этом отношении превосходил этанерцепт.
Сходные данные получены S. Guignard и соавт., которые провели ретроспективный анализ эффективности анти-ФНО-терапии у пациентов со СпА [39]. Из 46 человек, включенных в исследование, 13 получали лечение этанерцептом, 25 – инфликсимабом, 8 – адалимумабом. Средняя продолжительность анти-ФНО-терапии составила 1,2 года. Количество обострений увеита на 100 пациенто-лет составило для всех видов терапии 51,8 до лечения и 21,4 во время лечения. Для этанерцепта этот показатель составил 54,6 и 58,5, для инфликсимаба – 47,4 и 9,0, для адалимумаба – 60,5 и 0 соответственно. Результаты данного исследования показали превосходство антител к ФНО, особенно адалимумаба, над рекомбинантным растворимым рецептором в отношении снижения частоты обострений увеита.
В литературе имеются достаточно интригующие сообщения о случаях парадоксального развития увеита на фоне антицитокиновой терапии. Речь идет как об обострении, так и о развитии увеита de novo в прежде интактных глазах [36, 40]. При этом в большинстве случаев другие проявления заболевания (артрит, спондилит) успешно контролировались анти-ФНО-терапией. Случаи обострения увеита описывались на фоне лечения этанерцептом и инфликсимабом (чаще у больных АС), у отдельных больных с псориатическим артритом (ПсА) регистрировался ювенильный хронический артрит [40, 41, 42]. В большинстве описанных случаев прослеживалась четкая хронологическая связь между введением препарата и развитием увеита. После купирования увеита повторное назначение препарата вновь приводило к обострению воспаления глаза. Отмечено, что клинические проявления увеита, манифестировавшего у больных АС на фоне анти-ФНО-терапии, отличались от типичных при АС большей тяжестью и торпидностью, в ряде случаев двусторонним поражением глаз. Чем можно объяснить неожиданное развитие увеита на фоне мощного противовоспалительного лечения, существуют ли предикторы негативного ответа со стороны глаз на лечение анти-ФНО-препаратами, какие из анти-ФНО-препаратов более успешны в отношении увеита и превышает ли в целом польза анти-ФНО-терапии увеита потенциальный риск обострения – на эти вопросы еще предстоит найти ответы.
Используя независимые базы данных регистрации нежелательных явлений в период с 1998 по 2006 г., L. Lim и соавт. обобщили случаи развития увеита на фоне лечения различными анти-ФНО-препаратами [43]. Были подсчитаны все эпизоды увеита, развившиеся в этот период времени при лечении этанерцептом, инфликсимабом и адалимумабом. Оказалось, что с терапией этанерцептом было ассоциировано 43 случая увеита, с инфликсимабом – 14 случаев, с адалимумабом – 2.
T. Cobo-Ibáñez и соавт. провели исследование с участием пациентов со СпА, имеющих в анамнезе ОПУ и получавших анти-ФНО-препараты [44]. Из 19 пациентов (15 с АС, двое с недифференцированным СпА и двое с ПсА) 10 получали этанерцепт и 9 – инфликсимаб. Частота случаев увеита в группе лечения инфликсимабом составила 61,73 на 100 пациенто-лет до начала лечения и 2,64 – после начала лечения, в группе этанерцепта – 34,29 и 60 соответственно (р = 0,041). Похожие данные получены и в других работах [45].
Эти данные позволяют заключить, что в большинстве случаев обострения увеита ассоциированы с терапией этанерцептом. Для предотвращения повторных атак у больных с рецидивирующим увеитом также более эффективны инфликсимаб и адалимумаб [38, 39]. В чем причина таких различий в эффекте анти-ФНО-препаратов, остается неясным, пока в качестве объяснения этого феномена высказываются лишь гипотезы. Известно, что этанерцепт, в отличие от инфликсимаба, оказывает дополнительный ингибирующий эффект в отношении ФНО-бета (лимфотоксин-альфа). Однако на животных моделях было показано, что ФНО-бета также ассоциирован с развитием увеита. В связи с этим логично ожидать, что этанерцепт должен даже в большей степени, чем инфликсимаб, препятствовать развитию увеита. Аналогичные различия в эффективности инфликсимаба и этанерцепта установлены и при лечении других заболеваний, например, при болезни Крона. Возможно, ключом к пониманию биологических эффектов этих препаратов служат различия в их структуре и механизмах действия. Этанерцепт, являясь растворимым рецептором к ФНО-альфа, стимулирует Т-клеточный цитокиновый ответ, в то время как инфликсимаб и адалимумаб его подавляют. В основе другой гипотезы лежит различное влияние инфликсимаба и этанерцепта на апоптоз. Этанерцепт не активирует апоптоз, что имеет значение при заболеваниях, в патогенезе которых, предположительно, играет роль дефект апоптоза. В отличие от антител к ФНО-альфа, этанерцепт не уничтожает клетки, экспрессирующие цитокин на своей поверхности. В случае с увеитом пролонгируется период полувыведения ФНО-альфа из тканей глаза и повышается вероятность воспаления [43].
Таким образом, несмотря на то что три анти-ФНО-препарата (инфликсимаб, адалимумаб и этанерцепт) примерно одинаково эффективны для лечения больных артритом и спондилитом, их воздействие на увеит различно. Антитела к ФНО-альфа (инфликсимаб, адалимумаб) более эффективны, чем растворимые рецепторы, в отношении снижения частоты увеита и, по-видимому, реже ассоциированы с развитием увеита de novo. Тем не менее частота атак увеита у больных АС при лечении этанерцептом оказалась достоверно ниже, чем при приеме плацебо, поэтому все анти-ФНО-препараты могут успешно использоваться для лечения ревматических заболеваний, протекающих с поражением глаз [46, 47]. По мнению L. Lim, при развитии обострений увеита на фоне анти-ФНО-терапии целесообразна замена препарата [43].
Наши наблюдения подтвердили данные литературы об эффективности анти-ФНО-терапии и ее превосходстве по сравнению с традиционной противовоспалительной терапией у больных с увеитом при АС. У 48 пациентов с АС и рецидивирующим увеитом, получавших лечение анти-ФНО-препаратами, среднее число обострений увеита в год снизилось с 2,2 в период стандартной противовоспалительной терапии до 0,6 в год в период анти-ФНО-терапии (p = 0,0007), причем эффективными оказались все 3 препарата. Это позволило нам сделать вывод о достоверном снижении частоты атак увеита при АС на фоне анти-ФНО-терапии [48].
Заключение
В целом анти-ФНО-терапию можно рассматривать как высокоэффективный метод лечения, открывающий новые возможности и перспективы в лечении не только артритов, но и рефрактерных форм увеитов. Однако механизмы воздействия этих препаратов на глаз, вероятно, уникальны, отличны от воздействия на суставы и требуют дальнейшего изучения.
В развитии иммунного воспаления при увеите участвует не только ФНО-альфа, но и другие цитокины или сигнальные молекулы, ингибирование или активация которых теоретически также оправдана, но клинические подходы к их использованию недостаточно разработаны. Это, в частности, рецепторный комплекс интерлейкина-2 (ИЛ-2), различные поверхностные антигены Т-лимфоцитов, молекулы адгезии (ICAM-1), S-антиген сетчатки.
В настоящее время активно изучается препарат AIN457 (секукинумаб), представляющий собой моноклональные антитела, направленные против интерлейкина-17 (ИЛ-17) [49]. ИЛ-17 секретируется Т-хелперами 17 и вовлекается в качестве ключевого медиатора воспаления в патогенез аутоиммунных заболеваний, в том числе АС, псориаза, увеита.
Другой объект исследований – препарат апремиласт (СС-10004), специфический ингибитор фосфодиэстеразы-4 (PDE4) и модулятор про- и противовоспалительных медиаторов [49]. PDE4 – одна из основных фосфодиэстераз, экспрессирующихся лейкоцитами. Ингибирование PDE4 приводит к аккумуляции внутриклеточного циклического аденозинмонофосфата и, как следствие, к торможению транскрипции провоспалительных цитокинов и других клеточных реакций, таких как дегрануляция нейтрофилов, хемотаксис, клеточная адгезия. Предметом изучения в числе прочих станет влияние этих препаратов на течение увеита при АС. Можно рассчитывать, что разработка новых подходов к лечению увеита позволит существенно улучшить прогноз и качество жизни больных АС.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.