Особенности мукозального иммунитета у спортсменов высших достижений
- Аннотация
- Статья
- Ссылки
- English
Параметры мукозального иммунитета у спортсменов высших достижений могут иметь значение для оценки состояния иммунной защиты организма и мотивации к назначению и коррекции проводимой терапии. Изменения показателей мукозального иммунитета при инфекционных заболеваниях верхних дыхательных путей, имевшие место у участников исследования, указывают на необходимость применения у них препаратов с иммуномодулирующим эффектом.
Параметры мукозального иммунитета у спортсменов высших достижений могут иметь значение для оценки состояния иммунной защиты организма и мотивации к назначению и коррекции проводимой терапии. Изменения показателей мукозального иммунитета при инфекционных заболеваниях верхних дыхательных путей, имевшие место у участников исследования, указывают на необходимость применения у них препаратов с иммуномодулирующим эффектом.
Введение
За последние 20–30 лет физические нагрузки в спорте возросли в четыре-пять раз и стали предельными для человека. Увеличение физической нагрузки у спортсменов все чаще сопровождается нарушениями иммунной системы, выраженность которых зависит от интенсивности и продолжительности физических упражнений.
Длительные и интенсивные физические нагрузки провоцируют множественные изменения иммунной системы, или физиологический стресс. Спортсмены, которые напряженно тренируются в течение двух недель и впоследствии участвуют в соревнованиях, имеют повышенный риск развития инфекционных заболеваний верхних дыхательных путей (ИЗВДП) [1].
Следствием интенсивной физической нагрузки могут быть изменения врожденного, мукозального, адаптивного иммунитета и цитокиновой сети иммунной системы.
В США и Европе с участием спортсменов проведено немало исследований, посвященных изучению особенностей мукозального иммунитета. Например, в ходе французского исследования при повторных соревнованиях в команде триатлонистов ежедневные интенсивные упражнения приводили к снижению уровня иммуноглобулина (Ig) класса A слюны [2]. Аналогичные исследования проводились в Бразилии [3], Великобритании и США. Вместе с тем следует отметить, что снижение IgA слюны не является надежным маркером определения восприимчивости к инфекциям [4].
Местный иммунитет играет важную роль в защите слизистых оболочек респираторного, кишечного и урогенитального трактов, конъюнктивы глаза, ротовой полости. Защитные свойства слизистых оболочек (предотвращение проникновения антигенов во внутреннюю среду организма) обусловлены комплексом факторов (перистальтические движения, движение ресничек эпителия, отделение слизи, выделение ферментов), а также выработкой иммуноглобулинов и продукцией лизоцима, лактоферрина, интерферона и др. [5].
Гуморальный иммунитет слизистых оболочек предполагает продукцию IgA, IgM, IgG, а также секреторного IgА (sIgA). Иммуноглобулины попадают в ротовую полость с током крови, но их могут вырабатывать и плазмоциты. Затем иммуноглобулины проникают в место иммунного конфликта – в подслизистый или слизистый слой. IgM быстрее появляются на месте иммунного конфликта. Они менее эффективны, чем IgG, но оказывают иммуностимулирующее действие на местную лимфатическую систему.
К основным маркерам мукозального иммунитета относят sIgA. Слюна – основной материал для исследования мукозального иммунитета ротовой полости и верхних дыхательных путей. Плазматические клетки синтезируют sIgA, который в свою очередь играет первостепенную роль в защите слизистых оболочек от бактерий, грибов и вирусов. Он препятствует взаимодействию микробов со слизистой оболочкой, а также тормозит адгезию микроорганизмов, их токсинов и аллергенов на поверхности эпителия слизистых оболочек, предотвращая их проникновение во внутреннюю среду организма [5]. Антиадгезивные свойства sIgA лежат в основе его антибактериальных, антивирусных и антиаллергенных эффектов.
Продукция sIgA – основная эффекторная функция иммунной системы слизистых оболочек, обеспечивающая первую линию защиты от патогенов.
В недавних исследованиях доказана значимость антимикробных протеинов слюны – лактоферрина, лизоцима и др.
Действуя совместно с другими факторами защиты, такими как бета-лизин, дефензины, комплемент, лизоцим обеспечивает бактерицидность слюны. Расщепляя пептидогликан бактерий, он вызывает осмотический лизис и гибель микробов [6]. Однако лизоцим не активен в отношении вирусов.
Лизоцим проявляет синергизм с дефензинами – положительно заряженными аминокислотами. Дефензины связываются с цитоплазматическими мембранами бактерий, образуют поры, что также вызывает утечку клеточного содержимого и гибель клетки по механизму, аналогичному действию лизоцима [7].
В ротовой жидкости в достаточном количестве содержится лактоферрин. Захватывая ионы железа у бактерий, он парализует дыхание микробов. Лактоферрин служит важным маркером воспалительного процесса, показателем острой фазы воспаления [8].
Дефензины, кателицидины, гистатины относятся к пептидам, характеризующимся антибактериальными свойствами. Дефензины способны уничтожать бактерии, грибы и вирусы. Кроме того, они являются медиаторами воспаления, влияют на хемотаксис, оказывают иммуномодулирующий, цитотоксический и другие эффекты. Дефензины играют ведущую роль в защите макроорганизма от инфекций. Известно десять молекул дефензинов: шесть альфа- и четыре бета-дефензинов, сходных по структуре и функционированию [9].
Гистатины – семейство 12 гистидин-богатых пептидов, обнаруженных только в слюне человека и некоторых высших приматов. Гистатины обладают бактерицидной и фунгицидной активностью, что обеспечивает врожденную защиту ротовой полости [5].
Показано, что длительная и интенсивная тренировка способна индуцировать снижение sIgA в слюне. Результаты ряда исследований демонстрируют изменения показателей антимикробных пептидов в слюне у спортсменов после длительных нагрузок. Уменьшение секреции sIgA в слюне во время интенсивных тренировок и хронического стресса, вероятно, связано с изменением активности гипоталамо-гипофизарно-адреналовой оси при ингибиторных воздействиях на синтез sIgA и трансцитоз [10].
Учитывая противоречивость некоторых зарубежных исследований в отношении данных мукозального иммунитета у спортсменов, мы изучили показатели местного иммунитета у российских спортсменов высших достижений в различных видах спорта.
Материал и методы
Исследование проводилось в лаборатории клинической иммунологии Института иммунологии ФМБА России.
Для оценки мукозального иммунитета использовали нестимулированную слюну. Сбор смешанной нестимулированной слюны проводили в течение десяти минут, через час после еды и после предварительного ополаскивания рта водой. Затем образцы центрифугировали при 1500 g в течение 20 минут для удаления посторонних включений. Аликвоты слюны хранились в холодильнике при температуре -70 ºC.
При исследовании мукозального иммунитета оценивали следующие показатели:
-
уровни IgA и IgG, а также sIgA в слюне;
-
активность лизоцима в слюне;
-
количественное содержание лактоферрина в слюне.
Уровни IgA, IgG и sIgA в слюне определяли методом радиальной иммунодиффузии в геле Манчини. Активность лизоцима измеряли с помощью спектрофотометра. Количественное содержание лактоферрина оценивали методом твердофазного иммуноферментного анализа [11].
Результаты
Исследование проводилось в тренировочный период с нагрузками средней интенсивности.
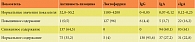
Всего было обследовано 213 спортсменов. В результате исследования мукозального иммунитета были получены данные, свидетельствовавшие о наличии дисфункции местного иммунитета у спортсменов высших достижений (см. таблицу).
У 61% участников исследования отмечалось снижение уровня sIgA в слюне.
Как известно, дефицит sIgA лежит в основе многих хронических воспалительных заболеваний слизистых оболочек и способствует развитию аллергических реакций [12].
Установлена прямая корреляция между уровнем снижения sIgA в слюне и наличием часто рецидивирующих вирусных инфекций у спортсменов (герпесвирусные, острые респираторные, рецидивирующие риносинуситы и т.д.).
Чаще снижение уровня sIgA отмечалось у спортсменов с выявленной аллергией.
У 64,3% обследованных отмечалось уменьшение активности лизоцима в слюне, что свидетельствовало о снижении местного иммунитета.
Лизоцим разрушает бета-1–4-гликозидную связь между N-ацетилглюкозамином и N-ацетилмурамовой кислотой пептидогликана, что приводит к изменению проницаемости клеточных стенок бактерий, лизису и гибели бактериальной клетки. Этот пептид высвобождает из клеточной стенки бактерии мурамилдипептид, что обеспечивает его защитные свойства.
У 96% спортсменов имело место повышение содержания лактоферрина в слюне. Повреждая внешнюю мембрану бактерий, лактоферрин дает возможность лизоциму воздействовать на пептидогликан бактерий. Лактоферрин также обладает фунгицидными свойствами, активен в отношении многих вирусов. Повышение содержания лактоферрина в слюне может свидетельствовать о наличии ИЗВДП.
У 69,1% спортсменов высших достижений выявлено снижение уровня IgА в слюне.
Специфические защитные механизмы слизистых оболочек обеспечивают защиту макроорганизма от воздействия внешней (инфекции) и внутренней агрессии за счет активации иммунокомпетентных и вспомогательных клеток, а также продукции иммуноглобулинов разных классов (G, M, A), в том числе секреторных (sIgA) [12]. Снижение содержания IgA в слюне обследованных спортсменов может говорить о снижении барьерной функции слизистой оболочки верхних дыхательных путей. Как следствие – повышенная заболеваемость ИЗВДП.
Нормальный уровень IgG в слюне отмечался у 95,6% обследованных, повышенный – у 4,6%. Это соответствует данным литературы: в нормальной слизистой оболочке верхних дыхательных путей значимых нарушений IgG иммунного ответа не выявляется [13].
Таким образом, на основании полученных данных установлено снижение показателей мукозального иммунитета у спортсменов высших достижений.
Многие патологические процессы, в том числе инфекционные, протекают на фоне сниженного местного иммунитета либо приводят к вторичной иммунной недостаточности. При хронической воспалительной реакции любой этиологии (инфекция, аллергия и др.) создаются условия для нарушения функционирования мукозального иммунитета, что подтверждено результатами данного исследования.
Выявленное нами уменьшение активности лизоцима в слюне может приводить к снижению фагоцитоза и литической активности комплекса sIgA с С3-компонентом комплемента в отношении грамотрицательных бактерий и повышенной инфекционной заболеваемости у спортсменов [14]. Такие изменения могут способствовать формированию и частым рецидивам ИЗВДП. Результаты клинико-лабораторных данных, полученных нами при обследовании спортсменов высших достижений, подтвердили это.
Как уже отмечалось, более трети обследованных нами спортсменов страдали рецидивирующими вирусными и бактериальными заболеваниями верхних дыхательных путей (ВДП). Необходимо учитывать, что в развитии любого местного клинического проявления со стороны слизистой оболочки носа и ВДП участвуют все интегральные системы организма (иммунная, нервная, эндокринная и др.). Местный иммунитет ЛОР-органов и ВДП – это барьерная функция слизистой оболочки, включающая две линии защиты:
-
механизм иммунного исключения или охраны; обеспечивается мукоцилиарным клиренсом;
-
механизм иммунной элиминации, или иммунное устранение; обеспечивается иммунным ответом слизистого и подслизистого слоя [15].
Профилактика и лечение
В связи с тем что одной из основных причин частого возникновения острых респираторных вирусных инфекций (ОРВИ) и более тяжелого течения инфекционно-воспалительных заболеваний является несостоятельность системы местной защиты, особую роль в лечении и профилактике ИЗВДП играют иммуномодуляторы местного действия. Они не запрещены антидопинговым контролем, в силу чего могут занять свою нишу в лечении и профилактике ИЗВДП у спортсменов высших достижений.
В настоящее время применяется несколько типов иммуномодуляторов местного действия:
-
препараты на основе компонентов клеточной стенки бактерий;
-
бактериальные лизаты: лизаты бактерий Candida albicans, Corynebacterium pseudodiphtheriticum, Enterococcus faecalis, E. faecium, Fusobacterium nucleatum subsp., Klebsiella pneumoniae subsp. pneumoniae, Lactobacillus acidophilus, L. fermentum, L. helveticus, L. delbrueckii subsp. lactis, Streptococcus pyogenes groupe A, S. sanguis, Staphylococcus aureus subsp. aureus (ИРС 19, Имудон);
-
препараты на основе нуклеиновых кислот (натрия нуклеинат, деринат и др.);
-
интерфероны (Виферон);
-
полимерные (Полиоксидоний).
Эффективность иммуномодуляторов системного и местного действия доказана в многочисленных клинических исследованиях. На фоне их применения удается добиться увеличения длительности ремиссии, снижения частоты обострений и госпитализаций. Кроме того, использование иммуномодуляторов способствует профилактике развития инфекционных осложнений. Многие иммуномодуляторы, в частности Полиоксидоний и Виферон, включены в медицинские стандарты по комплексному лечению рецидивирующих вирусных инфекций, рецидивирующих хронических неспецифических заболеваний легких, ЛОР-патологии, туберкулеза.
Так, в открытом рандомизированном исследовании с участием 77 пациентов с острыми и хроническими синуситами показано, что ИРС 19 снижает количество пункций и рецидивов риносинуситов у взрослых [16].
Препарат Имудон способствует устранению очагов инфекции в ротоглотке за счет увеличения фагоцитарной активности нейтрофилов, завершенности фагоцитоза и уменьшения внутриклеточной персистенции возбудителей, способствует нормализации микрофлоры полости рта и глотки и снижает риск рецидивов [17].
Профилактическое использование сублингвальной формы Полиоксидония усиливает иммунный ответ на широкий круг патогенов, ускоряя их уничтожение, а также обезвреживание возможных эндотоксинов микрофлоры респираторного тракта. Клинически это проявляется прекращением избыточного выделения экссудата, разжижением мокроты, улучшением оттока секрета из полостей верхних дыхательных путей.
Снижение показателей мукозального иммунитета отмечается у спортсменов высших достижений, страдающих аллергическими заболеваниями. В том случае, когда аллергические заболевания у спортсменов протекают в сочетании с рецидивирующими очагами бактериальной, вирусно-грибковой инфекции (хронический гнойно-обструктивный бронхит, хронический гнойный гайморит, слизисто-кожный кандидоз, рецидивирующая герпетическая инфекция и т.д.), патогенетически обоснованным считается назначение Полиоксидония. Препарат не усиливает синтез IgE и не вызывает обострение аллергических заболеваний [18, 19].
Особого подхода требует и назначение лечебно-профилактических мероприятий при аллергических заболеваниях у спортсменов высших достижений, что определяется требованиями антидопингового комитета и запретом на применение спортсменами многих противоаллергических средств. Если же использование запрещенных препаратов жизненно необходимо, следует соблюдать регламент оформления соответствующих документов. У спортсменов, страдающих аллергическими заболеваниями, разрешены к использованию так называемые барьерные методы терапии (например, Превалин), препараты, стабилизирующие мембраны тучных клеток, в частности препараты кромоглициевой кислоты (Интал, КромоГЕКСАЛ). Впервые в клинике Института иммунологии у спортсменов высших достижений показан высокий клинический эффект основного, патогенетически обоснованного метода лечения – аллергенспецифической иммунотерапии.
Заключение
Раннее выявление патогенеза иммуноопосредованных воспалительных состояний на фоне аллергических заболеваний и иммунной недостаточности позволяет своевременно и эффективно решать проблемы оказания спортсменам высших достижений первичной и специализированной аллергологической и иммунологической помощи. Эта помощь направлена на профилактику и раннюю диагностику иммунозависимых заболеваний, среди которых особое место занимают аллергические заболевания (бронхиальная астма, аллергический ринит, поллиноз, атопический дерматит), иммунодефицитные состояния и аутоиммунные заболевания.
N.V. Shartanova
Institute of Immunology of the Russian Federal Medical and Biological Agency
Contact person: Nataliya Valeryevna Shartanova, nshartanova@yandex.ru
This study was aimed at determining parameters and features of mucosal immunity in high-performance athletes. It was found that mucosal immunity in these persons was compromised, which was manifested as elevated immunoglobulin class G and lactoferrin levels in saliva and decreased activity of lysozyme.
By examining parameters of mucosal immunity in high-performance athletes it may have an importance for assessing status of immune system as well as evaluating motivation for administration and correction of the applied therapy. Changes in parameters of mucosal immunity found in high-performance athletes during upper respiratory tract infections point at the need to administer drugs with immunomodulating effect.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.