Пищевая аллергия и пищевая непереносимость: подходы к диагностике, терапии и профилактике
- Аннотация
- Статья
- Ссылки

Пищеварительная система человека толерантна к огромному разнообразию биологических макромолекул, появляющихся в организме в процессе переваривания пищевых продуктов, однако у некоторых людей развиваются побочные реакции на пищу.
Реакции непереносимости пищевых продуктов периодически встречаются почти у каждого человека, но впервые чаще всего отмечаются в детстве. У детей раннего возраста наличие таких реакций часто называют «экссудативным диатезом», еще раньше их называли «золотухой», а позднее – «аллергией». В последние десятилетия отмечается рост распространенности реакций непереносимости продуктов питания, а также усиление степени их тяжести. Сложность проблемы заключается в том, что в возникновении непереносимости пищевых продуктов могут участвовать различные механизмы, как иммунологически обусловленные (пищевая аллергия (ПА)), так и неиммунологические (пищевая непереносимость (ПН)). Реакции на пищу могут являться результатом проявления аллергии на продукты питания, пищевые добавки, примеси и др.
Тем не менее чаще всего нежелательные реакции, развивающиеся после приема пищи, бывают связаны с множеством других причин: нарушениями процессов переваривания и всасывания пищевого субстрата, инфекциями, врожденными и приобретенными нарушениями в работе ферментных систем и др.
История вопроса, терминология и эпидемиология реакций на пищевые продукты
Реакции повышенной чувствительности к пищевым продуктам известны с давних времен. Впервые тяжелые реакции в виде желудочно-кишечных и кожных проявлений после употребления коровьего молока описал Гиппократ. Более того, в сочинении “De rаtione victus in acutis” («О диете при острых болезнях») и др. Гиппократ положил начало рациональной диетологии.
Гален впервые сообщил об аллергически-подобных реакциях у детей после употребления козьего молока.
Начиная с XVII столетия число наблюдений тяжелых побочных реакций на пищу (приступы удушья после употребления рыбы, кожные проявления после употребления яиц или морепродуктов) постоянно растет.
В 1901–1902 гг. Ш. Рише и его коллеги впервые описали пищевую анафилаксию, а в 1911 г. опубликовали монографию «Пищевая анафилаксия». В 1913 г. Ш. Рише была присуждена Нобелевская премия в области физиологии и медицины в знак признания его работ по анафилаксии.
Существенный вклад в понимание проблемы ПА в начале 1930-х гг. внес исследователь из США А.Н. Rowe, обозначив ее как важнейшую медицинскую проблему.
В настоящее время нет точных данных о распространенности ПА. Это обусловлено множеством причин: отсутствием единых подходов к диагностике ПА, отсутствием ее унифицированной классификации, наличием в пище большого количества потенциальных аллергенов, так называемых скрытых пищевых аллергенов (например, в качестве наполнителя в колбасах используют сою или арахис и др.), употребление генетически модифицированных продуктов и др.
По результатам популяционных исследований, в среднем в мире ПА встречается у 10% детского и у 2% взрослого населения.
Существует мнение о том, что аллергия к продуктам животного происхождения обычно возникает у детей в возрасте до 6 лет, а аллергия к продуктам растительного происхождения чаще всего возникает в возрасте старше 6 лет и у взрослых. У лиц с аллергическими заболеваниями (АЗ) ПА выявляется чаще (в среднем в 12% случаев), чем у лиц без аллергопатологии (3% случаев).
В зависимости от механизма развития выделяют истинную пищевую аллергию (ИПА) и ложную пищевую аллергию (ЛПА).
Роль различных пищевых продуктов в развитии ПА
Практически любой пищевой продукт может стать аллергеном и причиной развития ПА или ПН. Наибольшее число случаев ПА – это аллергия к продуктам белкового происхождения, содержащим животные и растительные белки, хотя прямая зависимость между содержанием белка и аллергенностью продуктов отсутствует.
Пищевые аллергены (Пал) в основном представляют собой белки гликопротеины с молекулярной массой 10–70 кДа; они имеют трехмерную структуру, хорошо растворимы в воде, некоторые из них термостабильны и устойчивы к воздействию протеолитических ферментов. Аллергенность Пал зависит от наличия эпитопов (часть белковой молекулы (аллергена), которая связывается со специфическим антителом – иммуноглобулином класса Е (IgE), иммуноглобулином класса G (IgG)) и от пространственной конфигурации молекулы. Пал способны изменять свои антигенные свойства в процессе кулинарной обработки продуктов. Например, нагревание приводит к денатурации белка, при этом одни пищевые продукты теряют аллергенность, а другие, напротив, становятся более аллергенными. Хотя термическая денатурация может вызвать потерю нативной белковой конформации, IgE-антитела пациентов могут все еще реагировать с этими денатурированными пищевыми белками; предполагают, что эпитопы аллергенов не зависят от нативной конформации белка. Пастеризация, стерилизация и глубокое замораживание мало влияют на степень аллергенности пищевых продуктов. Напротив, неэнзиматическое побурение продуктов (например, в процессе дозревания овощей или фруктов) резко повышает их аллергенность.
При обычном питании в течение суток человек получает около 120 пищевых аллергенов.
Выделяют пищевые аллергены растительного и животного происхождения. К наиболее распространенным из них относят молоко, рыбу и морепродукты, яйца, пищевые злаки, бобовые (арахис, соя), орехи и др., что составляет 90% от всех этиологически значимых Пал. На долю всех остальных Пал приходится приблизительно 10%.
Следует заметить, что этиологическая значимость и роль пищевых продуктов в развитии АЗ у взрослых и детей различна. Так, у детей ПА часто бывает первым клиническим проявлением АЗ. К аллергенам, наиболее часто вызывающим реакции у детей, относятся коровье молоко, куриные яйца (желток), рыба и бобовые. Кроме того, широко распространена сенсибилизация к глютену или изолированная сенсибилизация к пшенице, белкам банана и риса. У 76% детей выявляется поливалентная сенсибилизация.
У взрослых ПА нередко связана с перекрестной сенсибилизацией к другим группам аллергенов, особенно ингаляционным (пыльца растений, бытовые или эпидермальные аллергены), тогда как сенсибилизация к грече, картофелю, сое, бобовым и кукурузе встречается реже. У взрослых пациентов преобладает аллергия к арахису и древесным орехам (фундук и др.), рыбе, ракообразным и моллюскам, часто вызывающим тяжелые реакции, вплоть до анафилактического шока, высока роль перекрестной аллергии (к свежим фруктам и овощам), а аллергия на молоко и яйца (яичный белок) встречается реже, чем у детей. Иногда отмечаются тяжелые аллергические реакции на говядину и свинину, а также реакции при употреблении зерновых продуктов, зараженных клещами.
Перекрестные свойства пищевых и других групп аллергенов
Одной из серьезных проблем ПА является наличие перекрестных свойств как с другими аллергенами в своей группе, так и с различными неинфекционными и инфекционными аллергенами. Перекрестное реагирование обусловлено сходством антигенных детерминант у родственных групп пищевых продуктов, а также антигенной общностью между пищевыми и пыльцевыми аллергенами, пищевыми продуктами и лекарствами растительного происхождения, бытовыми и эпидермальными аллергенами [1–3].
Основными источниками растительных Пал, имеющих важное значение в формировании ПА, являются белки защиты, или PR-белки (pathogen-response proteins), актинсвязывающие (структурные) белки или профилины, тиоловые протеазы и проламины (резервные белки семян и белки хранения (запаса)).
Из 14 групп PR-белков 8 содержат аллергены, имеющие перекрестные реакции с различными пищевыми продуктами. Так, PR2-белки – бета-1,3,-глюконазы, выделенные из бразильской гевеи (Hev b 2), – имеют перекрестные свойства со многими овощами и фруктами и являются причиной развития фруктово-латексного синдрома. PR3-белки – эндохитиназы – гидролитически расщепляют хитин и вызывают перекрестную чувствительность с латексом, фруктами, овощами. PR4-белки – хитиназы – имеют аминокислотные последовательности (АК), гомологичные белкам сои, картофеля, томатов. Что касается тауматин-подобных белков (PR5-белки), первым из них был выделен главный аллерген яблок, вишни и пыльцы горного кедра. АК этого аллергена гомологичны с тауматином пшеницы, сладкого перца, томатов. PR8 белки – латексный минорный аллерген гевамин, идентичный лизоциму (хитиназе огурца). PR9-белки – лигнин-образующие пероксидазы. Они были выделены из пшеничной муки, и с ними ассоциирована «астма булочников». Для PR10-белков (большая группа внутриклеточных белков из растений разных семейств (косточковые, пасленовые и др.)) показана структурная гомология с пыльцой березы, ольхи, орешника, каштана, граба, дуба и пищевых продуктов – каштана, фундука, желудя и др. PR14-белки обеспечивают межмембранный перенос фосфолипидов из липосом к митохондриям. PR14-белки обладают выраженной перекрестной реактивностью. Первые PR14-белки были получены из пыльцы крапивы, к этой же группе принадлежат аллергены из персиков, абрикосов, слив, вишни, яблок, винограда, лесного ореха, каштана.
Актинсвязывающие (структуральные) белки, или профилины, впервые были выделены из пыльцы березы. Актинсвязывающие белки обладают выраженной перекрестной реактивностью со многими группами аллергенов и часто являются причиной анафилактических реакций, особенно у детей с аллергией на сою и арахис, у больных поллинозом они вызывают перекрестные реакции на морковь, картофель, сельдерей, тыквенные семена, лесной орех, томаты и др.
Тиоловые протеазы содержат папаин из папайи, фицин из винной ягоды, бромелайн из ананаса, актинидин из киви, соевый белок из сои и др.
Проламины – резервные белки семян и белки хранения (запаса); многие резервные белки семян относятся к PR14-белкам.
Наличие перекрестных реакций между белками, содержащимися в различных пищевых продуктах, имеет особенно большое значение для больных с ИПА, поскольку у этих пациентов возможно развитие перекрестных аллергических реакций на другие группы аллергенов, например пыльцевые, бытовые, эпидермальные.
Классификация ПА
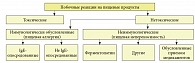
Общепринятая унифицированная классификация пищевой аллергии отсутствует, что создает ряд проблем при определении тактики ведения больных с непереносимостью пищевых продуктов, столь различных по патогенезу. На конгрессе Европейской академии аллергии и клинической иммунологии (Стокгольм, июнь 1994 г.) была предложена рабочая классификация, в основу которой были положены механизмы развития этих реакций (рис.). Согласно этой классификации, среди реакций непереносимости пищевых продуктов выделяют реакции на пищу токсического и нетоксического характера. Нетоксические реакции на пищу могут быть результатом участия как иммунных, так и неиммунных механизмов, на что указывал еще в 1960-х гг. академик РАМН А.Д. Адо.
К ИПА следует относить реакции непереносимости пищевых продуктов, в развитии которых лежат иммунологические механизмы. Эти реакции могут протекать как по гуморальным, так и по клеточным механизмам аллергии, то есть с участием аллергических антител или сенсибилизированных лимфоцитов. Иммунологически опосредованная истинная ПА в зависимости от механизма развития делится на IgE- и не IgE-опосредованные реакции и ПА, протекающую по механизмам замедленной аллергии.
Неиммунологическая ПН нетоксического характера может быть обусловлена наличием врожденных и приобретенных ферментопатий или нарушением (недостаточностью или дефицитом) ферментных систем (например, непереносимость коровьего молока вследствие лактазной недостаточности), наличием в пищевых продуктах фармакологических и других примесей.
После употребления пищевых продуктов, содержащих в виде примесей токсические вещества, могут развиваться токсические реакции. Клинические проявления этих реакций и степень их тяжести зависят от дозы и химических свойств токсических соединений, а не от вида пищевого продукта. Токсические примеси в продуктах питания могут быть как естественным компонентом пищи, так и образовываться в процессе приготовления пищи. Кроме того, токсины могут попадать в пищу при загрязнении или за счет токсического действия пищевых добавок.
К естественным компонентам пищи относятся натуральные токсины (в частности цианиды), которые содержатся в грибах, фруктах, ягодах, косточках фруктов (компот из вишни с косточкой, из абрикоса с косточкой). К токсинам, образующимся в процессе приготовления пищи, относятся, например, гемагглютинины, которые содержатся в недоваренных бобах. В плесени (в сырах, в плесени на хлебных злаках, крупах, сое) содержится афлатоксин, способный вызывать тяжелые побочные реакции после употребления таких продуктов. Примером токсинов, которые могут попадать в пищу при загрязнении, являются токсины морских водорослей, которыми питается рыба, моллюски и ракообразные. В этих водорослях содержатся PSP-токсин (paralytic shellfish poisoning) и DSP-токсин (diarrhetic shellfish poisoning), ответственные за развитие тяжелых системных неиммунологических реакций, которые ошибочно могут относить к аллергическим реакциям на рыбу и морепродукты.
Токсические реакции могут отмечаться при употреблении продуктов с избыточным содержанием нитратов, нитритов, сульфатов. Кроме того, токсические реакции на пищу могут развиваться за счет присутствия в пище токсинов или бактерий, способных вызывать системные реакции, напоминающие шок (так называемый гистаминовый шок, например, массивное высвобождение гистамина при отравлении рыбой). Системные реакции могут развиваться при употреблении пищевых продуктов, содержащих химические примеси. Примером таких реакций могут служить головная боль, распространенные пятнистые высыпания и покраснение кожи, сердцебиение, одышка при употреблении кофе с избыточным содержанием кофеина.
Факторы, способствующие формированию ПА
Факторы, способствующие развитию пищевой аллергии, являются общими для взрослых и детей [4, 5]. Следует отметить, что при нормальном функционировании желудочно-кишечного тракта (ЖКТ) и гепатобилиарной системы аллергия к пищевым продуктам, поступающим в организм, не развивается.
К основным факторам, способствующим формированию пищевой аллергии, относятся атопический статус (генетически детерминированная предрасположенность к развитию аллергии); незрелость кишечника; временный дефицит секреторного компонента иммуноглобулина класса А (sIgA); факторы окружающей среды; чрезмерное воздействие антигенов на кишечник; иммуносупрессорное воздействие вирусных инфекций; раздражители кишечника, паразиты, желудочно-кишечный кандидоз, алкоголь.
Провоцирующими факторами развития ПА служат ранний перевод ребенка на искусственное вскармливание; нарушение режима питания детей, выражающееся в несоответствии объема и соотношения пищевых ингредиентов весу и возрасту ребенка; сопутствующие заболевания ЖКТ, заболевания печени и желчевыводящих путей и др.
Нормальное переваривание и всасывание пищевых продуктов обеспечивается состоянием нейроэндокринной системы, строением и функцией ЖКТ, печени и желчевыводящих путей, составом и объемом пищеварительных соков, составом микрофлоры кишечника, состоянием местного иммунитета слизистой кишечника (лимфоидная ткань, секреторные иммуноглобулины и так далее), а также другими факторами.
В норме пищевые продукты расщепляются до соединений, не способных вызывать аллергию (аминокислоты и другие неантигенные и неаллергенные структуры), а кишечная стенка является непроницаемой для нерасщепленных продуктов, которые обладают или могут обладать при определенных условиях аллергизирующей активностью или способностью вызывать псевдоаллергические реакции.
При воспалительных заболеваниях ЖКТ, недостаточности функции поджелудочной железы, ферментопатии, дискинезии желечевыводящих путей и кишечника и др. отмечается повышение проницаемости слизистой кишечника, способствующее избыточному всасыванию нерасщепленных продуктов и развитию ПА или псевдоаллергии. Беспорядочное питание, слишком редкий или чрезмерно частый прием пищи приводят к нарушению секреции желудка, развитию гастрита, гиперсекреции слизи и другим расстройствам, также способствующим формированию пищевой аллергии или псевдоаллергии.
На формирование повышенной чувствительности к пищевым продуктам белковой природы оказывают влияние не только количество принятой пищи и нарушения диеты, но и кислотность желудочного сока [6]. В экспериментальных исследованиях установлено, что с увеличением кислотности желудочного сока всасывание нерасщепленных белков уменьшается. Показано, что недостаток в пище солей кальция способствует повышению всасывания нерасщепленных белков.
Иммунные механизмы развития ПА
Полученные за последние годы сведения позволили конкретизировать некоторые представления о механизмах формирования ПН, однако до настоящего времени механизмы формирования ИПА изучены недостаточно.
Сенсибилизация к пищевым аллергенам может произойти в разные периоды жизни пациента:
- внутриутробно через амниотическую жидкость, когда аллерген попадает в организм плода сквозь кожу, обладающую высокой проницаемостью, а также при глотательных или дыхательных движениях плода (попадание антигена в кишечник и дыхательные пути соответственно);
- в младенчестве и раннем детском возрасте;
- в детском и подростковом возрасте;
- у взрослых.
Аллергия к Пал в большинстве случаев развивается в младенческом возрасте и встречается как у детей с отягощенным, так и с неотягощенным аллергологическим анамнезом. Было установлено, что у детей с неотягощенным аллергологическим анамнезом пик концентрации аллергенспецифических IgE (антител к пищевым аллергенам) обычно наблюдается в течение первого года жизни, а затем снижается, и в дальнейшем IgE-антитела к Пал не определяются. Материнские аллергенспецифические IgE не проникают через плацентарный барьер, но известно, что продуцировать такие антитела плод может уже на сроке 11 недель. Предполагают, что основную роль в передаче аллергена плоду играют материнские антитела, принадлежащие к IgG. Эти антитела проникают через плацентарный барьер, неся пищевой аллерген в составе иммунного комплекса.
У детей с АЗ титр аллергенспецифических IgE к пищевым продуктам постоянно сохраняется и растет (часто он бывает очень высоким).
Имеются данные о том, что наличие высокого титра аллергенспецифических IgE к куриному белку у детей раннего возраста является маркером, позволяющим предсказать развитие в дальнейшем АЗ. В основе истинных аллергических реакций на пищевые продукты лежит сенсибилизация и иммунный ответ на повторное введение пищевого аллергена.
Наиболее изучена ПА, развивающаяся по механизмам аллергических реакций 1-го типа (IgE-опосредованного). Для формирования ПА пищевой аллерген должен обладать способностью усиливать функцию Т-хелперов и угнетать активность Т-супрессоров, что приводит к усилению продукции специфических IgE-антител. Кроме того, аллерген должен иметь не менее двух идентичных детерминант, отстоящих друг от друга, связывающих рецепторы на клетках-мишенях с последующим высвобождением медиаторов аллергии.
При истинной ПА для развития аллергической реакции достаточно употребить очень небольшое количество пищевого продукта. Более того, степень тяжести аллергической реакции при ПА не зависит ни от количества (дозы) поступившего в организм продукта, ни от способа попадания его в организм. Известен случай, когда девушка, страдавшая аллергией на арахис, умерла после того, как ее поцеловал парень, пообедавший бутербродом с арахисовым маслом. Например, человек, страдающий аллергией к арахису, съев часть или целую конфету или печенье, содержащие «следы» арахиса, может погибнуть от анафилактического шока.
Иногда ПА может развиваться на некоторые пищевые добавки (ПД), особенно азокрасители (в частности, тартразин). В этом случае азокрасители выполняют роль гаптенов и, образуя комплексы с белками, например, с сывороточным альбумином, становятся полноценными антигенами, на которые в организме вырабатываются специфические антитела. Существование IgE к тартразину было продемонстрировано в экспериментах на животных, выявлялись они и у человека при использовании радиоаллергосорбентного теста (РАСТ). Кроме того, возможно развитие гиперчувствительности замедленного типа, проявляющейся в виде экземы, возникающей после употребления пищевых продуктов, содержащих азокрасители, бензилгидрокситолуол, бутилгидроксианизол, хинин и др.
В частности, установлено, что ПД могут индуцировать выработку фактора, тормозящего миграцию макрофагов, являющегося медиатором гиперчувствительности замедленного типа, что свидетельствует о развитии замедленных аллергических реакций на пищевые продукты, содержащие эти добавки.
Следует, однако, заметить, что в двойном слепом плацебоконтролируемом исследовании определяющая роль изотипов иммуноглобулинов (кроме IgЕ) иммунных комплексов и клеточно-опосредованных реакций в механизме реакции на пищевые продукты не была доказана с достаточной убедительностью.
Ложные аллергические реакции на пищевые продукты (псевдоаллергия)
Чаще всего, примерно у 65–70% больных, непереносимость пищевых продуктов протекает по механизмам псевдоаллергических реакций (ПАР) [7]. Механизмы развития ПАР, в отличие от истинной ПА, не связаны с нарушениями в системе иммунитета.
ПАР получили свое название в связи с тем, что, как и случаи истинной пищевой аллергии, они имеют четкую связь развития реакции с приемом пищи и одинаковые клинические проявления, но различаются совершенно иными механизмами их формирования.
В реализации ПАР принимают участие те же клетки-мишени (тучные клетки, базофилы) и медиаторы, что и при истинной ПА (гистамин, лейкотриены, простагландины и другие цитокины и др.), но высвобождаются они из клеток-мишеней аллергии неспецифическим путем. Это возможно при прямом воздействии антигенов пищевого субстрата (без участия аллергических антител) на клетки-мишени или опосредованно, при активации антигеном ряда биологических систем (система комплемента, кининовая система и др.). Среди медиаторов, ответственных за развитие симптомов непереносимости при ЛПА, особая роль отводится гистамину.
Факторы, способствующие развитию ПАР на пищевые продукты
Развитию ПАР на пищевые продукты способствует ряд факторов:
- избыточное поступление в организм гистамина при употреблении (в том числе избыточном) пищевых продуктов, богатых гистамином, тирамином, гистаминолибераторами;
- избыточное образование гистамина и/или тирамина из пищевого субстрата путем синтеза кишечной флорой;
- повышенное всасывание гистамина и/или тирамина при функциональной недостаточности слизистой оболочки ЖКТ;
- избыточное образование тирамина при частичном дефиците тромбоцитарной моноаминооксидазы, что приводит к неполному разрушению эндогенного тирамина;
- повышенное высвобождение гистамина из клеток-мишеней;
- нарушение синтеза простагландинов и лейкотриенов.
При ПАР, в отличие от истинной ПА, имеет значение количество съеденной пищи, вызывающей реакцию, – чем оно больше, тем сильнее выражены клинические симптомы ПАР.
Наиболее часто ПАР развиваются после употребления продуктов, богатых гистамином, тирамином, гистаминолибераторами, таких как ферментированные сыры (рокфор промышленного производства, камамбер, бри, чеддер), кислая капуста, вяленая ветчина и говяжьи сосиски, ферментированные вина, свиная печень, консервированный тунец, филе и консервированная копченая икра сельди, маринованная сельдь, шпинат, томаты, пивные дрожжи и др.
Наиболее часто ПАР на рыбные продукты развиваются после употребления рыбы с высоким содержанием красного мяса, которое при приготовлении становится коричневым (например, рыба семейства скумбриевых – тунец, скумбрия, макрель) и содержит в мышечной ткани большое количество гистидина. В случаях неправильного хранения рыбы (охлаждения или замораживания с нарушением технологии этого процесса) гистидин под влиянием бактерий (Proteus morganii, Klebsiella pneumoniae) превращается в гистамин. В ходе этого процесса образуется большое количество гистамина, который называют скомбротоксином, и именно он (то есть гистамин) вызывает скомбротоксическое отравление, похожее на аллергическую реакцию: покраснение кожи, крапивница, рвота, боли в животе, диарея. Особенностью скомбротоксина является устойчивость к тепловой обработке: он не разрушается при варке, копчении, солении.
В последние годы отмечается рост частоты ПАР на примеси, обладающие высокой физической и биологической активностью (фторсодержащие, хлорорганические, сернистые соединения (в том числе пестициды), аэрозоли кислот, продукты микробиологической промышленности и др.), загрязняющие пищевые продукты.
Кроме того, нередко причиной развития ПАР на пищевые продукты является не сам продукт, а различные ПД, вносимые для улучшения вкуса, запаха, цвета, обеспечивающие длительность хранения. ПД – это большая группа веществ, в которую входят добавки различного назначения: красители, ароматизаторы, антиоксиданты, эмульгаторы, ферменты, загустители, бактериостатические вещества, консерванты и др. Чаще всего используются консерванты, красители, загустители, ароматизаторы (табл.). К наиболее распространенным пищевым красителям относятся тартразин, обеспечивающий оранжево-желтое окрашивание продукта; нитрит натрия, сохраняющий красный цвет мясным продуктам, и др. Для консервации пищи применяют глутамат натрия, салицилаты, в частности, ацетилсалициловую кислоту и др. Среди ПД выделяют естественные и искусственные. Реакции на естественные ПД встречаются реже, чем на искусственные.
Одной из важнейших причин ПН является недостаточность ферментов, которая приводит к нарушению обмена и всасывания углеводов, белков и жиров. Примером нарушения всасывания и обмена углеводов является недостаточность лактазы – фермента, расщепляющего молочный сахар (лактозу). При недостаточности лактазы после употребления молока у пациента возникают повышенное газообразование в кишечнике и жидкий стул. Кисломолочные продукты такими больными переносятся хорошо, поскольку в процессе молочнокислого брожения лактоза частично разрушается.
Другим примером заболеваний этого типа служит галактоземия – непереносимость галактозы. Галактоземия относится к наследственным ферментопатиям, передается по рецессивному типу наследования. В основе заболевания лежит нарушение превращения галактозы в глюкозу из-за отсутствия фермента галактокиназы, что приводит к накоплению фермента галактозо-1-фосфата, повреждающего ткань почек, печени, хрусталика глаза. Существует более мягкое течение галактоземии, имеющее единственный симптом – развитие катаракты.
Еще один пример – фруктоземия – редкое наследственное заболевание, связанное с отсутствием фермента, участвующего в обмене фруктового сахара – фруктозы. Клинические проявления (потливость, тошнота, рвота, иногда потеря сознании, иногда желтуха) возникают после приема пищи, содержащей фруктозу (фрукты, мед, тростниковый сахар).
К ПН, связанной с нарушением обмена веществ, относится и фенилкетонурия, или фенилпировиноградная олигофрения, – тяжелое заболевание, связанное с нарушением белкового обмена, при котором отсутствует фермент, необходимый для превращения аминокислоты (фрагмента белка) фенилаланина в тирозин. В крови пациента накапливаются фенилаланин и продукт его расщепления – финилпировиноградная кислота, вызывающие поражение головного мозга, приводящее к слабоумию.
В настоящее время болезнь научились выявлять с первых дней жизни ребенка (в родильных домах всем новорожденным проводят специальное обследование). Лечение заключается в исключении из рациона продуктов, содержащих фенилаланин (молоко, сыр, куриное мясо, яйца, белая рыба, хлеб, рис, горох, фасоль, арахис, орехи, картофель, а также сахарозаменители).
Диагностика ПА
Принципы диагностики истинной ПА те же, что и для всех АЗ, и направлены на выявление причинно-значимых пищевых аллергенов, специфических аллергических антител или продуктов специфического взаимодействия антител с антигенами, а также на выявление реакций на пищевые продукты, протекающих по механизму гиперчувствительности замедленного типа. Диагностика ПА представляет большие сложности в связи с отсутствием единых методических подходов, унифицированных методов диагностики непереносимости пищевых продуктов, позволяющих выявить все многообразие механизмов, принимающих участие в реализации реакций гиперчувствительности к пищевым продуктам. При ИПА непереносимость продуктов сохраняется многие годы, часто всю жизнь, требует разработки индивидуальных элиминационных диет, влияет на трудоспособность и качество жизни пациентов. При ПАР непереносимость пищевых продуктов, как правило, развивается на фоне сопутствующих соматических заболеваний и требует иного алгоритма диагностики и лечения.
Для диагностики ИПА применяют методы специфического аллергологического обследования и оценки клинико-лабораторных данных. К специфическим методам аллергологического обследования, наиболее часто используемым в практической аллергологии, относятся кожные тесты, провокационные методы, методы выявления специфических IgE-антител к пищевым продуктам.
Кожные тесты являются высокоспецифичным и доступным методом диагностики ПА, протекающей по IgE-зависимому механизму. Однако следует иметь в виду, что у ряда больных возможны ложноположительные или ложноотрицательные результаты, а у некоторых пациентов имеются противопоказания к использованию кожных тестов. Кроме того, информативная значимость размеров волдыря, свидетельствующего о реакции на те или иные пищевые аллергены, бывает различной [8].
Так, диагностически значимыми при ПА являются следующие размеры волдыря: коровье молоко – ≥ 5 мм; яйцо куриное – ≥ 4 мм; арахис – ≥ 6 мм; пищевые злаки – ≥ 3 мм; соя – ≥ 3 мм.
100%-ной положительной предиктивной значимостью у детей старше 2 лет обладают следующие размеры волдыря: коровье молоко – ≥ 8 мм, яйцо куриное – ≥ 7 мм, арахис – ≥ 6 мм.
100%-ной положительной предиктивной значимостью у детей в возрасте до 2 лет обладают следующие размеры волдыря: коровье молоко – ≥ 6 мм, яйцо куриное – ≥ 5 мм, арахис – ≥ 4 мм.
Основными показаниями для назначения лабораторных методов аллергодиагностики in vitro являются ранний детский возраст, высокая степень сенсибилизации пациента, непрерывное рецидивирующее течение заболевания без периодов ремиссии, невозможность отмены антигистаминных и других препаратов; поливалентная сенсибилизация, когда нет возможности провести тестирование in vivo сразу со всеми предполагаемыми аллергенами в ограниченные сроки обследования; резко измененная реактивность кожи (ложноположительный или ложноотрицательный результат при кожном тестировании), уртикарный дермографизм.
Основными преимуществами методов специфической аллергодиагностики in vitro являются безопасность для больного, информативность; возможность проведения исследования в случае, когда больной находится от аллерголога на большом расстоянии и в лабораторию доставлена лишь сыворотка крови; малое количество крови, необходимое для исследования.
Методы диагностики ПА in vitro
Для диагностики in vitro используются различные методы. К 1-му поколению относятся методы, направленные на регистрацию аллергенспецифических IgE-антител, циркулирующих в крови. Следует учитывать, что, поскольку продолжительность жизни свободных IgE не превышает нескольких дней, наибольшая достоверность результатов исследований in vitro достигается при анализе проб, отобранных в острой фазе AЗ.
Ко 2-му поколению относится ряд методов иммуноферментного анализа (ИФА) с использованием колориметрического, флюориметрического и хемилюминесцентного способов регистрации результатов (планшетные методы).
К 3-му поколению относится полностью автоматизированное иммуноферментное определение аллергенспецифических IgE с применением хемилюминесцентного способа регистрации результатов.
Различают следующие методы специфической диагностики in vitro при ПА:
- ИФА;
- РАСТ;
- множественный аллергосорбентный тест (МАСТ);
- САР-техника (метод ImmunoCAP от компании Phadia (Pharmacia Diagnostics), Швеция, отмечен Всемирной организацией здравоохранения как «золотой стандарт» аллергодиагностики);
- иммунохемилюминесцентный метод;
- тест антигенной стимуляции клеток (cellular allergen stimulation test, САSТ);
- тест стимуляции базофилов FAST (flow-cytometric basophil stimulation test), цитометрический вариант теста стимуляции базофилов – FLOW-САSТ;
- метод иммуноблота (основан на разделении белковых смесей в зависимости от их молекулярной массы, позволяет выявить аллергенспецифические антитела к различным белкам (аллергенам));
- реакция специфического высвобождения гистамина из базофилов периферической крови больного;
- определение уровня триптазы (фермент, выделяющийся при дегрануляции тучных клеток);
- реакция торможения миграции лейкоцитов;
- реакция бластной трансформации лейкоцитов;
- базофильный тест (тест Шелли) прямой и непрямой.
Информативность тестов in vitro зависит от возраста пациента, клинических симптомов ПА, спектра пищевых аллергенов.
Значимость уровня аллергенспецифических IgE к пищевым аллергенам
Изначально система классификации результатов уровня аллергенспецифических IgE была условной. Для сывороток крови пациентов с диагностированной аллергией было сформировано пять групп (классы от 0 до IV ) – по мере возрастания титра IgE-антител и выраженности клинических проявлений заболевания. Затем для методов ИФА была принята методика определения концентрации специфических IgE в кЕ/мл по калибровочной кривой, построенной по результатам определения общего IgE (1 кЕ/мл = 0,001 мЕ/мл). Однако не все формы специфических IgE подчиняются законам этой калибровочной кривой, поэтому большинство производителей тестов для определения специфических IgE в дополнение к общей калибровочной кривой приводят первоначальные референсные значения специфических IgE к разным аллергенам. В ряде случаев эта задача решается самой лабораторией, выполняющей исследования.
В норме уровень аллергенспецифических IgE в сыворотке крови не должен превышать 0,35 кЕ/л.
Пороговые уровни аллергенспецифических IgE к большинству пищевых аллергенов не установлены. Положительная предиктивная (прогностическая) значимость наличия аллергенспецифических IgE к пищевым аллергенам у детей раннего возраста составляет 40–60% [9].
Положительная предиктивная значимость наличия аллергенспецифических IgE для пищевых злаков составляет 60%, для сои – 37% [10, 11].
Результаты тестов in vitro можно считать информативными при содержании IgE к коровьему молоку – от 3,5 до 50кЕ/л (вероятность 90–95%), к яйцу куриному – ≥ 1,2–4 кЕ/л, арахису – ≥ 1,9–14кЕ/л (вероятность 90–95%), к пищевым злакам – ≥ 5–19,6 кЕ/л, (если менее 5 кЕ/л – отсутствие клинически значимой ПА) (отрицательная предиктивная значимость), к сое – ≥ 9,3 кЕ/л.
100%-ной положительной предиктивной значимостью у детей младше 2 лет обладают следующие уровни содержания аллергенспецифических IgE: к кровьему молоку – ≥ 5 кЕ/л, яйцу куриному – ≥ 2 кЕ/л, арахису – ≥ 4 кЕ/л [8].
Проблемы в оценке значимости результатов содержания общего IgE
Доступность и наличие отечественных и импортных тест-систем для определения IgE позволяют направлять больного на это исследование не только аллергологам-иммунологам, но и врачам других специальностей, что часто является причиной неправильной трактовки полученных результатов.
Повышенный уровень общего IgE не является однозначным маркером аллергической природы заболевания. Повышенный уровень общего IgE, даже при наличии положительного аллергологического анамнеза и клиники, не позволяет определить причину аллергии и выявить этиологически значимые аллергены.
Повышением общего IgE в сыворотке крови сопровождаются следующие заболевания:
- наличие скрытых вирусных или паразитарных инфекций (например, гельминтозы);
- некоторые формы первичных иммунодефицитов, например, гипер-IgE-синдром;
- бронхолегочный аспергиллез;
- IgE-миелома (неоплазия lgE-продуцирующих клеток);
- тимусная аплазия (синдром Ди Джорджи);
- синдром Вискотта – Олдрича и др.
Снижением уровня общего IgE в сыворотке крови сопровождаются некоторые прогрессирующие опухоли, а также атаксия-телеангиоэктазия.
Лечение ПА
Основными принципами лечения ПА являются комплексный подход и этапность в проведении терапии, направленные как на устранение симптомов аллергии, так и на профилактику обострений заболевания. Огромное значение имеет назначение адекватного рационального питания, соответствующего по объему и соотношению пищевых ингредиентов возрасту и массе тела больного и имеющимся у него сопутствующим заболеваниям, а также коррекция сопутствующих соматических заболеваний, прежде всего желудочно-кишечных (ферменты, пробиотики, энтеросорбенты и др.) [12, 13]. Особенности терапии и профилактики пищевой аллергии зависят от механизмов развития непереносимости пищевых продуктов, стадии и степени тяжести ее клинических проявлений, возраста больного, сопутствующих заболеваний и условий проживания пациента.
Лечебно-профилактические мероприятия при ПА включают следующие основные положения:
- элиминационная диета (полное исключение продукта) при ИПА;
- рациональное питание при ЛПА;
- фармакотерапия (симптоматическая терапия, базисная профилактическая терапия, лечение сопутствующих заболеваний);
- аллергенспецифическая иммунотерапия по показаниям;
- иммуномодулирующая терапия (при сочетании пищевой аллергии с иммунной недостаточностью);
- образовательные программы (обучение медицинских работников, пациентов и их родственников в аллергошколе);
- профилактика (первичная, вторичная, третичная).
При истинной ПА применяются специфические и неспецифические методы лечения. Неспецифические методы или фармакотерапия направлены на устранение симптомов развившейся реакции и на профилактику обострений. Фармакотерапия, или медикаментозная терапия, при ПА назначается в острый период заболевания для устранения симптомов развившейся реакции, а также для базисной терапии с целью профилактики развития таких реакций. Важнейшее место в лечении АЗ занимают антигистаминные препараты (АГП), основным действием которых является блокирование H₁-рецепторов на мембранах клеток различных тканей. Они стали основными в арсенале ЛС при АЗ в середине прошлого века, после того как были доказаны гетерогенность гистаминовых рецепторов и ответственность рецепторов 1-го типа за развитие симптомов аллергии.
Выделяют три основные группы АГП, применяемых при ПА. К первой группе относятся препараты, блокирующие гистаминовые рецепторы (Н₁-рецепторы), первого поколения (классические, или седативные) и препараты нового поколения (неседативные). Выделение некоторыми авторами антигистаминных препаратов 3-го поколения не является признанным в мировом сообществе аллергологов.
Во вторую группу антигистаминных препаратов входят средства, повышающие способность сыворотки крови связывать гистамин (гистаглобин, гистаглобулин и др.), назначаемые с профилактической целью. В настоящее время эти препараты применяются реже, так как для неспецифической терапии имеются не содержащие белок медикаменты, реже приводящие к развитию побочных эффектов.
К третьей группе относятся препараты, тормозящие высвобождение гистамина из тучных клеток, такие как кетотифен, кромолин-натрий и др.
К АГП первого поколения относятся хлорфенирамин, бромфенирамин, дифенгидрамин, прометазин, трипролидин, гидроксизин, азетидин и др.
К АГП второго поколения относятся акривастин, азеластин, цетиризин, дезлоратадин, фексофенадин, левоцетиризин, лоратадин, мизоластин, рупатадин. Особое место занимают производные хинуклидина (разработаны в лаборатории М.Д. Машковского) – хифенадин и сехифенадин, – которые сочетают свойства АГП первого и второго поколений.
Согласно последним международным рекомендациям Всемирной организации по борьбе с аллергией (World Allergy Organization, WAO) 2011–2012 гг. [14], для лечения аллергических реакций рекомендованы АГП второго поколения, поскольку они не оказывают значимого седативного, антихолинергического и кардиотоксического действия.
В настоящее время на фармацевтическом рынке России появился новый АГП – рупатадин – пример полифункционального противоаллергического лекарственного средства. Рупатадин представляет соединение блокатора Н₁-гистаминового рецептора нового поколения и антагониста фактора активации тромбоцитов (PAF-антагонист). Препарат одинаково активно влияет как на раннюю, так и на позднюю стадии аллергической реакции, обеспечивая длительный клинический эффект.
Рупатадин в дозе 10 мг в сутки допускается принимать одновременно с азитромицином, флуоксетином и лоразепамом; во время лечения рупатадином допускается прием алкогольных напитков. Препарат не оказывает значимого негативного влияния на когнитивные или психомоторные функции (включая способность к вождению автомобиля). В ходе клинических и доклинических исследований не выявлено нежелательного действия рупатадина на сердечно-сосудистую систему.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.