Особенности развития синдрома сухого глаза у пациентов с подагрой
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Обследовано 149 пациентов (261 глаз) мужского пола в возрасте от 35 до 75 лет (средний возраст 60,6 ± 11,0 года), из них 110 (202 глаза) с установленным диагнозом «катаракта с сопутствующим заболеванием – подагрой» и 39 (59 глаз) пациентов с катарактой без клинико-лабораторных признаков подагры. Всем пациентам были проведены как стандартные, так и специальные офтальмологические исследования. Концентрацию мочевой кислоты в слезе определяли методом высокоэффективной жидкостной хроматографии. Диагноз подагры подтвержден на основании критериев Американского колледжа ревматологов и Европейской лиги по борьбе с ревматизмом (ACR/EULAR) (2016).
Результаты. Показано, что у пациентов с подагрой, не принимающих уратснижающего препарата, ССГ встречается чаще (82,1%), чем у пациентов без подагры (23,1%). С увеличением концентрации мочевой кислоты в слезе наблюдается тенденция к сокращению времени разрыва слезной пленки (сильный коэффициент корреляции r = -0,51; p < 0,001) и снижению слезопродукции (проба Ширмера I) (сильный коэффициент корреляции r = -0,59; p < 0,001).
Выводы. Полученные результаты свидетельствуют о значительных изменениях функциональных показателей суммарной слезопродукции и стабильности прероговичной слезной пленки у пациентов с подагрой, что позволяет говорить о предрасположенности данной категории пациентов к развитию ССГ. Установлена сильная зависимость изменений слезопродукции и времени разрыва слезной пленки от концентрации мочевой кислоты в слезе. Необходимы дополнительное обследование пациентов с подагрой, адекватный выбор терапии, а также своевременное назначение препаратов искусственной слезы.
Материал и методы. Обследовано 149 пациентов (261 глаз) мужского пола в возрасте от 35 до 75 лет (средний возраст 60,6 ± 11,0 года), из них 110 (202 глаза) с установленным диагнозом «катаракта с сопутствующим заболеванием – подагрой» и 39 (59 глаз) пациентов с катарактой без клинико-лабораторных признаков подагры. Всем пациентам были проведены как стандартные, так и специальные офтальмологические исследования. Концентрацию мочевой кислоты в слезе определяли методом высокоэффективной жидкостной хроматографии. Диагноз подагры подтвержден на основании критериев Американского колледжа ревматологов и Европейской лиги по борьбе с ревматизмом (ACR/EULAR) (2016).
Результаты. Показано, что у пациентов с подагрой, не принимающих уратснижающего препарата, ССГ встречается чаще (82,1%), чем у пациентов без подагры (23,1%). С увеличением концентрации мочевой кислоты в слезе наблюдается тенденция к сокращению времени разрыва слезной пленки (сильный коэффициент корреляции r = -0,51; p < 0,001) и снижению слезопродукции (проба Ширмера I) (сильный коэффициент корреляции r = -0,59; p < 0,001).
Выводы. Полученные результаты свидетельствуют о значительных изменениях функциональных показателей суммарной слезопродукции и стабильности прероговичной слезной пленки у пациентов с подагрой, что позволяет говорить о предрасположенности данной категории пациентов к развитию ССГ. Установлена сильная зависимость изменений слезопродукции и времени разрыва слезной пленки от концентрации мочевой кислоты в слезе. Необходимы дополнительное обследование пациентов с подагрой, адекватный выбор терапии, а также своевременное назначение препаратов искусственной слезы.




Введение
Подагра представляет собой системное заболевание, развивающееся вследствие нарушения пуринового обмена, что приводит к повышению содержания мочевой кислоты (МК) в сыворотке крови (гиперурикемии) [1–4].
По данным ряда авторов, сегодня в мире наблюдается неуклонный рост заболеваемости подагрой [5–8]. Основными причинами роста заболеваемости в Российской Федерации, равно как и в большинстве стран мира, являются высокая распространенность факторов риска развития подагры и изменение образа жизни населения [5, 8–11].
В силу многообразия клинических проявлений подагра вызывает все больший интерес у исследователей.
В настоящее время благодаря достижениям современной биохимии доказана роль нарушений обмена пуринов как в патогенезе, так и в этиологии ряда заболеваний, развитие и прогрессирование которых ранее не рассматривалось во взаимосвязи с дефектами мочекислого обмена [12].
В эпидемиологических исследованиях достоверно установлено повышение уровня МК в сыворотке крови у 5–12% населения разных регионов и стран [13]. Так, в США гиперурикемия выявлена у 2% взрослого населения, во Франции – у 17%, в Испании – у 7%, России – у 19,3% населения [14, 15].
В последние годы наблюдается особый интерес к изучению риска развития офтальмологических патологий при повышенной концентрации МК в организме.
Так, S.E. Moss и соавт. (2000) в проспективном когортном исследовании отмечали высокую частоту развития синдрома сухого глаза (ССГ) у пациентов с нелеченой подагрой в анамнезе, что предполагало у них высокий уровень МК в сыворотке крови [16].
Таким образом, необходимо более внимательно подходить к вопросу изучения обмена МК и его нарушений при различных заболеваниях. Наше исследование было посвящено оценке роли нарушений обмена МК при офтальмологических патологиях у пациентов с подагрой.
Цель – определить и изучить особенности развития ССГ при подагре в зависимости от уратснижающей терапии, длительности заболевания подагрой и концентрации МК в слезе.
Материал и методы
В период с 2017 по 2020 г. было обследовано 149 пациентов (261 глаз) мужского пола в возрасте от 35 до 75 лет (средний возраст – 60,6 ± 11,0 года), из них 110 (202 глаза) с установленным диагнозом «катаракта с сопутствующим заболеванием – подагрой» и 39 пациентов (59 глаз) с катарактой без клинико-лабораторных признаков подагры.
Все пациенты были разделены на две группы. Первую (контрольную) группу составили 39 пациентов с катарактой без подагры. Во вторую (основную) группу вошли 110 пациентов с сопутствующим заболеванием – подагрой, которые были распределены на шесть подгрупп: три подгруппы в зависимости от особенностей режима приема уратснижающего препарата Аллопуринола (подгруппа А – 35 пациентов, регулярно принимавших Аллопуринол; подгруппа Б – 36 пациентов, нерегулярно принимавших Аллопуринол; подгруппа В – 39 пациентов, не получавших уратснижающего препарата) и три подгруппы в зависимости от длительности заболевания подагрой, которая соответствовала продолжительности приема уратснижающего препарата Аллопуринола (подгруппа Г – 35 пациентов с длительностью заболевания подагрой 1–5 лет; подгруппа Д – 37 пациентов с длительностью заболевания подагрой 6–10 лет; подгруппа Е – 38 пациентов с длительностью заболевания подагрой более десяти лет).
Всем пациентам были проведены как стандартные, так и специальные офтальмологические исследования. Концентрацию МК в слезе определяли методом высокоэффективной жидкостной хроматографии. Диагноз подагры подтверждали на основании критериев Американского колледжа ревматологов и Европейской лиги по борьбе с ревматизмом (ACR/EULAR) (2016) [17]. При статистическом анализе результатов использовали пакет прикладных программ математической статистики IBM SPSS Statistics 20.0 (США).
Результаты и обсуждение
В таблице 1 представлены результаты статистического анализа сравнения показателей концентрации МК в различных средах. Целью данного анализа стало подтверждение статистически значимых различий между группами. При статистическом сравнении использовали непараметрический критерий Краскела – Уоллиса.
Как видно из табл. 1, показатели концентрации МК в крови статистически значимо различаются между четырьмя сравниваемыми группами (p < 0,05).
Таким образом, у пациентов с подагрой, не принимавших уратснижающего препарата (подгруппа В), отмечались самые высокие показатели концентрации МК в крови – 735,95 ± 112,57 мкмоль/л, что в три раза превышало аналогичный показатель у пациентов без подагры (контрольная группа) – 282,72 ± 43,38 мкмоль/л и почти в два – у пациентов с подагрой, регулярно получавших уратснижающий препарат (подгруппа А) (р < 0,005).
Показатели концентрации МК в слезе статистически значимо различались между собой во всех группах (p < 0,05). Самые высокие концентрации МК в слезе выявлены у пациентов с подагрой, не принимавших уратснижающего препарата (подгруппа В), – 28,60 ± 1,25 мкг/мл и пациентов с подагрой, нерегулярно получавших такой препарат (подгруппа Б), – 27,09 ± 1,10 мкг/мл по сравнению с другими группами (р < 0,005).
При статистическом анализе результатов концентрации МК в различных средах в зависимости от длительности заболевания подагрой обнаружены статистически значимые различия между всеми подгруппами основной группы и контрольной группой (df = 3; p < 0,0001) (табл. 2).
Установлено статистически значимое повышение концентрации МК в крови и слезе у пациентов с длительностью заболевания подагрой 1–5 лет (подгруппа Г), более десяти лет (подгруппа Е) и 6–10 лет (подгруппа Д) по сравнению с пациентами без подагры (контрольная группа) (p < 0,0001). Статистически значимых различий между результатами концентрации МК в разных средах у пациентов с длительностью заболевания подагрой более десяти лет (подгруппа Е) и пациентов с длительностью заболевания подагрой 6–10 лет (подгруппа Д) и 1–5 лет (подгруппа Г) не установлено (р > 0,05) (табл. 2).
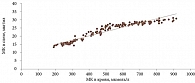
Для оценки связи между результатами концентрации МК в крови и показателями МК в слезе был проведен корреляционный анализ. Его результаты продемонстрировали тесную связь между данными показателями. Так, с увеличением концентрации МК в крови отмечалась тенденция к увеличению концентрации МК в слезе (сильный коэффициент корреляции r = 0,97; p < 0,001) (рис. 1).
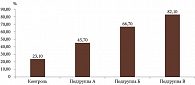
Показатели частоты встречаемости ССГ статистически значимо различались между всеми подгруппами основной группы и контрольной группой (χ2 = 31,4159; df = 3; p < 0,0001) (табл. 3). Наибольшие статистические различия зафиксированы между контрольной группой и подгруппой В основной группы (на 59,0%; p < 0,0001), между подгруппами А и В (на 36,4%; p = 0,0011) и контрольной группой и подгруппой Б основной группы (на 43,6%; p = 0,0001) (рис. 2).
Таким образом, установлено статистически значимое увеличение встречаемости ССГ у пациентов с подагрой (подгруппы А, Б, В основной группы) по сравнению с пациентами без подагры (контрольная группа) (p < 0,0001). Как показано на рис. 2, ССГ чаще отмечался у пациентов с подагрой, не принимавших уратснижающего препарата (подгруппа В), – 82,1%, что статистически в четыре раза выше, чем у пациентов без подагры (контрольная группа) – 23,1% (p < 0,0001). Частота встречаемости ССГ у пациентов с подагрой, нерегулярно принимавших уратснижающий препарат (подгруппа Б), составила 66,7%, что в три раза превысило показатель у пациентов без подагры (контрольная группа) – 23,1% (p < 0,0001). Между частотой встречаемости ССГ у пациентов с подагрой, нерегулярно принимавших уратснижающий препарат (подгруппа Б), и пациентов с подагрой, не получавших уратснижающего препарата (подгруппа В), статистически значимые различия не зафиксированы (р = 0,1259).
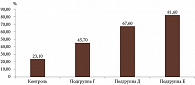
Статистически значимые различия между частотой встречаемости ССГ в зависимости от длительности заболевания подагрой установлены между всеми подгруппами основной группы и контрольной группой (χ2 = 29,3714; df = 3; p < 0,0001) (табл. 4, рис. 3).
Наибольшие статистические различия наблюдались между контрольной группой и подгруппой Е (p < 0,0001), контрольной группой и подгруппой Г (p = 0,0403), контрольной группой и подгруппой Д (p = 0,0005) и между подгруппами Г и Е (p = 0,0034) (табл. 4, рис. 3).
Установлено статистически значимое увеличение частоты встречаемости ССГ у пациентов с длительностью заболевания подагрой более десяти лет (подгруппа Е) – 81,6% по сравнению с пациентами без подагры (контрольная группа) – 23,1% (p < 0,0001) и пациентами с длительностью заболевания подагрой 1–5 лет (подгруппа Г) – 45,7% (p = 0,0034). Статистически значимых различий между частотой встречаемости ССГ у пациентов с длительностью заболевания подагрой более десяти лет (подгруппа Е) – 81,6% и пациентов с длительностью заболевания подагрой 6–10 лет (подгруппа Д) – 67,6% не зарегистрировано (р = 0,1663).
Результаты функциональных проб у пациентов с подагрой (подгруппы А, Б, В) статистически значимо отличались от показателей пациентов без подагры (контрольная группа). Отмечались укорочение времени разрыва слезной пленки (ВРСП) (проба Норна) и снижение показателя суммарной слезопродукции (проба Ширмера I) у пациентов с подагрой (подгруппы А, Б, В) в отличие от таковых у лиц без подагры (контрольная группа) (табл. 5).
Как видно из табл. 5, все показатели статистически значимо различаются между сравниваемыми подгруппами основной группы и контрольной группой (p < 0,0001).
Наиболее статистически значимые различия по показателю «проба Норна» обнаружены между контрольной группой (9,46 ± 2,43 с; 9,00 (8,00; 11,00)) и подгруппой В основной группы (пациенты с подагрой, не принимавшие утратснижающего препарата) (6,33 ± 1,68 с; 6,00 (5,00; 7,00)) (p < 0,0001); между подгруппой А (пациенты с подагрой, регулярно принимавшие уратснижающий препарат) (8,42 ± 1,63 с; 9,00 (7,00; 10,00)) и подгруппой В (пациенты с подагрой, не принимавшие утратснижающего препарата) (6,33 ± 1,68 с; 6,00 (5,00; 7,00)) (p < 0,0001); между подгруппой А (пациенты с подагрой, регулярно принимавшие уратснижающий препарат) (8,42 ± 1,63 с; 9,00 (7,00; 10,00)) и подгруппой Б (пациенты с подагрой, нерегулярно получавшие уратснижающий препарат) (7,50 ± 2,29 с; 7,00 (6,00; 9,00)) (р = 0,0114).
Для показателя «проба Ширмера I» наиболее статистически значимые различия выявлены между контрольной группой (пациенты без подагры) (11,23 ± 3,09 мм; 10,00 (9,00; 12,00)) и подгруппой В (пациенты с подагрой, не принимавшие уратснижающего препарата) (7,08 ± 2,06 мм; 7,00 (5,00; 8,00)) (p < 0,0001); между контрольной группой (11,23 ± 3,09 мм; 10,00 (9,00; 12,00)) и подгруппой Б (пациенты с подагрой, нерегулярно получавшие уратснижающий препарат) (8,56 ± 3,30 мм; 9,00 (6,00; 9,00)) (р = 0,0103); между подгруппой А (пациенты с подагрой, регулярно получавшие уратснижающий препарат) (9,58 ± 1,66 мм; 10,00 (8,00; 10,00)) и подгруппой В (пациенты с подагрой, не принимавшие уратснижающего препарата) (7,08 ± 2,06 мм; 7,00 (5,00; 8,00)) (p < 0,0001); между подгруппой А (пациенты с подагрой, регулярно получавшие уратснижающий препарат) (9,58 ± 1,66 мм; 10,00 (8,00; 10,00)) и подгруппой Б (пациенты с подагрой, нерегулярно принимавшие уратснижающий препарат) (8,56 ± 3,30 мм; 9,00 (6,00; 9,00)) (р = 0,0155).
Для оценки связи возраста пациентов с результатами функциональных проб был проведен корреляционный анализ этих показателей. С увеличением возраста пациентов во всех группах отмечалась тенденция к уменьшению ВРСП (слабый коэффициент корреляции r = -0,3; p < 0,001). Аналогичная тенденция наблюдалась при использовании пробы Ширмера I (слабый коэффициент корреляции между результатами теста и возрастом обследуемых r = -0,31).
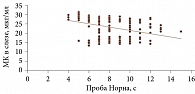
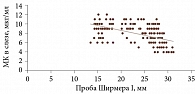
Для оценки связи результатов функциональных проб с концентрацией МК в слезе был проведен корреляционный анализ. Его результаты показали наличие значимой отрицательной взаимосвязи между данными показателями. Так, с увеличением концентрации МК в слезе имела место тенденция к укорочению ВРСП (сильный коэффициент корреляции r = -0,51; p < 0,001) и снижению слезопродукции (проба Ширмера I) (сильный коэффициент корреляции r = -0,59; p < 0,001) (рис. 4 и 5).
Выводы
На основании полученных результатов можно сделать следующие выводы.
- У пациентов с подагрой, не принимающих уратснижающего препарата, ССГ встречается чаще (82,1%), чем у пациентов без подагры (23,1%) и пациентов с подагрой, регулярно получающих уратснижающий препарат (45,7).
- Увеличение частоты встречаемости ССГ наблюдается при длительности заболевания подагрой 6–10 лет – 67,6% и свыше десяти лет – 81,6%.
- С увеличением концентрации МК в крови отмечается тенденция к увеличению концентрации МК в слезе (сильный коэффициент корреляции r = 0,97; p < 0,001).
- С увеличением концентрации МК в слезе наблюдается тенденция к укорочению ВРСП (сильный коэффициент корреляции r = -0,51; p < 0,001) и снижению слезопродукции (проба Ширмера I) (сильный коэффициент корреляции r = -0,59; p < 0,001).
Авторы заявляют об отсутствии конфликта интересов.
K.N. Odinayeva, M.A. Frolov, PhD, Prof., N.S. Al Khateeb, Z.Sh. Rustamova
Russian University of Peoples' Friendship Medical Institute of FSAEIO HE
Department of Eye Diseases of Russian University of Peoples' Friendship
Contact person: Kibriyo N. Odinayeva, kima.med-91@mail.ru
Purpose – to determine and study the features of the development of dry eye syndrome (DES) in gout, depending on urate-lowering therapy, the duration of the gout disease and the concentration of uric acid in the tear.
Material and methods. The study involved 149 male patients (261 eyes) aged 35 to 75 years (mean age 60.63 ± 11.00 years). Among them, 110 people (202 eyes) with an established diagnosis 'cataract with concomitant gout disease' and 39 people (59 eyes) with cataracts without clinical and laboratory signs of gout. All patients underwent both standard ophthalmological examinations and special ones. The concentration of uric acid in tears was determined by high performance liquid chromatography. The diagnosis of gout was confirmed according to the criteria recommended by ACR/EULAR (2016).
Results. In patients with gout who do not take a urate-lowering drug, DES occurs more often (82.1%) than in patients without gout (23.1%). With an increase in the concentration of uric acid in the tear, there is a high tendency to a shortening of the tear film rupture time (strong correlation coefficient r = -0.51; p < 0.001) and to a decrease in tear production (Schirmer's I test) (strong correlation coefficient r = -0.59; p < 0.001).
Conclusions. The data obtained indicate clear changes in the functional parameters of total tear production (Schirmer's I test) and the stability of the pre-corneal tear film (Norn's test) in patients with gout. This can be considered as a fact of the predisposition of this category of patients to the development of DES. A strong dependence of changes in tear production and HRVP on the concentration of uric acid in the tear was established. There is an obvious need for additional examination of this category of patients and an adequate choice of therapy, as well as the timely appointment of 'artificial tear' drugs.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.