количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Остеопороз недостаточно диагностируется, недостаточно лечится
Эффективная фармакотерапия. Эндокринология. СПЕЦВЫПУСК № 2.
- Аннотация
- Статья
- Ссылки
В последние годы клиническая медицина добилась серьезных успехов в области диагностики и лечения остеопороза. Хорошо очерчены факторы риска, что позволяет проводить грамотные профилактические мероприятия. Между тем число людей, знающих о возможности такой профилактики и лечебной тактики при выявлении риска заболевания, невелико даже среди медицинских работников, что подтверждено данными проведенного авторами клинического исследования. В этой связи актуальным представляется вопрос информированности практических врачей о современных способах диагностики и лечения остеопороза для предотвращения самого серьезного его осложнения – остеопоротических переломов.
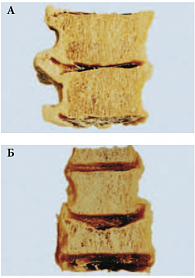
Рис. 1. Остеопороз позвоночника: а) нормальная кость, б) кость при остеопорозе

Таблица. Структура костной ткани
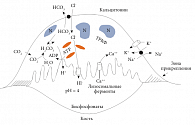
Рис. 2. Модель структуры и активации остеокластов в процессе костной резорбции
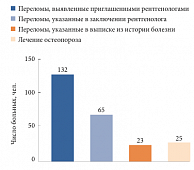
Рис. 3. Результаты рентгенографии позвоночника у женщин старше 60 лет (n = 903)
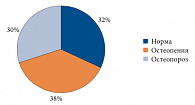
Рис. 4. Частота остеопенического синдрома по результатам DЕXA
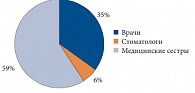
Рис. 5. Уровень медицинского образования включенных в исследование
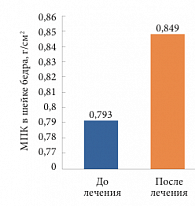
Рис. 6. Динамика минеральной плотности кости (МПК) поясничного отдела позвоночника
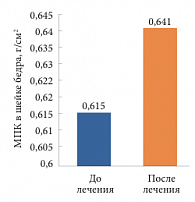
Рис. 7. Динамика минеральной плотности кости (МПК) в шейке бедра
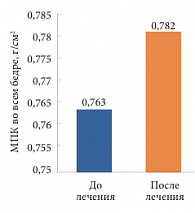
Рис. 8. Динамика минеральной плотности кости (МПК) во всем бедре
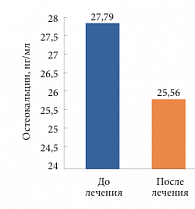
Рис. 9. Динамика уровня остеокальцина
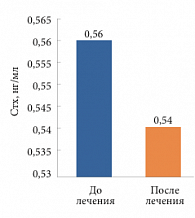
Рис. 10. Динамика уровня С-терминального телопептида (Стх)
Введение
Актуальность проблемы ОП в современной медицине вызвана, прежде всего, социальными и экономическими последствиями остеопоротических переломов. При этом в перспективе проблема ОП станет еще более серьезной и глобальной, поскольку в современном обществе наблюдается увеличение продолжительности жизни и всеобщее старение населения (к 2020 г. прогнозируется удвоение числа жителей старше 50 лет).
Большую часть людей, подверженных ОП, составляют женщины. В течение первых 5 лет после наступления менопаузы потеря костной массы у женщины может составить до 1/3 от общей массы костей, утраченной за всю жизнь. Потеря костной массы, возникающая после менопаузы, повышает у женщин риск развития ОП и связанных с ним переломов. При денситометрическом обследовании лиц в возрасте 50 лет и старше в соответствии с критериями Всемирной организации здравоохранения (ВОЗ) ОП в России выявляется у каждой третьей женщины [1]. Аналогичные показатели распространенности ОП у женщин отмечены среди белого населения Северной Америки и ряда стран Европы [2].
Так, для 50-летней женщины риск перелома позвоночника составляет в среднем 15,5%, шейки бедра – 17,5%, костей запястья – 16,0%, а любого из трех участков скелета – 39,7%. В 1997–2000 гг. проведен ряд эпидемиологических исследований среди женского населения Московской области старше 45 лет [3, 4]. Результаты рентгенологического исследования позвоночника показали: 36% обследованных имели компрессионные переломы позвонков (рис. 1). По данным денситометрии, ОП позвоночника был обнаружен у 26% женщин в постменопаузе, ОП шейки бедра – у 12%, остеопения – у каждой второй женщины.
ОП в постменопаузе отмечается почти у 30% женщин, а остеопения – у 54%, что предопределяет уязвимость последних в отношении развития остеопороза и остеопоротических переломов. Так, 50% женщин старше 50 лет в течение своей последующей жизни переносят остеопоротический перелом. Переломы тел позвонков являются наиболее частым осложнением ОП, составляя около половины всех переломов. Такие переломы вызывают острые или хронические боли в спине, приводят к снижению роста, нарушению осанки.
Остеопороз – это основная причина переломов шейки бедра, часто встречающихся у женщин старше 65 лет. У лиц пожилого возраста 90% переломов шейки бедра, как показали международные исследования, происходят на фоне ОП. К сожалению, наметилась четкая тенденция к увеличению частоты переломов шейки бедра на фоне ОП и в возрастной группе 40–60 лет. Риск переломов данной локализации достигает 15%, что приближается к уровню заболеваемости раком молочной железы, яичников и эндометрия, вместе взятых. Последствия переломов шейки бедра катастрофические – 20% больных погибают в течение полугода, причем еще в стационаре смертность составляет 3% для женщин и 8% для мужчин, у половины выживших после перелома бедра снижается качество жизни, а треть нуждается в длительном уходе и теряет способность к самообслуживанию. Цена на лечение остеопоротических переломов в развитых странах приблизительно одинакова, но существенно отличается от стоимости лечения в России. Так, стоимость года лечения перелома бедра с включением госпитального периода и последующей реабилитации в Бельгии составляет 15 тыс. евро, в Великобритании – 12 тыс. фунтов стерлингов, в Канаде – 26,5 тыс. канадских долларов. Стоимость только стационарного лечения пациентов с переломами бедра в 2000 г. (Ярославль) составила 1 166 765 рублей в год [5].
По данным ВОЗ, именно переломы проксимального отдела бедренной кости ставят ОП на 4-е место среди всех причин инвалидности и смертности. В России смертность при переломах шейки бедренной кости, как показали эпидемиологические исследования, колеблется в зависимости от региона в дипазоне 19,7–55%. Риск переломов в дальнейшем возрастает, если пациент пережил один остеопоротический перелом. Так, если пациент старше 65 лет перенес перелом позвоночника, риск перелома бедра или верхней части бедра в течение пяти лет составляет 6,7% и 13,3% соответственно, после первого перелома позвонка риск другого перелома возрастает в 4–7 раз [6].
Химический состав кости и клеточное строение
Кость является одной из особых форм соединительной ткани, составляющей вместе с хрящевой тканью скелет организма. Кость состоит из коллагенового матрикса, который минерализован включениями кристаллов фосфата кальция. Такой состав ткани придает скелету прочность и силу, при этом сохраняя свойства эластичности. Скелет человека состоит более чем из двухсот костей. Известно, что масса всех костей скелета составляет около 1/5 массы тела.
Основными функциями костной ткани являются:
механическая (основа опорно-двигательного аппарата);
защитная (гемопоэтическая, иммунная, защита внутренних органов);
метаболическая (депо кальция и фосфора, их гомеостаз в крови).
Существуют два морфологических вида кости: кортикальная, или компактная (80% от общей костной массы), и трабекулярная (губчатая) (20%). Метаболические процессы в этих тканях протекают с разной скоростью – более активны в трабекулярной, нежели кортикальной, костной ткани. Кроме того, масса губчатого вещества в 4 раза меньше, чем компактного, но общая поверхность в 9,4 раза выше. Именно поэтому нарушения минерального обмена обнаруживаются раньше именно в губчатой кости и потеря ее массы происходит в 5 раз быстрее по сравнению с кортикальной. Структурные особенности костной ткани определяют функциональные различия. Так, кортикальная кость выполняет механическую и защитную функцию, а трабекулярная – метаболическую. В таблице представлена структура костной ткани. В состав костной ткани входит костный матрикс (межклеточное вещество), минеральный компонент и клеточные элементы. Костные пластинки компактного и губчатого вещества образуют матрикс кости.
Основным минеральным компонентом кости является гидроксиапатит (Са10(РО4)6(ОН)2), образующийся из аморфного фосфата кальция и соединяющийся с молекулами коллагена посредством неколлагеновых протеинов матрикса. Гидроксиапатит не единственная форма ассоциации кальция и фосфора в костной ткани. Кость содержит окта-, ди-, трикальций фосфаты, аморфный фосфат кальция. Кроме этого, в состав неорганического матрикса входят бикарбонаты, цитраты, фториды, соли Mg, K, Na и др.
Органический матрикс образуют коллаген 1-го типа и неколлагеновые матриксные протеины. От правильного набора матриксных белков зависит нормальное отложение кристаллов гидроксиапатита.
К матриксным белкам, имеющим важное значение в процессах минерализации кости, относятся:
- белки, осуществляющие адгезию клеток (фибронектин, тромбоспондин, остеопонтин, костный сиалопротеин) и способные интенсивно связываться с кальцием и участвовать в минерализации кости;
- гликопротеины (щелочная фосфатаза, остеонектин, BAG-75);
- протеогликаны (кислые полисахариды и гликозаминогликаны);
- белки, содержащие гамма-карбоксиглутаминовую кислоту (гамма-карбоксилированные (gla)) (остеокальцин, gla-протеин матрикса);
- факторы роста (фактор роста фибробластов, трансформирующие факторы роста, костные морфогенетические белки).
Коллаген 1-го типа – основной белок, составляющий 90–95% органического матрикса кости. Он синтезируется остеобластами в виде предшественника проколлагена 1-го типа, который представляет собой большую молекулу, содержащую с К- и А-концов частично глобулярные фрагменты, отделяющиеся от основной молекулы с помощью специфических пептидаз после выброса проколлагена из клетки. Костный коллаген характеризуется уникальными внутримолекулярными и межмолекулярными соединениями между остатками лизина, которые образуют метаболически стабильные пиридинолин и деоксипиридинолин. Пиридинолины, особенно деоксипиридинолин, являются специфическими продуктами деградации костной ткани, которые постоянно обеспечивают наилучшие биохимические параметры костной резорбции. Практически все минеральные вещества, присутствующие в костной ткани, концентрируются внутри коллагеновых фибрилл.
Наряду с органическим матриксом костная ткань содержит специфические и неспецифические пулы клеток. Специфическими клетками кости являются остеобласты, остеокласты и остеоциты. Неспецифические костные клетки представлены моноцитами и фибробластами.
Термин «остеобласт» был предложен в 1864 г. германским анатомом Карлом Гегенбауэром (Karl Gegenbaur). Остеобласты представляют собой крупные клетки с базофильной цитоплазмой и относительно большими расположенными эксцентрично овальными ядрами, имеющими кубическую или призматическую форму. Дифференцировка остеобластов из клеток-предшественников занимает 60 часов и является сложным процессом, который стимулируется паратиреоидным гормоном (ПТГ), гормонами щитовидной железы, соматотропным гормоном (СТГ). Основной функцией остеобластов является продукция костного матрикса и его последующая минерализация. Остеобласты синтезируют подавляющее большинство компонентов органического костного матрикса – коллаген 1-го типа, остеокальцин, костный сиалопротеин, остеопонтин, трансформирующие факторы роста, остеонектин, коллагеназу и др. Для них также характерен синтез щелочной фосфатазы.
Важной функцией остеобластов является регуляция развития, дифференцировки и функционирования остеокластов. Так, остеобласты секретируют фактор дифференцировки остеокластов RANKL (receptor activation of NF-kappa-ligand). RANKL является трансмембранным лигандом, экспрессированным на поверхности остеобластов, связывается с RANK-рецептором, экспрессированным на клетках – предшественниках остеокластов из линии «моноциты – макрофаги». В дальнейшем индуцируется процесс дифференцировки и формирования остеокластов. Остеобластам принадлежит ведущая роль в минерализации органической основы костного матрикса.
Еще один тип специфических костных клеток представлен остеокластами, которые резорбируют костную ткань (рис. 2). Остеокласты – это подвижные крупные (20–180 мкм) многоядерные (5–20), до конца дифференцированные клетки гемопоэтической природы. На рисунке показаны следующие структуры: ядра, митохондрии, углеродная ангидраза (гидратация СО2), кальциевые и хлоридные каналы, секреция лизосомальных ферментов, Н+- и К+-АТФазы, рецепторы к кальцитонину, зона прикрепления и так называемый гофрированный край.
Остеокласты могут находиться в активном и неактивном состоянии. В активном состоянии остеокласты поляризуются и характеризуются появлением гофрированного края. Остеокласты растворяют как минеральные, так и органические компоненты матрикса. Костный распад начинается со стороны гофрированного края, который помимо протонов выделяет гидролитические ферменты. Зрелые остеокласты прикрепляются к поверхности кости гофрированным краем. Гофрированный край – это скрученная спиралью мембрана с множественными цитоплазматическими складками, являющаяся зоной активной резорбции.
Секретируемые зрелыми остеокластами и накапливаемые в резорбируемом пространстве ферменты в условиях кислой среды и образования свободных радикалов обеспечивают растворение кристаллов костного матрикса. Скорость резорбции костной ткани одним остеокластом колеблется от 103 до 203 мкм2 в сутки. Один остеокласт разрушает столько кости, сколько создали за то же время 100 остеобластов.
Маркерами остеокластов являются карбоангидраза и тартрат-резистентная кислая фосфатаза (ТРКФ), которая находится на костной поверхности, обращенной к гофрированному краю. Важным фенотипическим проявлением остеокластов является экспрессия рецепторов к кальцитонину.
Другими клетками – производными остеобластов являются остеоциты. Это клетки, неспособные к делению. По мере старения остеобласт, утративший свою синтетическую активность и окруженный основным веществом кости, превращается в остеоцит, расположенный в костной лакуне. Это звездообразные, многоядерные плоские клетки, которые распределены по всему основному веществу. Остеоциты выполняют несколько функций, включая обеспечение внутрикостного транспорта питательных веществ, регуляцию минерализации кости, остеоцитический остеолиз, костное формирование и ответ на механические воздействия. Остеоциты поддерживают структурную целостность минерализованного матрикса и участвуют в регуляции кальциевого обмена. Также эти клетки являются посредниками передачи сигналов, регулирующих костную резорбцию, и участвуют в заживлении микропереломов. Зрелые остеоциты играют роль в костно-минеральном транспорте.
Остеоциты расположены оптимально для того, чтобы воспринимать любые изменения упругого напряжения костной ткани и, трансформируя механические стимулы в биохимические сигналы, инициировать процессы ремоделирования в определенном ее локусе.
Регуляция процесса ремоделирования кости
Костная ткань представляет собой активную динамическую систему, в которой постоянно происходят процессы резорбции старой кости и образования новой. Эти процессы составляют цикл костного ремоделирования, который начинается еще в утробе матери и продолжается в течение всей жизни человека. Известно, что у человека ежегодно обновляется около 25% губчатой и 3% кортикальной кости. Цикл костного ремоделирования представляет собой смену последовательных и взаимосвязанных процессов: активация, резорбция, реверсия, формирование, покой.
Фаза активации (2–3 недели). Ремоделирование костной ткани начинается с фазы активации, осуществляемой в процессе остеокластогенеза. В этот период наблюдается пролиферация и активация предшественников остеокластов, формирование зрелых остеокластов и их прикрепление к зонам будущей резорбции.
Фаза резорбции. Процесс костной резорбции продолжается около 2 недель. Остеокласт прикрепляется к костной поверхности с помощью адгезивных гликопротеидов-интегринов. В дальнейшем остеокласт формирует гофрированный край и светлую зону, изолируя пространство под собой. В образованное замкнутое пространство поступают протеолитические, лизосомальные ферменты, ионы водорода, и происходит активная резорбция кости. Скорость резорбции кости остеокластами составляет около 20–50 мкм/день.
Фаза реверсии (1–2 недели). Во время фазы реверсии в лакуны мигрируют преостеобласты, которые в дальнейшем дифференцируются в остеобласты. Наблюдается активация остеобластов, их усиленное деление, и образуется цементирующая линия, которая в дальнейшем соединит старую и вновь образованную кость.
Фаза формирования (3 месяца). Заключительной фазой цикла костного ремоделирования является образование новой кости. Фаза формирования продолжается до полного замещения резорбционной лакуны, пока полностью не сформируется новая костная структурная единица. Остеобласты активно секретируют коллаген, неколлагеновые протеины – компоненты нового костного матрикса со скоростью 2–3 мкм в день. С возрастом снижается количество матрикса, продуцируемого остеобластами. Финальным процессом является минерализация матрикса, которая заканчивается спустя несколько недель. В процессе минерализации часть остеобластов превращается в остеоциты.
Таким образом, все процессы костеобразования являются результатом тесного клеточного взаимодействия остеобластов и остеокластов. В целом продолжительность цикла костного ремоделирования с формированием минерализованной структурной единицы костной ткани составляет от 3 до 5 месяцев. Постоянные процессы обновления костной ткани позволяют удалять микротравмы и микротрещины.
Полагают, что ежегодно перестраивается от 2–4% до 10% костной массы. Следовательно, за 10–20 лет обновляется практически весь скелет.
С возрастом цикл костного ремоделирования характеризуется более высокой скоростью костной резорбции по сравнению с процессом формирования кости, что отражает состояние негативного кальциевого баланса и потерю костной массы. Ежедневно около 330 мг кальция выделяется из костей как результат деятельности остеокластов, в то же самое время 300 мг поступает в кости под влиянием остеобластов. Таким образом, негативный кальциевый баланс составляет 30 мг/сут. Все люди начинают терять костную массу с конца третьего десятилетия жизни. В начале эта потеря незначительна – 0,3–0,5% в год. При наступлении периода постменопаузы у женщин процесс потери костной массы резко ускоряется, достигая 2–3% в год. Так продолжается до возраста 65–70 лет, после чего скорость вновь снижается до 0,3–0,5% в год.
Костное ремоделирование осуществляется под влиянием паратирина, кальцитонина, D-гормона. Наряду с ними активное влияние на процессы костной резобции и формирования оказывают половые гормоны, глюкокортикоиды, а также СТГ, инсулин. К активным модуляторам процессов ремоделирования относится большое количество цитокинов и других паракринных факторов, которые секретируются костными и близкими к ним клетками. Интерлейкин (ИЛ) -1 (ИЛ-1), ИЛ-3, ИЛ-6, ИЛ-11, факторы некроза опухолей альфа и бета, а также макрофагальный колониестимулирующий фактор активируют процессы костной резорбции. Напротив, ИЛ-4, ИЛ-10, ИЛ-13, трансформирующий фактор роста бета понижают костную резорбцию.
Ключевую роль в остеокластогенезе играют представители семейства факторов некроза опухоли: RANKL, RANK, остеопротегерин (OPG), являющиеся молекулярными посредниками других медиаторов ремоделирования костной ткани. RANKL представляет собой лиганд рецептора-активатора ядерного фактора каппа-В, экспрессируется на различных типах клеток, включая остеобласты, остеокласты, стромальные клетки, а также активированные Т-лимфоциты, эндотелиальные клетки, хондроциты и другие клетки. RANK – это функциональный рецептор-активатор ядерного фактора каппа-В. RANKL связывается с RANK на предшественниках остеокластов, стимулирует их дифференцировку и активность, ингибирует апоптоз остеокластов. OPG – «ложный» растворимый рецептор RANKL. Он является растворимым рецептором, который поступает из ряда клеток (стромальные клетки, остеобласты) во внеклеточную среду. Биологические эффекты OPG противоположны эффектам RANKL. Он конкурентно тормозит связывание RANKL с его рецептором – RANK, препятствуя его действию на костные клетки. Результатом является угнетение образования остеокластов, подавление активации зрелых остеокластов и ускорение их апоптоза. Система RANKL/RANK/OPG, а точнее баланс между продукцией RANK и OPG, занимает центральное место в регуляции резорбтивной активности остеокластов. Биосинтез указанных цитокинов и рецепторных белков находится под контролем кальцемических гормонов, а также эстрогенов, глюкокортикоидов.
Влияние образа жизни и вредных привычек на развитие остеопороза
Известно, что низкая физическая активность на протяжении многих лет способствует развитию ОП в пожилом возрасте. Неподвижный образ жизни, иммобилизация ведут к быстрой потере костной массы, обусловленной ускоренной костной резорбцией и замедленным костеобразованием. Исследования, проведенные в группе добровольцев молодого возраста, свидетельствуют, что при пребывании на постельном режиме в течение 120 суток отмечалось достоверное снижение минеральной плотности костей (МПК) в больших берцовых и бедренных костях на 4–8% в месяц, а в поясничных позвонках – со скоростью 0,9–1,7% в месяц.
Негативное влияние на кость оказывает также злоупотребление алкоголем. Алкоголизм сопровождается замедлением процессов формирования новой кости, что объясняется токсическим действием этанола на остеобласты. Определенное значение придается также функциональным и органическим нарушениям: синдрому мальабсорбции, недостаточному питанию, хроническим заболеваниям печени и органов желудочно-кишечного тракта. Известно, что у женщин, злоупотребляющих алкоголем, менопауза наступает в более ранние сроки.
Немаловажным фактором риска развития ОП является курение. По данным эпидемиологических исследований, у курящих женщин раньше наступает менопауза, выше частота компрессионных переломов позвоночника и больше потеря массы кортикальной кости в области запястья.
Отрицательное влияние на костный обмен может оказывать кофеин. Изучение метаболического баланса кальция показало, что малые количества кофеина (2 чашки кофе в день) приводят к ежедневной потере 6 мг кальция. Проведенное в 1988–1991 гг. обследование 980 женщин в периоде менопаузы выявило статистически достоверную корреляцию между увеличением потребления кофеинизированного кофе и уменьшением МПК позвоночника и проксимальных отделов бедра. Интересен тот факт, что МПК не уменьшалась, если женщины, постоянно употреблявшие кофе, ежедневно выпивали не менее стакана молока.
Патогенез и клинические проявления постменопаузального остеопороза
В патогенезе постменопаузального ОП пусковым моментом развития является дефицит эстрогенов. Он способствует продукции остеобластами фактора RANK, стимулирующего активность остеокластов и их дифференцировку, что обусловливает повышенную резорбцию кости и снижение выработки OPG – фактора, ингибирующего резорбцию костной ткани. Дефицит эстрогенов отражается на активности 1-альфа-гидроксилазы, что приводит к снижению синтеза кальцитриола и уменьшению всасывания кальция в кишечнике. Дефицит эстрогенов ведет к уменьшению секреции кальцитонина и повышенной чувствительности кости к резорбтивному действию ПТГ, что, в свою очередь, усиливает костную резорбцию. Другой непрямой механизм развития остеопении связывают с изменением продукции 1,25(ОН)2D3, что обусловлено влиянием гипоэстрогении на активность альфа-гидроксилазы в почках. В результате снижается синтез активного метаболита витамина D и уменьшается абсорбция кальция в кишечнике. Характерный низкий уровень андрогенов (из-за снижения их продукции в яичниках) с их стимулирующим влиянием на костеобразование может играть роль дополнительного механизма в развитии постменопаузального ОП.
В большинстве случаев ОП протекает бессимптомно, что позволило назвать это заболевание «безмолвной эпидемией». Часто диагноз остеопороза ставят, выявив при рентгенологическом обследовании по поводу другого заболевания костные изменения, снижение высоты тел позвонков или их клиновидную деформацию.
Наиболее яркими клиническими проявлениями ОП оказываются переломы костей без видимой причины или при минимальной физической нагрузке. Вместе с тем некоторым клиническим симптомам неспецифического характера, длительно беспокоящим больных, обычно не придается должного значения. Этими симптомами ОП являются боли в спине острого или хронического характера в грудном, пояснично-крестцовом отделе позвоночника, чувство тяжести в межлопаточной области, усталость спины. Такие боли часто усиливаются после небольшой физической нагрузки или длительного пребывания в одном положении. Наряду с этим в течение дня больным необходим многократный отдых, желательно в положении лежа. Больные с хронической болью в спине либо не обращаются к врачу, либо нередко в течение длительного времени неэффективно лечатся по поводу остеохондроза, радикулита, спондилеза и других заболеваний. Особенностью болевого синдрома при ОП является низкая эффективность современных нестероидных противовоспалительных средств. Причинами возникновения остеопоротических болей в спине как острого, так и хронического характера могут быть компрессионные переломы позвонков. При этом 2/3 таких переломов могут не вызывать боли. Большинство переломов позвонков происходит в результате компрессионной нагрузки, возникающей при подъеме даже нетяжелого груза, изменении положения тела. Причиной боли являются также микропереломы трабекул позвонков, периостальные кровоизлияния, реактивное мышечное напряжение на уровне перелома и механическое сдавление связок и мышц.
Характерным симптомом ОП является медленное снижение линейного роста и нарушение осанки. Формируется выраженный кифоз, что является причиной боли в результате давления на ребра, гребни подвздошных костей и укорочения параспинальной мускулатуры. Со стороны поясничного отдела позвоночника наблюдается выпрямление лордоза. С течением времени увеличение числа деформированных позвонков вызывает выраженную деформацию скелета.
Снижение высоты позвоночного столба проводит к уменьшению расстояния между ребрами и тазовыми костями, в результате вперед выдается живот, увеличивается внутрибрюшинное давление и нарушается легочная экскурсия. В тяжелых случаях нижние ребра практически опускаются в полость таза. Появляются выраженные кожные складки, расположенные по боковым поверхностям туловища, и исчезает линия талии. Кроме того, прогрессирует ограничение двигательной активности, и нарушается походка. Пациенты с ОП медленно и неуверенно перемещаются и имеют характерную походку – шаркающую с широко расставленными стопами («утиная походка»).
Крайне важным при обследовании больных ОП является тщательный сбор семейного анамнеза: выяснение наличия переломов различной локализации, кифотической деформации позвоночника у близких родственников.
Переломы являются поздними проявлениями ОП. Нередко переломы бывают спонтанными или обычно связаны с падением с высоты роста (на пол). Вероятность падения увеличивается с возрастом. Большинство падений связано с рядом функциональных нарушений у пациентов (изменения походки, снижение остроты зрения, мышечная слабость, нарушение равновесия и др.). Спотыкание или скольжение являются частыми причинами падений, особенно у менее пожилых пациентов.
По мере нарастания тяжести ОП увеличивается риск развития переломов. При этом заболевании наиболее часто наблюдаются переломы проксимального отдела бедра, дистального отдела предплечья и позвонков. Особое внимание, в частности, уделяется переломам бедра. Учитывая всю сложность лечения таких пациентов, высокую смертность (от 13 до 37% в течение 1 года после перелома), инвалидизацию (до 60%), стоимость проводимой терапии, нетрудно представить себе экономические последствия остеопоротических переломов и тяжесть груза социальных проблем, ассоциированных с этим осложнением ОП.
Диагностика остеопороза
Диагностика ОП, наряду с клинико-анамнестическими данными, включает денситометрическое исследование, а также ряд биохимических исследований.
Определение МПК является одним из основных методов не только диагностики, но и оценки эффективности профилактики и терапии ОП, а также его прогноза. Традиционное рентгенографическое исследование костей для диагностики начальных нарушений при ОП малоинформативно, так как рентгенологические признаки ОП выявляются лишь тогда, когда потеря костной массы значительна и составляет 25–30%. Кроме того, рентгенограммы заведомо не дают возможности количественно охарактеризовать костную массу. Поскольку терапия ОП в первую очередь направлена на сохранение или увеличение МПК, крайне важно знать исходные точные значения МПК до начала клинического обследования и определения тактики лечения.
Наиболее универсальным является применение двухэнергетической рентгеновской абсорбциометрии (DEXA), позволяющей измерять содержание костного минерала в любом участке скелета, а также определять содержание солей кальция, жира и мышечной массы во всем организме; аксиальная компьютерная томография измеряет MПK поясничных позвонков, разделяя трабекулярные и кортикальные костные структуры, измеряя объемные показатели (г/см3). Стандартными программами для DEXA-денситометров являются программы для поясничных позвонков, проксимальных отделов бедра, костей предплечья и программа «все тело».
Оценка изменений МПК производится с использованием следующих количественных критериев – T и Z. Т-критерий определяется в процентах от пика костной массы у лиц соответствующего пола и выражается в величинах стандартного отклонения (СО). Z-критерий выражается в процентах от половозрастной популяционной нормы в величинах СО от среднетеоретической нормы.
В настоящее время мы располагаем разработанными ВОЗ диагностическими критериями ОП. Согласно этим рекомендациям, диагноз ОП ставят в том случае, если МПК по Т-критерию снижена более чем на -2,5 СО. Наличие переломов в этой ситуации свидетельствует о тяжелом ОП. Для каждого одного стандартного отклонения от среднего значения пиковой костной массы риск перелома увеличивается в 2–3 раза. Состояние остеопении диагностируется, когда МПК по Т-критерию определяется в пределах от -1,0 до -2,5 СО. Значения МПК, отклоняющиеся по Т-критерию менее чем на -1 СО, расцениваются как норма.
Современная диагностика ОП включает также целый ряд лабораторных исследований, позволяющих охарактеризовать состояние минерального обмена, а также концентрации кальций-регулирующих гормонов и основных маркеров костного метаболизма. Последние показатели позволяют установить патогенетические механизмы возникновения ОП, исключить вторичные формы ОП, оценить процессы формирования и резорбции костной ткани и особенности метаболических изменений в ней. Различают биохимические маркеры костеобразования, характеризующие функцию остеобластов, и маркеры костной резорбции, характеризующие функцию остеокластов. Использование современных биохимических маркеров костного ремоделирования позволяет выбрать адекватное лечение и оценить его эффективность в динамике. Повторное определение уровня костных маркеров, позволяющее судить об эффективности проводимой терапии, обычно проводится через 2–3 месяца терапии ОП. Кроме того, биохимические маркеры используются для решения вопроса о необходимости лекарственной терапии у женщин после менопаузы: чем выше значения костного метаболизма и чем ниже величина костной плотности по сравнению с нормальными значениями, тем больше необходимость назначения лекарственной терапии. К костным маркерам, позволяющим оценивать костеобразование, относятся общая и костноспецифическая щелочная фосфатаза, остеокальцин и бета-изомер С-терминального телопептида молекулы коллагена I типа (Стх). Все маркеры костеобразования измеряются в сыворотке крови.
Известно, что поздняя диагностика и несвоевременное начало терапии ОП характерны для 75% женщин и 90% мужчин. Приоритетной задачей практической медицины является не только своевременная диагностика, но и адекватное лечение ОП и его осложнений – остеопоротических переломов, – порой имеющих фатальный характер. Разрешению этой задачи, несомненно, способствует более широкое информирование как врачей различных специальностей, так и населения о проблеме ОП. Активная профилактика ОП является ключевой задачей в проблеме предупреждения переломов и инвалидности.
В настоящее время существуют эффективные программы профилактики и лечения ОП, включающие сочетание нефармакологических методов с современными противоостеопоротическими препаратами. Ранняя профилактика и лечение ОП позволяют замедлить развитие заболевания, снизить частоту переломов костей и улучшить качество жизни пациента. Вопросы профилактики ОП нами широко освещались ранее, поэтому в рамках данной статьи мы предпочли представить современную терапию ОП с главной целью – предупредить переломы костей.
Лечение и профилактика остеопороза
Основными целями фармакотерапии остеопороза являются:
нормализация процессов костного ремоделирования;
замедление или прекращение потери массы кости (в идеале – ее прирост);
предотвращение возникновения новых переломов костей;
уменьшение болевого синдрома, расширение двигательной активности.
Существуют разные подходы к медикаментозному лечению пациенток с ОП. Они основаны на применении бисфосфонатов, стронция ранелата (препарат Бивалос) и деносумаба. Длительное и широкое применение антирезорбтивных препаратов показало, что они эффективно уменьшают скорость ремоделирования костной ткани, но при этом не приводят к увеличению костной массы. Это значит, что повышение МПК обусловлено активной вторичной минерализацией низкой костной массы, а не ее увеличением. В исследовании продолжительностью 1 год у 10 пациенток с постменопаузальным ОП были взяты биопсийные образцы костной ткани из области подвздошного гребня на исходном этапе и через 1 год применения стронция ранелата в дозе 2 г/сут. До этого все пациентки принимали бисфосфонаты в течение почти 3 лет. Через 1 год применения стронция ранелата отмечено выраженное увеличение относительного объема трабекулярной кости (реальное увеличение на 30%), а также увеличение толщины трабекул (на 10%). Эти изменения обусловлены образованием новой костной ткани.
Стронция ранелат представляет собой инновационный подход к лечению ОП, когда одномоментно стимулируется синтез костной ткани и подавляется костная резорбция. Это приводит к восстановлению баланса костного метаболизма в пользу формирования новой костной ткани.
Молекула стронция ранелата (Бивалос) состоит из двух атомов стабильного, нерадиоактивного стронция и органического основания – ранеловой кислоты.
Именно компоненты стронция, образующиеся в ходе распада
Бивалоса в желудочно-кишечном тракте, обладают фармакологической активностью и тем самым влияют на метаболизм костной ткани. Ранеловая кислота не метаболизируется и выводится из организма в неизмененном виде. Двойной механизм действия Бивалоса изменяет баланс костного метаболизма в пользу образования костной ткани.
Стронция ранелат оказывает прямое действие на костеобразующие клетки, остеобласты. Показано, что in vitro стронция ранелат усиливает репликацию клеток-предшественников остеобластов, что приводит к интенсивному синтезу костного матрикса, стимулируется синтез коллагена в костной ткани. Возможно, что синтез коллагена опосредуется через рецептор чувствительности к кальцию (CaSR).
Стронция ранелат оказывает прямое действие также на остеокласты, подавляя дифференцировку клеток-предшественников, что проявляется угнетением активности костной резорбции.
Особо следует отметить, что Бивалос улучшает в том числе и микроархитектуру костной ткани (трабекулярной и кортикальной), не влияя на физиологические механизмы минерализации кости.
При проведении трехмерной реконструкции костной ткани с помощью метода микрокомпьютерной томографии на 41 биопсийном образце подвздошной кости, полученном у женщин с постменопаузальным ОП, отмечено увеличение числа трабекул на 14% (p = 0,05), уменьшение межтрабекулярных пространств на 16% (p = 0,04) и улучшение индекса трабекулярной структурной модели на 22% (p = 0,01).
Наряду с этим в группе стронция ранелата отмечено достоверное увеличение толщины кортикального слоя кости на 18%. Считается, что стронция ранелат является по сути единственным антиостеопоротическим препаратом, который способствует увеличению толщины кортикального слоя кости (727 против 615 мкм; p = 0,008).
Более того, даже у пациенток, которые продолжают подвергаться высокому риску, несмотря на ранее проводившееся длительное лечение бифосфонатами, стронция ранелат способен перезапустить процесс обновления костной ткани.
Эффективность и безопасность стронция ранелата изучалась в течение 10-летнего приема препарата. Кумулятивная частота возникновения новых переломов позвонков и внепозвоночных переломов на протяжении этого периода достоверно не отличалась от эффекта стронция ранелата, наблюдавшегося в первые 3 года терапии в исследованиях SOTI/TROPOS, несмотря на повышение риска вследствие старения наблюдаемых женщин.
Таким образом, большие успехи клинической медицины за последние годы в области лечения ОП привели к разработке и широкому внедрению современных принципов диагностики и лечения заболевания. Хорошо очерчены факторы риска, что позволяет проводить грамотные профилактические мероприятия. Между тем число людей, знающих о возможности такой профилактики и лечебной тактики при выявлении риска заболевания, невелико даже среди медицинских работников. Соответственно, если лица с медицинским образованием, осведомленные о проблеме ОП, не занимаются профилактикой перелома у себя, то можно ли предполагать, что они займутся профилактикой ОП и переломов среди населения?
Не вызывает сомнений, что ОП недостаточно диагностируется и недостаточно лечится (рис. 3). Международный фонд остеопороза (International Osteoporosis Foundation, IOF) провел рентгенологическое исследование позвоночника среди 903 женщин старше 60 лет (2000). В заключении локального рентгенолога было указано наличие 65 переломов позвонков, в то время как приглашенным высококвалифицированным рентгенологом выявлено 132 перелома. Вызывает тревогу и то, что лечащие врачи этих пациентов лишь в 23 случаях в выписке из истории болезни указали на наличие перелома позвоночника у пациенток, а лечение, в конечном счете, получали лишь 25 пациенток (19%).
В связи с этим нами было проведено клиническое исследование, цель которого заключалась в уточнении причин невнимательного отношения медицинских работников к такой междисциплинарной проблеме, как остеопороз. В рамках исследования проводилась оценка состояния скелета и скорости костного ремоделирования у женщин в менопаузе, имеющих медицинское образование.
Для участия в исследовании были приглашены женщины с медицинским образованием, работающие в ФГЛПУ «Поликлиника Минэкономразвития России» г. Москвы, в ГКБ № 63 Департамента здравоохранения г. Москвы, в Стоматологическом комплексе при ГБОУ ВПО МГМСУ г. Москвы, в Удельнинской поликлинике Раменского района Московской области.
Критериями включения в исследование являлись: женский пол, возраст старше 50 лет, менопауза в течение 5 лет и более, медицинское образование. Критериями невключения в исследование являлись: подозрение на вторичный остеопороз, первичный и вторичный гиперпаратиреоз, остеомаляция, подозрение на метастатическое поражение костей, миеломная болезнь, венозные тромбоэмболии (в том числе в анамнезе), почечная недостаточность, повышенная чувствительность к стронция ранелату, гиперкальциемия, нефролитиаз, активный туберкулез, саркоидоз, синдром мальабсорбции. Критериями исключения из исследования являлись: появление побочных эффектов от приема стронция ранелата (тошнота, диарея, головные боли, раздражение кожи), появление побочных эффектов от приема препарата Кальций-Д3 Никомед Форте (запоры, диарея, метеоризм, тошнота, боль в животе, гиперкальциемия), отказ от приема препаратов кальция и витамина D3 и стронция ранелата.
На этапе скрининга лицам, которые соответствовали критериям включения, предлагалось ответить на вопросы анкеты, чтобы выявить у них факторы риска ОП и переломов. Посредством анкетирования для дальнейшего участия было отобрано 68 человек с высоким риском развития ОП и переломов. Им была выполнена двухэнергетическая рентгеновская абсорбциометрия поясничного отдела позвоночника и бедра (DEXA).
По результатам DEXA (рис. 4) остеопороз (Т-критерий -2,5 СО и ниже) был выявлен у 20 человек (30%). 22 человека (32%) имели нормальную МПК (Т-критерий от +2,5 до -1 СО от пиковой костной массы). У 26 человек (38%) была выявлена остеопения (Т-критерий от -1 до -2,5 СО).
Из 68 человек, прошедших денситометрию, 40 человек составляли медицинские сестры, 24 человека – врачи различных специальностей и 4 человека – врачи-стоматологи (рис. 5).
Таким образом, у приблизительно 68% включенных в исследование женщин при проведении денситометрического исследования были выявлены нарушения со стороны МПК в виде остеопении и остеопороза. Лишь 1/3 женщин в возрасте старше 50 лет, находящихся в менопаузе не менее 5 лет, имели нормальную МПК.
Возраст участвовавших в исследовании пациенток составлял в среднем: 61,8 лет (от 52 до 74 лет) в группе с нормальной МПК, 60,7 лет (от 53 до 75 лет) – с остеопенией, 62,5 года (от 55 до 73 лет) – с остеопорозом. Статистического различия по возрасту между группами не обнаружено.
При анализе индекса массы тела (ИМТ) выяснилось, что у женщин с нормальной МПК этот показатель составил 32,3 кг/см2, у женщин с остеопенией – 27,3 кг/см2, а у пациенток с ОП – 26,6 кг/см2. ИМТ женщин с нормальной МПК был cтатистически достоверно выше (p
Длительность менопаузы у женщин с нормальной МПК составляла 9,78 лет (от 5 до 18 лет), у женщин с остеопенией – 10,4 лет (от 5 до 22 лет), а у пациенток с остеопорозом – 13,35 лет (от 5 до 26 лет). Таким образом, длительность менопаузы женщин с ОП была достоверно дольше (p
При анализе профилактических антиостеопоротических мер выяснилось, что 11 пациенток до участия в исследовании эпизодически принимали препараты кальция и витамина D3. Из них у 1 женщины впоследствии была выявлена нормальная МПК, у 2 – остеопения, у 8 – остеопороз.
По результатам анкетирования жалобы, возможно связанные с ОП, такие как боль в спине, ограничение движений из-за болей в спине, уменьшение роста, кифоз, отмечали у себя 10 человек с нормальной МПК, 10 человек с остеопенией и 14 человек, у которых впоследствии был выявлен ОП.
Переломы при минимальной травме в менопаузе имели 7 женщин с ОП, причем 4 из них – более одного перелома. У пациенток с нормальной МПК и остеопенией переломов не выявлено.
Три женщины с ОП, 3 с остеопенией и 1 женщина с нормальной МПК курили. 4 пациентки с ОП и 1 женщина с нормальной МПК плохо переносили молоко и молочные продукты, в связи с чем их использование было ограничено.
Среди сопутствующих заболеваний отмечались: ревматоидный артрит, артрозы, гипертоническая болезнь, ИБС, язвенная болезнь желудка, хронический бронхит, анемия, узловой нетоксический зоб, гипотиреоз в стадии медикаментозной компенсации.
К дальнейшему участию в исследовании были привлечены 20 женщин с ОП (Т-критерий -2,5 СО и ниже). Им проводился стандартный клинический осмотр, общий анализ крови, общий анализ мочи, электрокардиография (ЭКГ), биохимия крови (креатинин, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), МВ-фракция креатинкиназы (КФК-МВ), кальций ионизированный, фосфор, холестерин общий, триглицериды, липопротеиды низкой плотности (ЛПНП), липопротеиды высокой плотности (ЛПВП), С-пептид), маркеры костного метаболизма (остеокальцин, СТх), гормональное исследование (ПТГ, эстрадиол, лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ)). Данные первичных исследований не выявили значимых отклонений в состоянии здоровья и противопоказаний к приему антиостеопоротических препаратов. Все женщины находились в постменопаузальном периоде, что было подтверждено исследованием эстрадиола, ЛГ и ФСГ. Показатели фосфорно-кальциевого обмена (кальций ионизированный, фосфор, ПТГ) были в пределах нормы.
У всех 20 женщин был диагностирован постменопаузальный ОП. Они были приглашены к дальнейшему участию в исследовании, а именно к этапу лечения. Из 20 женщин только 16 согласились принимать дальнейшее участие в исследовании. Им был назначен препарат стронция ранелат (Бивалос®) 2 г/сут на ночь в сочетании с препаратом кальция 1000 мг/сут и витамина D3 800 МЕ/сут (Кальций-Д3 Никомед Форте®) на 1 год. Из 16 пациенток 3 прекратили прием препаратов до окончания срока клинического исследования и были исключены из дальнейшего участия, 1 пациентка принимала препарат в течение года, но отказалась проходить контрольное обследование по окончании исследования и была исключена из статистики. Во время годового приема препаратов побочных эффектов не наблюдалось ни у одной из пациенток.
Таким образом, 12 пациенток прошли полный годичный курс приема препаратов и были приглашены на контрольное обследование. Им проводилась двухэнергетическая рентгеновская абсорбциометрия поясничного отдела позвоночника и бедра, а также определялись маркеры костного метаболизма: остеокальцин, СТх.
По данным DEXA поясничного отдела позвоночника до и после годового лечения было выявлено, что общий прирост Т-критерия у обследованных пациенток в среднем составил 25,5% (от 3,8% до 100%).
При этом у 9 пациенток выявлен прирост Т-критерия на 28,5%, а у одной – снижение на 5%. У 2 пациенток данные Т-критерия и МПК не принимались в расчет из-за выраженной деформации позвоночника.
МПК в области поясничного отдела позвоночника у всех пациенток в среднем выросла с 0,793 до 0,849 г/см2. Общий прирост в среднем составил 0,056 г/см2, или 7,1% (рис. 6).
При этом у 9 пациенток с улучшением показателей МПК в области поясничного отдела позвоночника в среднем выросла с 0,789 до 0,852 г/см2. Общий прирост в среднем составил 0,063 г/см2, или 8,0% (от 0,5% до 30,2%).
У 1 пациентки с ухудшением показателей МПК в области поясничного отдела позвоночника снизилась с 0,831 до 0,821 г/см2, то есть на 0,01 г/см2, или 4,5%. Следует отметить, что изначально данная пациентка имела остеопоротические показатели МПК именно в области позвоночника, а в шейке бедра показатели соответствовали остеопении (в результате лечения показатели МПК в области шейки бедра улучшились).
В среднем МПК в области шейки бедра у всех пациенток увеличилась с 0,615 до 0,641 г/см2, то есть на 0,026 г/см2, или 4,2% (рис. 7).
По данным двухэнергетической рентгеновской абсорбциометрии проксимального отдела бедра выяснилось, что в области шейки бедра улучшение показателей наблюдалось у 8 человек, в то время как ухудшение – у 4.
У 8 пациенток с улучшением показателей средний Т-критерий в области шейки бедра увеличился с -2,39 до -1,95 СО, то есть на 18,3% (от 3,5% до 58,8%), а МПК выросла в среднем с 0,582 до 0,633 г/см2. Таким образом, общий прирост МПК в среднем составил 0,051 г/см2, или 8,8% (от 2,2% до 16,8%).
У 4 пациенток наблюдалось незначительное снижение показателей среднего Т-критерия в области шейки – от -1,5 до -1,7 СО, что составило 13,3% (от 6,7% до 25%), а МПК – с 0,681 до 0,658 г/см2. Таким образом, у этих пациенток общее снижение МПК в среднем составило 0,023 г/см2, или 3,4% (от 0,9% до 5,8%).
При этом в результате лечения в целом по группе показатель МПК в общем бедре увеличился с 0,763 до 0,782 г/см2, то есть на 0,019 г/см2, или 2,5% (рис. 8).
Общие показатели в бедре улучшились у 8 пациенток, остались без динамики у 1 и ухудшились у 3 пациенток.
У 8 пациенток с улучшением показателей средний Т-критерий в общем бедре увеличился от -1,6 до -1,4 СО, то есть на 12,5% (от 4,8% до 44%), а МПК выросла в среднем с 0,747 до 0,78 г/см2. Таким образом, общий прирост МПК в среднем составил 0,033 г/см2, или 4,4% (от 0,5% до 7,0%).
У 3 пациенток наблюдалось незначительное снижение показателей среднего Т-критерия в общем бедре от -1,2 до -1,3 СО, что составило 8,3% (от 6,3% до 9,5%), а МПК – с 0,794 до 0,783 г/см2. Таким образом, общее снижение МПК в среднем составило 0,011 г/см2,
или 1,4% (от 0,7% до 2,0%).
Стоит отметить, что изначально, до лечения, остеопороз в области бедра и его шейки диагностирован у 4 пациенток и именно у них выявлено улучшение показателей МПК. Снижение же показателей МПК отмечено у пациенток, изначально имевших остеопению или нормальные показатели МПК в области бедра, но ни у кого из них показатели не опустились до значения -2,5 и менее СО.
По данным исследований маркеров метаболизма костной ткани (остеокальцин, СТх) выявлено, что значение остеокальцина в среднем до лечения составляло 27,79 нг/мл, после лечения – 25,56 нг/мл (рис. 9). Таким образом, снижение показателя на фоне терапии составило 2,23 нг/мл (8,0%).
В ходе исследования у 3 пациенток показатель остеокальцина вырос в среднем с 25,63 до 28,18 нг/мл, то есть на 9,9% (от 5,7% до 12,4%), а у 9 пациенток снизился в среднем с 28,51 до 24,96 нг/мл, или на 13,4% (от 3,8% до 34,1%).
Значение СТх в среднем до лечения составляло 0,56 нг/мл, после лечения – 0,54 нг/мл (рис. 10). Снижение показателя составило 0,02 нг/мл (3,6%).
У 5 пациенток в ходе исследования показатель СТх вырос в среднем с 0,464 до 0,588 нг/мл, то есть на 25,3% (от 6,7% до 74%), а у 7 пациенток снизился в среднем с 0,63 до 0,51 нг/мл, или на 19% (от 11% до 44,4%).
Отметим, что изменения показателей метаболизма костной ткани как в сторону уменьшения, так и в сторону увеличения никак не соотносились с увеличением или уменьшением МПК.
Заключение
Таким образом, распространенность ОП у женщин в менопаузе, имеющих медицинское образование, соответствует распространенности ОП у женщин в менопаузе в популяции в целом.
Ни одна из женщин-медиков с ОП не получала эффективного лечения. Это говорит о низкой информированности об ОП не только женщин в популяции, но и врачей и медицинских сестер.
Комбинация стронция ранелата (Бивалос) и препаратов кальция и витамина D3 привела к повышению МПК у пациенток как в области позвоночника, так и в шейке бедра. Отрицательная динамика, наблюдавшаяся у трех пациенток, была обусловлена низкой приверженностью к терапии (периодически забывали принимать препарат). Отмечена безопасность и хорошая переносимость стронция ранелата. Ни у одной из пациенток не отмечено нежелательных явлений на фоне терапии. Наблюдение за пациентками продолжается.
1. Михайлов Е.Е., Беневоленская Л.И., Мылов Н.М. Рас- пространенность переломов позвоночника в популяционной выборке лиц 50 лет и старше // Вестник травматологии и ортопедии им. н.н. Приорова. 1997. No 3. С. 20–27.
2. Ahmed A.I., Blake G.M., Rymer J.M. et al. Screening for osteopenia and osteoporosis: do the accepted normal ranges lead to overdiagnosis? // Osteoporos. Int. 1997. Vol. 7. No 5. P. 432–438.
3. Михайлов Е.Е., Беневоленская Л.И., Баркова Т.В. Эпидемио- логическая характеристика переломов конечностей в попу- ляционной выборке лиц 50 лет и старше // Остеопороз и остеопатии. 1998. No 2. С. 2–6.
4. Меньшикова Л.В., Храмцова Н.А., Ершова О.Б. и др. Ближайшие и отдаленные исходы переломов проксимального отдела бедра у лиц пожилого возраста и их медико-социальные последствия (по данным многоцентрового исследования) // Остеопороз и остеопатии. 2002. No 1. С. 8–11.
5. Лесняк О.М. Фармакоэкономика средств профилактики и лечения остеопороза // Руководство по остеопорозу. М.: Бином, 2003. С. 469–481.
6. Ершова О.Б., Семенова О.В., Дегтярев А.А. Результаты про- спективного изучения исходов переломов проксимального отдела бедра // Остеопороз и остеопатии. 2000. No 1. С. 9–10.
Новости на тему
21.02.2022
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.